HSS сталь: марки, характеристики, расшифровка, твердость, применение, аналоги, покрытия
- Общие характеристики
- Особенности изготовления и термообработки
- Методы улучшения характеристик
- Легирование HSS сталей
- Маркировка
- Разновидности
- Виды покрытий и напылений
- Области применения
- Отличия HSS стали от углеродистой инструментальной и твердых сплавов
Общие характеристики HSS сталей
Сталь HSS применяют для производства инструмента, предназначенного для высокоскоростной обработки металлических заготовок. Быстрорежущая сталь HSS обладает отличными эксплуатационными свойствами, которые выделяют материал среди углеродистых аналогов и твёрдых сплавов.
Высокоскоростные режимы резания
Изготовленный из HSS стали инструмент без повреждения и деформации применяют для высокоскоростной обработки различных материалов, в том числе, при прерывистых режимах резания. Это единственный тип стали, справляющийся с такими нагрузками.
Это единственный тип стали, справляющийся с такими нагрузками.
Сопротивление к механическим воздействиям и разрушению
Быстрорежущая сталь в минимальной степени подвержена хрупкому разрушению, которое характерно для материалов высокой твёрдости. Этот показатель определяется при изгибе призматических образцов, а также при медленно нарастающих и быстрых нагрузках. Чем выше значения сопротивляемости, тем большую скорость подачи инструмента и глубину резания можно использовать.
Горячая твёрдость при нагреве
В нормальных условиях твёрдость углеродсодержащей стали выше, чем у быстрорежущей. Однако в процессе обработки металлической заготовки происходит значительная теплоотдача, что запускает процессы отпуска и снижает первоначальную прочность. У углеродистой стали температурный порог теплостойкости составляет 200 градусов. HSS сталь способна сохранять свои свойства при температурах 500-600 градусов.
Красностойкость 4 часа
Основное достоинство быстрорежущих сталей – красностойкость. Этот параметр определяет, в течение какого времени сталь способна сохранять прочность при высокотемпературном воздействии и сколько времени сталь способна выдерживать температурные нагрузки.
Этот параметр определяет, в течение какого времени сталь способна сохранять прочность при высокотемпературном воздействии и сколько времени сталь способна выдерживать температурные нагрузки.
Благодаря легирующим и функциональным присадкам (кобальт, хром, вольфрам, молибден, ванадий), стали марки HSS выдерживают воздействие температуры в 600-650 градусов в течение 4 часов с полным сохранением показателей прочности.
Особенности изготовления и термообработки HSS сталей
При изготовлении быстрорежущих сталей применяют несколько технологий, при этом особое внимание уделяется проковке. Именно от прокованности зависит качество материала, а при недостаточной проковке – происходят процессы карбидной ликвации.
Для повышения эксплуатационных свойств и характеристик стали HSS проходят обязательную термическую обработку с использованием трёх базовых методик:
- Отжиг. Способствует устранению внутренних натяжений материала, улучшает обрабатываемость сплава и последующую закалку.

- Закалка. Способствует повышению красностойкости стали. Закаливается материал при температуре +1300 градусов, превышение этого режима не допускается, чтобы избежать появления оплавлений и зернистости. Поэтому температура закалки всегда выдерживается с максимальной точностью.
- Отпуск. Под этим определением понимается цикличное охлаждение до температуры 550-560 градусов. Отпускается сплав с периодичностью в 60 минут.
Комментарий: Инструмент из стали HSS используют для обработки металлических заготовок на высоких скоростях
Методы улучшения технических характеристик
Для повышения износоустойчивости применяют дополнительные способы химико-термической обработки. Суть процесса заключается в добавлении в структуру сплава усиливающих компонентов, которые проникают в молекулярно-кристаллическую решётку.
3 метода улучшения эксплуатационных характеристик:
- Азотирование.
 Выдержка в газовой среде с целью насыщения материала азотом. Происходит при температуре 500-600 градусов, в течение 10-40 минут. Процесс способствует укреплению поверхностных слоёв.
Выдержка в газовой среде с целью насыщения материала азотом. Происходит при температуре 500-600 градусов, в течение 10-40 минут. Процесс способствует укреплению поверхностных слоёв. - Цианирование. Насыщение цинком в жидкой или газовой среде для повышения показателей износоустойчивости. Процесс может быть высокотемпературным или низкотемпературным.
- Сульфидирование. Нагрев в серно-азотистой соли, что способствует насыщению серой, повышает прочность и износостойкость режущих кромок.
Легирование HSS сталей
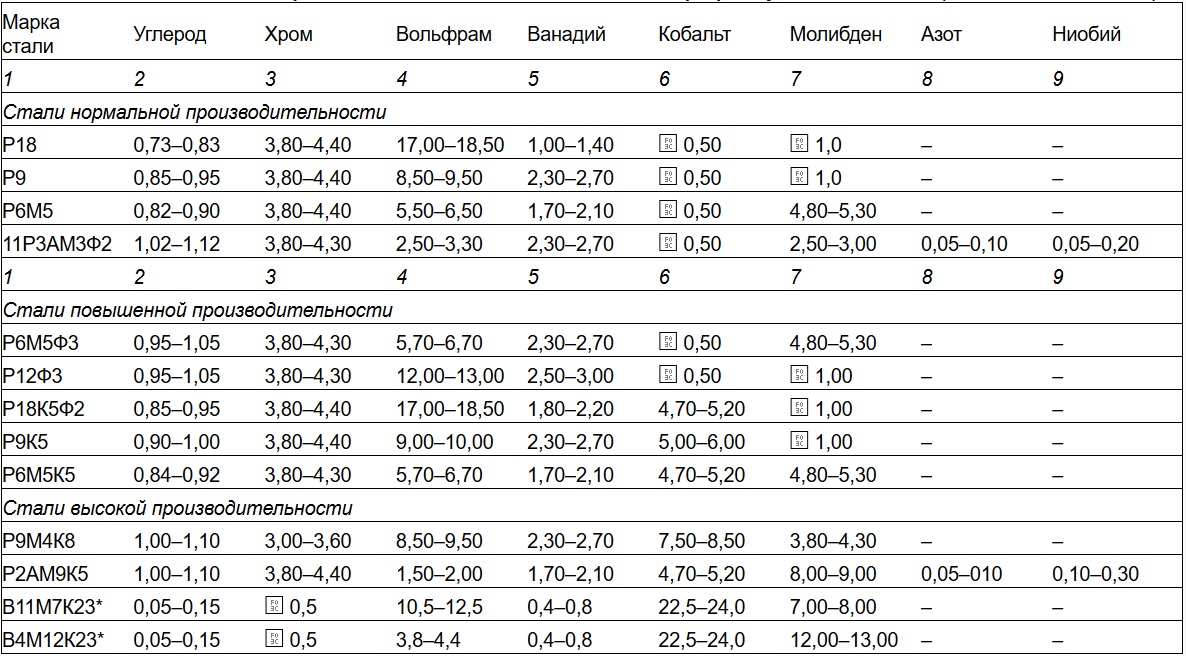
Легированием называют ряд технологических процедур, которые необходимы для ввода в состав сплава различных примесей, способствующих улучшению химического состава. Легирование позволяет быстрорежущей стали сохранять твердость при высоких температурах. Легирование выполняется карбидообразующими элементами (вольфрам, молибден, ванадий, хром, кобальт, марганец, никель, титан), что существенно повышает красностойкость.
Лучшие эксплуатационные характеристики у сталей с присадкой кобальта, однако это самый дорогой элемент.
Главными задачами легирования являются:
- Повышение конструкционной прочности;
- Улучшение ударной вязкости;
- Повышение жаропрочности и коррозийной устойчивости;
- Улучшение прокаливаемости.
Компонент, выбранный производителем для легирования, всегда указывают в маркировке. Обычно для этого используется первая буква названия легирующего элемента. Например, для марганца это «М», для вольфрама «В» и так далее.
Маркировка быстрорежущих сталей
Отличия между быстрорежущими инструментальными сталями определяются маркировкой:
- HSS-R (или сталь HSS) – указывается на изделиях, выпускающихся методом роликового проката и отличающихся наименьшими показателями прочности;
- HSS CO – основным легирующим элементом является кобальт;
- HSS-G – рабочая часть шлифуется кубическим нитридом бора, что повышает механическую прочность, снижая биение при работе;
- HSS-E – используют для обработки сложных заготовок с повышенной вязкостью;
- HSS-G TiN – изделия с нитрид-титановым напылением.
 Сталь HSS TiN отличается высокими показателями прочности и термоустойчивости.
Сталь HSS TiN отличается высокими показателями прочности и термоустойчивости. - HSS-G TiAlN – материал с хорошей механической прочностью за счет покрытия из нитрида титан-алюминия;
- HSS-E VAP – функциональное покрытие для нержавейки, которое снижает скапливание стружки.
Российский аналог стали HSS маркируется иным способом. Быстрорежущий сплав обозначается литерой «Р», что означает rapid steel. После основной марки указывают основной легирующий элемент, который используется для повышения технических характеристик:
- М – молибден;
- Ф – ванадий;
- К – кобальт.
Цифровые обозначения указывают на процентное соотношение химических элементов. Например, сталь HSS Р6М5. В этой марке стали 6% вольфрама и 5% молибдена.
Важно понимать, что во всех быстрорежущих сталях всегда присутствует хром, но в маркировке этот элемент не указывается.
Фрезы из быстрорежущей стали
Короткие сверла HSS до 3XD
Сверла HSS стандартной длины 5XD-8XDДлинные сверла HSS 8XD – 12XD
Центровки из быстрорежущей стали
221430 HSSCo5
Разновидности быстрорежущих сталей
По основному химическому элементу, который используется для легирования, быстрорежущие инструментальные стали делятся на 3 основные категории: молибденовые, вольфрамовые и высоколегированные. Рассмотрим действующую классификацию более детально.
Рассмотрим действующую классификацию более детально.
Молибденовые
Для обозначения этого типа стали используется литера «М». Материал содержит молибден, что делает инструмент пригодным для эксплуатации при низких температурах. Из молибденовой HSS стали изготавливают штампы и накатные плашки. Для увеличения ударной вязкости термообработка закаливанием проводится при низких температурах.
Таблица компонентного состава молибденовой инструментальной стали
| Маркировка | Отечественный аналог | C | Mn | Si | Cr | V | W | Mo | Co | Ni |
| М1 | 0.80 | 4 | 1 | 1.5 | 8 |
|
|
|||
| М2 | Р6М5 | 0. 85 85 |
|
|
2 | 6 | 5 |
|
||
| М3 | Р6М5Ф3 | 1.20 |
|
|
3 |
|
|
|||
| М4 |
|
1.30 |
|
|
4< | 5.5 | 4.5 |
|
|
|
| М6 |
|
0. 80 80 |
|
|
2 | 4 | 5 |
|
|
|
| М7 |
|
1 |
|
|
1.75 | 8.75 |
|
|
||
| М10 |
|
0.85-1 |
|
|
|
8 |
|
|
||
| М30 |
|
0. 80 80 |
|
|
1.25 | 2 |
|
|
||
| М33 |
|
0.90 |
|
|
1.15 | 1.5 | 9.5 |
|
|
|
| М34 |
|
|
|
2 | 2 | 8 |
|
|
||
| М35 | Р6М5К5 | 0. 82-0.88 82-0.88 |
0.15-0.40 | 0.20-0.45 | 3.75-4.50 | 1.75-2.2 | 5.5-6-75 | 5 | 4.5-5.5 | Не более 0.30 |
| М36 |
|
0.80 |
|
|
4 | 2 | 6 |
|
|
Вольфрамовые
Считаются дорогостоящими по причине дефицита вольфрама и его высокой стоимости. Эта инструментальная сталь маркируется литерой «Т». Среди выпускаемых видов сплавов этой группы реже всего используют Т1 и Т15.
Материал относится к сталям нормальной производительности, основная область применения которой – производство резцов, фрез и зенкеров. Компонентный состав стали регулируется требованиями ГОСТ и международными стандартами качества.
Таблица вольфрамовых HSS сталей
| Маркировка | Отечественный аналог | C | Cr | V | W | Co |
|
Т1 |
Р18 |
0.75 |
4 |
1 |
18 |
|
|
Т2 |
Р18Ф2 |
0.80 |
2 |
|
||
|
Т4 |
Р18К5Ф2 |
0. |
1 |
5 |
||
|
Т5 |
|
0.80 |
2 |
8 |
||
|
Т6 |
|
4.5 |
1.5 |
20 |
12 |
|
|
Т8 |
|
0.75 |
4 |
2 |
14 |
5 |
|
Т15 |
Р12Ф5К5 |
1. |
5 |
12 |
Высоколегированные
Многокомпонентные составы, отличающиеся повышенной стойкостью к изгибу и кручению. Из преимуществ можно выделить равномерное перераспределение карбидов, что обеспечивает хорошую теплостойкость и отличную механическую прочность после закалки.
Целевое назначение – производство метчиков, резцов для обработки высокопрочных сплавов с высокой скоростью резания, сверл, фрез. Для маркировки сплава используется литера «М».
Таблица соотношения легирующих компонентов и присадок в высоколегированных HSS сталях
| Маркировка | Отечественный аналог | C | Mn | Si | Cr | V | W | Mo | Co< | Ni |
|
М41 |
Р6М3К5Ф2 |
1. |
|
|
4.25 |
2 |
6.75 |
3.75 |
5 |
|
|
М42 |
|
3.75 |
1.15 |
1.5 |
9.5 |
8 |
|
|||
|
М43 |
|
1. |
1.60 |
2.75 |
8 |
8.25 |
|
|||
|
М44 |
|
1.15 |
4.25 |
2 |
5.25 |
6.25 |
12 |
|
||
|
М46 |
|
1.25 |
4 |
3. |
2 |
8.25 |
8.25 |
|
||
|
М47 |
Р2АМ9К5 |
1.10 |
3.75 |
1.25 |
1.5 |
9.5 |
5 |
|
||
|
М48 |
|
1.42-1.52 |
0.15-0.40 |
0.15-0.40 |
3. |
2.75-3.25 |
9.5-10.5 |
0.15-0.4 |
8-10 |
Не более 0.3 |
|
М50 |
|
0.78-0.88 |
0.15-0.45 |
0.20-0.60 |
3.75-4.5 |
0.8-1.25 |
Не более 0.10 |
3.9-4.75 |
|
|
|
М52 |
|
0. |
3.5-4.3 |
1.65-2.25 |
0.75-1.5 |
4-4.9 |
|
|||
|
М62 |
|
1.25-1.35 |
0.15-0.40 |
0.15-0.40 |
3.5-4 |
1.8-2 |
5.75-6.5 |
10-11 |
|
Комментарий: Напыления и покрытия улучшают эксплуатационные характеристики инструмента из HSS стали
Виды покрытий и напылений HSS стали
Для улучшения структуры стали и повышения эффективности инструмента используется специальное напыление. Покрытия повышают эксплуатационные характеристики и позволяют работать инструментом без использования смазывающе-охлаждающих жидкостей (СОЖ).
Покрытия повышают эксплуатационные характеристики и позволяют работать инструментом без использования смазывающе-охлаждающих жидкостей (СОЖ).
Популярные типы покрытий быстрорежущих сталей:
- TiN, Balinit – однослойное покрытие из нитрида титана. Напыление имеет золотистый цвет, способствует повышению поверхностной прочности и внутренней упругости. В среднем, скорость резания увеличивается на 60%, а фрикционный коэффициент снижается до 0.4.
- TiAlN, FNT – нитрид титана, дополнительно легированный алюминием. Наноструктурированный слой почти чёрного цвета. Наносят для повышения термической устойчивости и механической прочности.
- TiAlN, Balinit Х.TREME – однослойное напыление нитрида алюмо-титана. Наносится для инструмента, работающего в тяжёлых условиях резания. Покрытие повышает прочность до 3 500 HV.
- Black (OX, Black Oxide) – оксидная плёнка, которая используется на метчиках и свёрлах. Покрытие мелкопористое, что хорошо удерживает смазку на поверхности инструмента.
 Покрытие повышает коррозийную устойчивость и исключает перегрев даже при высоких скоростях резания.
Покрытие повышает коррозийную устойчивость и исключает перегрев даже при высоких скоростях резания. - TiC – карбид-титановое напыление, снижающая склонность инструмента к разрушению.
- TiCN, Balinit B – многослойное покрытие из карбонитрида титана. Напыление снижает фрикционный коэффициент, увеличивая поверхностную твёрдость и показатели термической устойчивости.
- TiALN+WC/C, HL – тёмно-серое напыление, выполненное алюмонитридом титана. Покрытие многослойное, увеличивает эксплуатационные характеристики инструмента.
- CrN – серебристо-серое напыление из нитрида хрома. Напыление отличается оптимальным соотношением твёрдости-пластичности, предотвращает появление трещин даже при цикличных нагрузках. Допускает применение СОЖ с повышенной агрессивной активностью.
- AlCrN – хромонитрид алюминия, который наносится тонким слоем, окрашивая поверхность в серо-синий цвет. Повышает термостойкость до температуры +1100 градусов, а поверхностную твёрдость – до 3 200 HV.

Области применения быстрорежущих сталей
Что делают из быстрорежущих сталей? Материал используют преимущественно для изготовления концевого инструмента, а также сменных твердосплавных насадок для токарных резцов.
Основные сферы применения быстрорежущих сталей на примере российских аналогов:
- Р9 – изделия элементарной формы: зенкеры, резцы, фрезы;
- Р18 – фасонный инструмент для нарезания резьбы и создания метрических зубьев;
- Р9К5 – используются для точения жароустойчивых и высокопрочных сталей;
- Р9Ф5 – походят для производства протяжек, развёрток;
- Р9М4 – используются для производства инструмента, предназначенного для первичной обработки.
Отличия HSS стали от углеродистой инструментальной
Углеродистые легированные и быстрорежущие стали различаются областью применения. Инструментальные легированные стали с высоким содержанием углерода маркируются литерой «У». Из этого материала изготавливается инструмент для деревообработки и резания полимерных материалов. Также сталь этой группы идёт на изготовление слесарного инструмента: спиральных свёрл, шаберов, напильников, ножовок.
Из этого материала изготавливается инструмент для деревообработки и резания полимерных материалов. Также сталь этой группы идёт на изготовление слесарного инструмента: спиральных свёрл, шаберов, напильников, ножовок.
Главные отличия инструментальной стали от быстрорежущей HSS заключаются в меньшем пределе прочности и повышенной зернистости, которая повышается даже при незначительном нагреве и закалке. В частности, предел прочности инструментальной стали заканчивается при температурном нагреве в +170/+200 градусов.
Углеродистые инструментальные стали не способны выдержать высокоскоростные режимы резания.
Отличия HSS стали от твёрдых сплавов
Твёрдые сплавы представляют собой композитные материалы, которые изготавливаются с использованием технологий порошковой металлургии. Основными компонентами являются карбиды вольфрама, титана, тантала. Жаропрочные стали обладают повышенной твёрдостью, и по этим параметрам они лучше быстрорежущих.
Однако твёрдые сплавы отличаются меньшей механической прочностью, поэтому повреждаются при значительных силовых и вибрационных нагрузках. Твердосплавный инструмент никогда не используют для резания и обработки на высоких скоростях. Более того, технология производства твёрдых сплавов дорогостоящая, что делает инструмент из этого материала нерентабельным.
Фреза: HSS или HM? Когда что использoвать?
При фрезеровании часто возникает вопрос, какую фрезу для какой области применения я могу использовать. Мнения расходятся относительно того, какой из двух режущих инструментов лучше всего подходит для какого материала.
Теперь мы хотим пролить свет на темноту и обсудить разницу и наилучшее возможное применение HSS или HM.
Прежде чем мы перейдем к вопросу о том, какой материал когда используется, мы хотели бы взглянуть на материалы в целом.
Содержание
- Из чего сделана HSS и каковы ее свойства?
- Как производится фреза HM и какие свойства он проявляет?
- Когда используется HSS и HM?
HSS происходит от английского High Speed Steel, что в переводе означает быстрорежущая сталь.
HSS — это легированная инструментальная сталь с содержанием углерода до 2,06% и содержанием до 30% легирующих элементов, таких как кобальт, молибден и титан. Есть еще 3 типа инструментов из быстрорежущей стали: HSS-R (формовка прокаткой), HSS-G (формовка шлифованием — G = шлифовка) для низких допусков и HSS-E (как HSS-G, но с добавлением кобальта) для материалов. с высокой прочностью и длинными режущими каналами.
Чтобы улучшить различные свойства, HSS также может иметь покрытие из сплава / твердого материала, которое обычно представляет собой твердое хромирование, азотирование или карбонизацию.
Благодаря своей высокой твердости, устойчивости к износу и термостойкости он может легко обрабатывать мягкие и тонкостенные детали с высокой точностью. Фрезы из быстрорежущей стали имеют более высокую вязкость и прочность кромки, что создает более высокий передний угол и, следовательно, меньший угол клина, что делает стружку более тонкой, но снижает сопротивление резке.
Однако преимущество HSS заключается в том, что, в отличие от фрез из твердого металла, она нечувствительна к ударам и вибрации.
Как производится фреза HM и какие свойства он проявляет?
Фреза из твердого сплава, HM, получают методом порошковой металлургии, этот процесс состоит из 3 этапов; Фрезерование и смешивание, формование и спекание. Они состоят из кобальта (связующего вещества) и содержащихся в них карбидов (твердых материалов), таких как титан, карбид вольфрама или нитрид титана. Свойства материала можно улучшить за счет уменьшения размера зерна, но он имеет недостаток, заключающийся в увеличении производственных затрат и затрат. Эти материалы в основном используются в качестве инструментов или частей инструмента для механической обработки, обработки без резания и для абразивного износа. Современный вариант HM, называемый керметами (керамика и металл), в основном используется для высокоскоростной резки.
Их свойства, такие как высокая твердость, термостойкость и износостойкость, значительно выше, чем у обычных режущих материалов, таких как HSS, хотя они имеют только низкую вязкость разрушения и сопротивление термическому удару. Благодаря этим хорошим свойствам одновременно достигается более высокая скорость резки, и даже твердые материалы, такие как стекло и фарфор, могут обрабатываться твердосплавным инструментом.
Благодаря этим хорошим свойствам одновременно достигается более высокая скорость резки, и даже твердые материалы, такие как стекло и фарфор, могут обрабатываться твердосплавным инструментом.
Когда используется HSS и HM?
Фрезы из быстрорежущей стали используются для обработки стали, чугуна, пластмасс и других мягких материалов, где работа может выполняться на низких скоростях, возникает множество ударов и вибраций, и требуется острая режущая кромка. Однако они быстро затупляются, а затем приобретают нечистый рисунок фрезерования. Благодаря острым режущим кромкам они идеально подходят для обработки алюминия и пластика.
Фрезы из твердого сплава HM используются для обработки деталей из нержавеющей стали, панелей и пластмасс, а также многих других материалов с разной степенью твердости, так как они могут работать на очень высоких скоростях. Они также обладают более высокой твердостью, термостойкостью и износостойкостью по сравнению с HSS, что делает их более подходящими для многих областей применения. При фрезеровании древесины следует использовать только твердосплавные фрезы, так как они обеспечивают более точную фрезеровку материала.
При фрезеровании древесины следует использовать только твердосплавные фрезы, так как они обеспечивают более точную фрезеровку материала.
В конце концов, можно сказать, что твердосплавные фрезы намного дороже, но их можно использовать более универсально и они более стабильны, чем фрезы из быстрорежущей стали. Но если предстоит использовании лишь небольшого количества материалов, которое легко поддается фрезерованию, то фрезы HSS — хороший выбор.
Related posts:
F5 Cloud Docs
BIG-IP Extensibility
- F5 Application Services 3 Extension
Конфигурации для конкретных приложений в системе BIG-IP с использованием декларативной модели.
- F5 Декларативное подключение
Начальная конфигурация системы BIG-IP с использованием декларативной модели.
- F5 Потоковая передача телеметрии
Агрегация, нормализация и пересылка статистики и событий из BIG-IP в потребительские приложения.

- Шаблоны служб приложений F5
Шаблоны
FAST предоставляют набор инструментов для создания шаблонов и управления приложениями AS3 на BIG-IP
.
- F5 Отказоустойчивое облако
Функциональность аварийного переключения L3 для системы BIG-IP в облачных средах.
- iApps LX/iControl LX
Возможность программирования уровня управления системой BIG-IP или платформой iWorkflow с помощью Node.js.
- F5 Управляемая конфигурация доступа BIG-IP
Управляемая настройка с использованием REST API, коннектора SAML IdP и конфигурации приложения SaaS.
Руководства на GitHub
- Декларативная политика F5 BIG-IP WAF
Специальные конфигурации WAF в системе BIG-IP с использованием модели декларативной политики.
Облачные интеграции
- Облачные службы F5
Облачные решения SaaS для улучшенной доставки приложений, безопасности и анализа.

- Распределенная облачная платформа F5
F5 Эталонные архитектуры распределенного облака и соответствующая информация о реализации.
- BIG-IP ВЭ
BIG-IP Virtual Edition (VE) на общедоступных и частных облачных платформах.
- OpenStack Китай
решения OpenStack для рынка Китая.
Интеграция экосистем
- Модули F5 для Ansible
Набор модулей Ansible для системы BIG-IP.
Модули на GitHub
- Ресурсы F5 для Terraform Provider
Набор ресурсов F5 для Terraform.
- Сервисный центр F5 ACI
Интеграция между BIG-IP и инфраструктурой, ориентированной на приложения Cisco (ACI).
- Интеграция контейнеров Kubernetes
Встроенная интеграция BIG-IP в Kubernetes с F5 Container Ingress Services.
- Интеграция контейнера RedHat OpenShift
Встроенная интеграция BIG-IP как в RedHat OpenShift, так и в OpenShift Origin с F5 Container Ingress Services.

Сети 5G
- Прокси службы для Kubernetes
Облачное решение для управления трафиком приложений, разработанное для сетей CoSP 5G.
- Облачные сетевые функции
Передовые решения для обеспечения безопасности и управления трафиком для облачных сетей CoSP 5G.
- Программа сертификации F5 Partner CNF
F5 и ее партнеры будут сертифицировать SPK и Aspen Mesh в облачной среде с CNF поставщиков.
Справочник API
- F5 BIG-IQ API
REST API для сценариев рабочих процессов BIG-IQ.
- F5 BIG-IP iApps
настраиваемых инструмента настройки на основе шаблонов для развертывания служб приложений.
- F5 BIG-IP iRules API
API программирования на основе Tcl для трафика плоскости данных.
- F5 BIG-IP iRulesLX API
API программирования на основе Node.js для трафика плоскости данных.

- F5 BIG-IP iControlREST API
API на основе REST для императивной настройки и управления услугами BIG-IP.
- API iControl F5 BIG-IP
API на основе SOAP для императивной настройки и управления услугами BIG-IP.
- F5 iHealth API
API на основе REST для программной работы с диагностическим сайтом F5 iHealth.
- API скриптов F5 tmsh
API сценариев на основе Tcl для действий плоскости управления в BIG-IP.
Благодарности OSS
Справочник интерфейса командной строки
- Справочник F5 TMSH
Ссылки
TMSH представляют собой наборы версий справочных страниц BIG-IP tmsh.
- F5OS-C/ВЕЛОС CLI
Интерфейс командной строки для настройки F5OS в системах VELOS.
- Интерфейс командной строки F5OS-A/F5 rSeries
Интерфейс командной строки для настройки F5OS в системах rSeries.

Виртуализация сетевых функций
F5 SSL Visibility
- F5 SSL Orchestrator
Обеспечивает видимость зашифрованного трафика SSL/TLS с управлением трафиком и динамической цепочкой сервисов
- Руководство по устранению неполадок SSLO
Руководство на основе блок-схем по устранению распространенных проблем в F5 SSL Orchestrator
Обучение и лаборатории
Узнайте, как получить максимальную отдачу от продуктов F5 с помощью онлайн-обучения и лабораторных материалов.
Посетите сообщество обучения и лабораторий F5- Автоматизированная песочница F5
Предоставление инфраструктуры и выполнение вариантов использования с использованием шаблонов
- Решения доступа F5
Предоставляет автоматизированные примеры конфигурации APM для решения распространенных вариантов использования
Варианты использования - SPK
Обзор вариантов использования Service Proxy для Kubernetes
Профили модификации тРНК и стратегии декодирования кодонов у Methanocaldococcus jannaschii
1. Crick FH.
1966 год.
Спаривание кодонов и антикодонов: гипотеза колебания. Джей Мол Биол
19: 548–555. doi: 10.1016/S0022-2836(66)80022-0. [PubMed] [CrossRef] [Академия Google]
Crick FH.
1966 год.
Спаривание кодонов и антикодонов: гипотеза колебания. Джей Мол Биол
19: 548–555. doi: 10.1016/S0022-2836(66)80022-0. [PubMed] [CrossRef] [Академия Google]
2. Weixlbaumer A, Murphy FV IV, Dziergowska A, Malkiewicz A, Vendeix FA, Agris PF, Ramakrishnan V. 2007. Механизм расширения декодирующей способности транспортных РНК путем модификации уридинов. Nat Struct Мол Биол 14:498. дои: 10.1038/nsmb1242. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Яриан С., Таунсенд Х., Честковски В., Сочачка Э., Малкевич А.Дж., Гюнтер Р., Мискевич А., Агрис П.Ф. 2002. Точная трансляция генетического кода зависит от нуклеозидов, модифицированных тРНК. J Биол Хим 277:16391–16395. doi: 10.1074/jbc.M200253200. [PubMed] [CrossRef] [Google Scholar]
4. Розов А., Демешкина Н., Хусаинов И., Вестхоф Э., Юсупов М., Юсупова Г.
2016.
Новые взаимодействия спаривания оснований в положении колебания тРНК имеют решающее значение для точного чтения генетического кода. Нац Коммуна
7:10457. дои: 10.1038/ncomms10457. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нац Коммуна
7:10457. дои: 10.1038/ncomms10457. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Boccaletto P, Machnicka MA, Purta E, Piątkowski P, Bagiński B, Wirecki TK, de Crécy-Lagard V, Ross R, Limbach PA, Kotter А, Хелм М, Буйницкий Дж.М. 2018. MODOMICS: база данных путей модификации РНК. обновление 2017 года. Нуклеиновые Кислоты Res 46:D303–D307. дои: 10.1093/нар/gkx1030. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Limbach PA, Crain PF, McCloskey JA. 1994. Резюме: модифицированные нуклеозиды РНК. Нуклеиновые Кислоты Res 22:2183–2196. doi: 10.1093/нар/22.12.2183. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Rozenski J, Crain PF, McCloskey JA. 1999. База данных модификаций РНК: обновление 1999 г. Нуклеиновые Кислоты Res 27:196–197. doi: 10.1093/нар/27.1.196. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Макклоски Дж. А., Грэм Д. Е., Чжоу С., Крейн П. Ф., Ибба М., Кониски Дж., Сёлль Д. , Олсен Г. Дж.
2001.
Посттранскрипционная модификация тРНК архей: идентичность и филогенетические отношения нуклеотидов мезофильных и гипертермофильных метанококков. Нуклеиновые Кислоты Res
29:4699–4706. doi: 10.1093/нар/29.22.4699. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Олсен Г. Дж.
2001.
Посттранскрипционная модификация тРНК архей: идентичность и филогенетические отношения нуклеотидов мезофильных и гипертермофильных метанококков. Нуклеиновые Кислоты Res
29:4699–4706. doi: 10.1093/нар/29.22.4699. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Noon KR, Guymon R, Crain PF, McCloskey JA, Thomm M, Lim J, Cavicchioli R. 2003. Влияние температуры на модификацию тРНК у архей: Methanococcoides burtonii (оптимальная температура роста [T opt , 23°C) и Stetteria hydrophila (T opt , 95°C). J Бактериол 185: 5483–5490. doi: 10.1128/JB.185.18.5483-5490.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Phillips G, de Crécy-Lagard V. 2011. Биосинтез и функция модификаций тРНК у архей. Курр Опин Микробиол 14:335–341. doi: 10.1016/j.mib.2011.03.001. [PubMed] [CrossRef] [Google Scholar]
11. Ватанабэ М., Мацуо М., Танака С., Акимото Х., Асахи С., Нисимура С., Катце Дж. Р., Хашизуме Т. , Крейн П. Ф., Макклоски Дж. А., Окада Н.
1997.
Биосинтез археозина, нового производного 7-деазагуанозина, специфичного для тРНК архей, протекает по пути, включающему замену оснований в полинуклеотидной цепи тРНК. J Биол Хим
272:20146–20151. doi: 10.1074/jbc.272.32.20146. [PubMed] [CrossRef] [Google Scholar]
, Крейн П. Ф., Макклоски Дж. А., Окада Н.
1997.
Биосинтез археозина, нового производного 7-деазагуанозина, специфичного для тРНК архей, протекает по пути, включающему замену оснований в полинуклеотидной цепи тРНК. J Биол Хим
272:20146–20151. doi: 10.1074/jbc.272.32.20146. [PubMed] [CrossRef] [Google Scholar]
12. Mandal D, Köhrer C, Su D, Russell SP, Krivos K, Castleberry CM, Blum P, Limbach PA, Söll D, RajBhandary UL. 2010. Агматидин, модифицированный цитидин в антикодоне архейной tRNAIle, образует пары оснований с аденозином, но не с гуанозином. Proc Natl Acad Sci U S A 107: 2872–2877. doi: 10.1073/pnas.0914869107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Ikeuchi Y, Kimura S, Numata T, Nakamura D, Yokogawa T, Ogata T, Wada T, Suzuki T, Suzuki T. 2010. Цитидин, конъюгированный с агматином, в антикодоне тРНК необходим для декодирования AUA у архей. Нат Хим Биол 6: 277–282. doi: 10.1038/nchembio.323. [PubMed] [CrossRef] [Google Scholar]
14. Hori H, Kawamura T, Awai T, Ochi A, Yamagami R, Tomikawa C, Hirata A.
2018.
Перенос ферментов модификации РНК из термофилов и их модифицированных нуклеозидов в тРНК. Микроорганизмы
6:110. дои: 10.3390/микроорганизмы6040110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Hori H, Kawamura T, Awai T, Ochi A, Yamagami R, Tomikawa C, Hirata A.
2018.
Перенос ферментов модификации РНК из термофилов и их модифицированных нуклеозидов в тРНК. Микроорганизмы
6:110. дои: 10.3390/микроорганизмы6040110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Гупта Р. 1984. тРНК Halobacterium volcanii. Идентификация 41 тРНК, охватывающей все аминокислоты, и последовательностей 33 тРНК класса I. J Биол Хим 259:9461–9471. [PubMed] [Google Scholar]
16. Гупта Р. 1986 год. Транспортные РНК Halobacterium volcanii: последовательности пяти лейциновых и трех сериновых тРНК. Сист Аппл Микробиол 7:102–105. doi: 10.1016/S0723-2020(86)80131-X. [Перекрестная ссылка] [Академия Google]
17. Росс Р., Цао X, Ю. Н., Лимбах П.А. 2016. Картирование последовательности химических модификаций транспортной РНК с помощью жидкостной хроматографии и тандемной масс-спектрометрии. Методы 107:73–78. doi: 10.1016/j.ymeth.2016.03.016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Limbach PA, Paulines MJ.
2017.
Выход на глобальный уровень: новая эра картирования модификаций РНК. Провода РНК
8:e1367. doi: 10.1002/wrna.1367. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Limbach PA, Paulines MJ.
2017.
Выход на глобальный уровень: новая эра картирования модификаций РНК. Провода РНК
8:e1367. doi: 10.1002/wrna.1367. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Urbonavičius J, Meškys R, Grosjean H. 2014. Биосинтез производных висозина в тРНКФе архей: роль замечательной бифункциональной тРНКФе: метилтрансферазы m1G/imG2. РНК 20:747–753. doi: 10.1261/РНК.043315.113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. де Креси-Лагар В., Брошье-Армане С., Урбонавичус Дж., Фернандес Б., Филлипс Г., Лайонс Б., Нома А., Альварес С., Другманс Л., Арменго Дж., Грожан Х. 2010. Биосинтез производных висозина в тРНК: древний и весьма разнообразный путь у архей. Мол Биол Эвол 27:2062–2077. doi: 10.1093/molbev/msq096. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Reddy DM, Crain PF, Edmonds CG, Gupta R, Hashizume T, Stetter KO, Widde F, McCloskey JA.
1992.
Определение структуры двух новых аминокислотсодержащих производных аденозина из тРНК термофильных бактерий и архей. Нуклеиновые Кислоты Res
20:5607–5615. дои: 10.1093/нар/20.21.5607. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нуклеиновые Кислоты Res
20:5607–5615. дои: 10.1093/нар/20.21.5607. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Mandal D, Köhrer C, Su D, Babu IR, Chan CTY, Liu Y, Söll D, Blum P, Kuwahara M, Dedon PC, Rajbhandary УЛ. 2014. Идентификация и свойства чтения кодонов 5-цианометилуридина, нового модифицированного нуклеозида, обнаруженного в положении колебания антикодона мутантных галоархейных изолейциновых тРНК. РНК 20:177–188. doi: 10.1261/РНК.042358.113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Jora M, Burns AP, Ross RL, Lobue PA, Zhao R, Palumbo CM, Beal PA, Addepalli B, Limbach PA. 2018. Дифференциация позиционных изомеров модификаций нуклеозидов с помощью масс-спектрометрии высокоэнергетической диссоциации столкновений (HCD MS). J Am Soc Масс-спектр 29: 1745–1756. doi: 10.1007/s13361-018-1999-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Nelson CC, McCloskey JA.
1992.
Диссоциация аденина при столкновении. J Am Chem Soc
114:3661–3668. дои: 10.1021/ja00036a014. [CrossRef] [Google Scholar]
J Am Chem Soc
114:3661–3668. дои: 10.1021/ja00036a014. [CrossRef] [Google Scholar]
25. Chan CT, Chionh YH, Ho C-H, Lim KS, Babu IR, Ang E, Wenwei L, Alonso S, Dedon PC. 2011. Идентификация N6,N6-диметиладенозина в транспортной РНК Mycobacterium bovis Bacille Calmette-Guerin. Молекулы 16: 5168–5181. дои: 10.3390/молекул 16065168. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Arragain S, Handelman SK, Forouhar F, Wei F-Y, Tomizawa K, Hunt JF, Douki T, Fontecave M, Mulliez E, Atta M. 2010. Идентификация эукариотических и прокариотических метитиотрансфераз для биосинтеза 2-метилтио-N6-треонилкарбамоиладенозина в тРНК. J Биол Хим 285:28425–28433. doi: 10.1074/jbc.M110.106831. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Puri P, Wetzel C, Saffert P, Gaston KW, Russell SP, Cordero Varela JA, van der Vlies P, Zhang G, Limbach PA, Ignatova З., Пулман Б.
2014.
Систематическая идентификация тРНКома и его динамика у Lactococcus lactis. Мол Микробиол
93: 944–956. дои: 10.1111/mmi.12710. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мол Микробиол
93: 944–956. дои: 10.1111/mmi.12710. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Wagner TM, Nair V, Guymon R, Pomerantz SC, Crain PF, Davis DR, McCloskey JA. 2004. Новый метод размещения последовательности модифицированных нуклеотидов в смесях транспортной РНК. Nucleic Acids Symp Ser (Oxf) 2004: 263–264. [PubMed] [Google Scholar]
29. Хоссейн М., Лимбах П.А. 2007. Обнаружение транспортных РНК на основе масс-спектрометрии по характерным продуктам расщепления эндонуклеазами. РНК 13:295–303. doi: 10.1261/РНК.272507. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Hossain M, Limbach PA. 2009. Множественные эндонуклеазы улучшают обнаружение характерных продуктов переваривания MALDI-MS бактериальных транспортных РНК. Анальная биоанальная химия 394:1125. doi: 10.1007/s00216-008-2562-2. [PubMed] [CrossRef] [Google Scholar]
31. Castleberry CM, Limbach PA.
2010.
Относительное количественное определение транспортных РНК с использованием жидкостной хроматографии, масс-спектрометрии и характерных продуктов расщепления. Нуклеиновые Кислоты Res
38:e162. дои: 10.1093/нар/gkq578. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нуклеиновые Кислоты Res
38:e162. дои: 10.1093/нар/gkq578. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Wetzel C, Limbach PA. 2012. Глобальная идентификация транспортных РНК методом жидкостной хроматографии-масс-спектрометрии (ЖХ-МС). J Протеомика 75:3450–3464. doi: 10.1016/j.jprot.2011.09.015. [PubMed] [CrossRef] [Google Scholar]
33. Reeve JN. 1992. Молекулярная биология метаногенов. Анну Рев Микробиол 46:165–191. doi: 10.1146/annurev.mi.46.100192.001121. [PubMed] [CrossRef] [Google Scholar]
34. Bult CJ, White O, Olsen GJ, Zhou L, Fleischmann RD, Sutton GG, Blake JA, FitzGerald LM, Clayton RA, Gocayne JD, Kerlavage AR, Dougherty BA, Томб Дж. Ф., Адамс М. Д., Райх К. И., Овербик Р., Киркнесс Э. Ф., Вайншток К. Г., Меррик Дж. М., Глодек А., Скотт Дж. Л., Геогхаген Н. С., Вентер Дж. К. 1996. Полная последовательность генома метаногенного археона Methanococcus jannaschii. Наука 273: 1058–1073. doi: 10.1126/наука.273.5278.1058. [PubMed] [CrossRef] [Google Scholar]
35. Zhu W, Reich CI, Olsen GJ, Giometti CS, Yates JR.
2004.
Протеомика Methanococcus jannaschii и понимание метаногенеза. J Протеом Res
3: 538–548. doi: 10.1021/pr034109s. [PubMed] [CrossRef] [Google Scholar]
Zhu W, Reich CI, Olsen GJ, Giometti CS, Yates JR.
2004.
Протеомика Methanococcus jannaschii и понимание метаногенеза. J Протеом Res
3: 538–548. doi: 10.1021/pr034109s. [PubMed] [CrossRef] [Google Scholar]
36. Perche-Letuvée P, Molle T, Forouhar F, Mulliez E, Atta M. 2014. Биосинтез вибутозина: структурный и механистический обзор. РНК Биол 11: 1508–1518. дои: 10.4161/15476286.2014.992271. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Edmonds C, Crain P, Gupta R, Hashizume T, Hocart C, Kowalak J, Pomerantz S, Stetter K, McCloskey J. 1991. Посттранскрипционная модификация тРНК у термофильных архей (архебактерий). J Бактериол 173:3138–3148. doi: 10.1128/jb.173.10.3138-3148.1991. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Nicoghosian K, Gu X-R, Cedergren R. 1985. Последовательности тРНК Halobacterium cutirubrum. FEBS Lett 193: 255–260. doi: 10.1016/0014-5793(85)80164-2. [CrossRef] [Google Scholar]
39. Gu X-R, Nicoghosian K, Cedergren R, Wong JT-F. 1983.
Последовательности галобактериальных тРНК и отсутствие U в первой позиции их антикодонов. Нуклеиновые Кислоты Res
11:5433–5442. doi: 10.1093/нар/11.16.5433. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1983.
Последовательности галобактериальных тРНК и отсутствие U в первой позиции их антикодонов. Нуклеиновые Кислоты Res
11:5433–5442. doi: 10.1093/нар/11.16.5433. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Kuchino Y, Ihara M, Yabusaki Y, Nishimura S. 1982. Инициаторные тРНК из архебактерий демонстрируют общие характеристики уникальной последовательности. Природа 298:684. дои: 10.1038/298684a0. [PubMed] [CrossRef] [Google Scholar]
41. Килпатрик М., Уокер Р. 1981. Нуклеотидная последовательность тРНК MMet et архебактерии Thermoplasma acidophilum. Нуклеиновые Кислоты Res 9:4387–4390. doi: 10.1093/нар/9.17.4387. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Tomikawa C, Ohira T, Inoue Y, Kawamura T, Yamagishi A, Suzuki T, Hori H. 2013. Отличительные модификации тРНК у термоацидофильных архей Thermoplasma acidophilum. FEBS Lett 587:3575–3580. doi: 10.1016/j.febslet.2013.090,021. [PubMed] [CrossRef] [Google Scholar]
43. Gu X-R, Nicoghosian K, Cedergren R.
1984.
Последовательности тРНК глицина и аспарагма из архебактерии Methanobacterium thermoautotrophicum. FEBS Lett
176: 462–466. doi: 10.1016/0014-5793(84)81219-3. [CrossRef] [Google Scholar]
Gu X-R, Nicoghosian K, Cedergren R.
1984.
Последовательности тРНК глицина и аспарагма из архебактерии Methanobacterium thermoautotrophicum. FEBS Lett
176: 462–466. doi: 10.1016/0014-5793(84)81219-3. [CrossRef] [Google Scholar]
44. Polycarpo C, Ambrogelly A, Bérube A, Winbush SM, McCloskey JA, Crain PF, Wood JL, Söll D. 2004. Аминоацил-тРНК-синтетаза, которая специфически активирует пирролизин. Proc Natl Acad Sci U S A 101:12450–12454. doi: 10.1073/pnas.0405362101. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Росс Р.Л., Цао X, Лимбах П.А. 2017. Картирование посттранскрипционных модификаций на последовательности переноса рибонуклеиновой кислоты с помощью жидкостной хроматографии и тандемной масс-спектрометрии. Биомолекулы 7:21. doi: 10.3390/biom7010021. [CrossRef] [Google Scholar]
46. Wetzel C, Limbach PA. 2016. Масс-спектрометрия модифицированных РНК: последние разработки. Аналитик 141:16–23. doi: 10.1039/c5an01797a. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Menezes S, Gaston KW, Krivos KL, Apolinario EE, Reich NO, Sowers KR, Limbach PA, Perona JJ.
2011.
Образование m 2 G6 в тРНК Methanocaldococcus jannaschii катализируется новой метилтрансферазой Trm14. Нуклеиновые Кислоты Res
39: 7641–7655. doi: 10.1093/нар/гкр475. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Menezes S, Gaston KW, Krivos KL, Apolinario EE, Reich NO, Sowers KR, Limbach PA, Perona JJ.
2011.
Образование m 2 G6 в тРНК Methanocaldococcus jannaschii катализируется новой метилтрансферазой Trm14. Нуклеиновые Кислоты Res
39: 7641–7655. doi: 10.1093/нар/гкр475. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Liu Y, Zhu X, Nakamura A, Orlando R, Söll D, Whitman WB. 2012. Биосинтез 4-тиуридина в тРНК у метаногенных архей Methanococcus maripaludis. J Биол Хим 287:36683–36692. doi: 10.1074/jbc.M112.405688. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Арменгауд Дж., Урбонавичюс Дж., Фернандес Б., Чауссинанд Г., Буйницкий Дж.М., Грожан Х. 2004. N2-метилирование гуанозина в положении 10 в тРНК катализируется S-аденозилметионин-зависимой метилтрансферазой, содержащей домен THUMP, консервативной у архей и эукариот. J Биол Хим 279: 37142–37152. doi: 10.1074/jbc.M403845200. [PubMed] [CrossRef] [Google Scholar]
50. Phillips G, Swairjo MA, Gaston KW, Bailly M, Limbach PA, Iwata-Reuyl D, de Crécy-Lagard V. 2012.
Разнообразие синтеза археозинов у кренархеот. ACS Chem Biol
7: 300–305. дои: 10.1021/cb200361w. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2012.
Разнообразие синтеза археозинов у кренархеот. ACS Chem Biol
7: 300–305. дои: 10.1021/cb200361w. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Bai Y, Fox DT, Lacy JA, Van Lanen SG, Iwata-Reuyl D. 2000. Гипермодификация тРНК у термофильных архей: клонирование, сверхэкспрессия и характеристика тРНК-гуанинтрансгликозилазы из Methanococcus jannaschii. J Биол Хим 275:28731–28738. doi: 10.1074/jbc.M002174200. [PubMed] [CrossRef] [Академия Google]
52. Филлипс Г., Чиквана В.М., Максвелл А., Эль-Якуби Б., Сваирджо М.А., Ивата-Рейл Д., де Креси-Лагард В. 2010. Открытие и характеристика амидинотрансферазы, участвующей в модификации тРНК архей. J Биол Хим 285:12706–12713. doi: 10.1074/jbc.M110.102236. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Nishimoto M, Higashijima K, Shirouzu M, Grosjean H, Bessho Y, Yokoyama S.
2008.
Кристаллическая структура тРНК N2,N2-гуанозиндиметилтрансферазы Trm1 из Pyrococcus horikoshii. Джей Мол Биол
383: 871–884. [PubMed] [Академия Google]
[PubMed] [Академия Google]
54. Gagnon KT, Biswas S, Zhang X, Brown BA, Wollenzien P, Mattos C, Maxwell ES. 2012. Структурно консервативный N-концевой домен Nop56/58 способствует активности метилтрансфераз, управляемой sRNP архейного бокса C/D. J Биол Хим 287:19418–19428. doi: 10.1074/jbc.M111.323253. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. d’Orval BC, Bortolin ML, Gaspin C, Bachellerie J-P. 2001. Box C / D РНК направляет метилирование рибозы тРНК архей. Интрон tRNATrp направляет образование двух рибозометилированных нуклеозидов в зрелой tRNATrp. Нуклеиновые Кислоты Res 29: 4518–4529. doi: 10.1093/нар/29.22.4518. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Auxilien S, El Khadali F, Rasmussen A, Doutwaite S, Grosjean H. 2007. Археаза из Pyrococcus abyssi улучшает субстратную специфичность и растворимость тРНК m5C-метилтрансферазы. J Биол Хим 282:18711–18721. doi: 10.1074/jbc.M607459200. [PubMed] [CrossRef] [Google Scholar]
57. Куратани М., Хирано М., Гото-Ито С., Ито Ю., Хикида Ю., Нисимото М., Секине С.и., Бесшо Ю., Ито Т., Грожан Х., Йокояма С.
2010.
Кристаллическая структура комплекса Methanocaldococcus jannaschii Trm4 с синефунгином. Джей Мол Биол
401: 323–333. doi: 10.1016/j.jmb.2010.06.046. [PubMed] [CrossRef] [Академия Google]
Куратани М., Хирано М., Гото-Ито С., Ито Ю., Хикида Ю., Нисимото М., Секине С.и., Бесшо Ю., Ито Т., Грожан Х., Йокояма С.
2010.
Кристаллическая структура комплекса Methanocaldococcus jannaschii Trm4 с синефунгином. Джей Мол Биол
401: 323–333. doi: 10.1016/j.jmb.2010.06.046. [PubMed] [CrossRef] [Академия Google]
58. Гурха П., Гупта Р. 2008. Белки Pus10 архей могут продуцировать как псевдоуридины 54, так и 55 в тРНК. РНК doi: 10.1261/РНК.1276508. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Roovers M, Hale C, Tricot C, Terns MP, Terns RM, Grosjean H, Droogmans L. 2006. Образование консервативного псевдоуридина в положении 55 тРНК архей. Нуклеиновые Кислоты Res 34:4293–4301. дои: 10.1093/нар/гкл530. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Gurha P, Joardar A, Chaurasia P, Gupta R.
2007.
Дифференциальная роль белков бокса H/ACA архей в формировании зависимого от направляющей РНК и независимого псевдоуридина. РНК Биол
4: 101–109. doi: 10.4161/РНК.4.2.5177. [PubMed] [CrossRef] [Google Scholar]
doi: 10.4161/РНК.4.2.5177. [PubMed] [CrossRef] [Google Scholar]
61. Muller S, Fourmann J-B, Loegler C, Charpentier B, Branlant C. 2007. Идентификация детерминант в белках-партнерах aCBF5 и aNOP10, необходимых для активности тРНК: Ψ55-синтазы и РНК-управляемой РНК: Ψ-синтазы. Нуклеиновые Кислоты Res 35:5610–5624. doi: 10.1093/nar/gkm606. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Kamalampeta R, Kothe U. 2012. Белки архей Nop10 и Gar1 повышают каталитическую активность Cbf5 в псевдоуридилировании тРНК. научный представитель 2:663. дои: 10.1038/srep00663. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Менгель-Йоргенсен Дж., Кирпекар Ф. 2002. Обнаружение псевдоуридина и других модификаций тРНК с помощью цианоэтилирования и масс-спектрометрии MALDI. Нуклеиновые Кислоты Res 30:e135. дои: 10.1093/нар/gnf135. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Addepalli B, Limbach PA.
2016.
Псевдоуридин в антикодоне тРНКTyr (QΨA) Escherichia coli катализируется ферментом двойной специфичности RluF. J Биол Хим
291:22327–22337. doi: 10.1074/jbc.M116.747865. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J Биол Хим
291:22327–22337. doi: 10.1074/jbc.M116.747865. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Чаттерджи К., Блаби И.К., Тиавиль П.С., Маджумдер М., Грожан Х., Юань Ю.А., Гупта Р., де Креси-Лагард В. 2012. Члены SPOUT-метилтрансферазы COG1901/DUF358 архей вместе с псевдоуридинсинтазой Pus10 катализируют образование 1-метилпсевдоуридина в положении 54 тРНК. РНК 18:421–433. doi: 10.1261/РНК.030841.111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Chen H-Y, Yuan YA. 2010. Кристаллическая структура белка Mj1640/DUF358 выявляет предполагаемую РНК-метилтрансферазу класса SPOUT. Дж Мол Селл Биол 2: 366–374. дои: 10.1093/jmcb/mjq034. [PubMed] [CrossRef] [Google Scholar]
67. Wurm JP, Griese M, Bahr U, Held M, Heckel A, Karas M, Soppa J, Wöhnert J. 2012. Идентификация фермента, ответственного за N1-метилирование псевдоуридина 54 в тРНК архей. РНК 18:412–420. doi: 10.1261/РНК.028498.111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Kawamura T, Anraku R, Hasegawa T, Tomikawa C, Hori H.
2014.
Метилтрансферазы переноса РНК из Thermoplasma acidophilum, термоацидофильного археона. Int J Mol Sci
16:91–113. дои: 10.3390/ijms16010091. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Kawamura T, Anraku R, Hasegawa T, Tomikawa C, Hori H.
2014.
Метилтрансферазы переноса РНК из Thermoplasma acidophilum, термоацидофильного археона. Int J Mol Sci
16:91–113. дои: 10.3390/ijms16010091. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Roovers M, Wouters J, Bujnicki JM, Tricot C, Stalon V, Grosjean H, Droogmans L. 2004. Первичный фермент модификации РНК: случай тРНК (m1A) метилтрансферазы. Нуклеиновые Кислоты Res 32: 465–476. doi: 10.1093/нар/гх291. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Grosjean H, Constantinesco F, Foiret D, Benachenhou N. 1995. Новый ферментативный путь, приводящий к модификации 1-метилинозина в тРНК Haloferax volcanii. Нуклеиновые Кислоты Res 23: 4312–4319. doi: 10.1093/нар/23.21.4312. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Гупта А., Кумар П.Х., Динешкумар Т., Варшней У., Субраманья Х.С.
2001.
Кристаллическая структура Rv2118c: AdoMet-зависимая метилтрансфераза из Mycobacterium tuberculosis h47Rv 1, 2. J Mol Biol
312: 381–391. doi: 10.1006/jmbi.2001.4935. [PubMed] [CrossRef] [Google Scholar]
J Mol Biol
312: 381–391. doi: 10.1006/jmbi.2001.4935. [PubMed] [CrossRef] [Google Scholar]
72. Мацуо М., Абэ Ю., Сарута Ю., Окада Н. 1995. Гены моллюска, кодирующие лизиновую тРНК (UUU), содержат интроны. Ген 165:249–253. doi: 10.1016/0378-1119(95)00451-B. [PubMed] [CrossRef] [Google Scholar]
73. Somme J, Van Laer B, Roovers M, Steyaert J, Versées W, Droogmans L. 2014. Характеристика двух гомологичных 2′-O-метилтрансфераз, демонстрирующих различную специфичность в отношении их субстратов тРНК. РНК 20:1257–1271. doi: 10.1261/РНК.044503.114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Singh SK, Gurha P, Tran EJ, Maxwell ES, Gupta R. 2004. Последовательное 2′-O-метилирование нуклеотидов пре-тРНКTrp архей управляется кодируемым интроном, но транс-действующим бокс-рибонуклеопротеином C/D пре-тРНК. J Биол Хим 279: 47661–47671. doi: 10.1074/jbc.M408868200. [PubMed] [CrossRef] [Google Scholar]
75. Терасака Н., Кимура С., Осава Т., Нумата Т. , Судзуки Т.
2011.
Биогенез 2-агматинилцитидина катализируется двойным белком и РНК-киназой TiaS. Nat Struct Мол Биол
18:1268. doi: 10.1038/nsmb.2121. [PubMed] [CrossRef] [Google Scholar]
, Судзуки Т.
2011.
Биогенез 2-агматинилцитидина катализируется двойным белком и РНК-киназой TiaS. Nat Struct Мол Биол
18:1268. doi: 10.1038/nsmb.2121. [PubMed] [CrossRef] [Google Scholar]
76. Selvadurai K, Wang P, Seimetz J, Huang RH. 2014. Архейный Elp3 катализирует модификацию уридина колебания тРНК в С5 посредством радикального механизма. Нат Хим Биол 10:810–812. doi: 10.1038/nchembio.1610. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Ван Тран Н., Мюллер Л., Росс Р.Л., Лестини Р., Летокварт Дж., Ульрик Н., Лимбах П.А., де Креси-Лагард В., Чианферани С., Грайль М. 2018. Эволюционное понимание холоферментов Trm112-метилтрансферазы, участвующих в трансляции между археями и эукариотами. Нуклеиновые Кислоты Res 46:8483–8499. doi: 10.1093/nar/gky638. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Perrochia L, Crozat E, Hecker A, Zhang W, Bareille J, Collinet B, Van Tilbeurgh H, Forterre P, Basta T.
2013.
Биосинтез in vitro универсальной модификации тРНК t6A у архей и эукариот. Нуклеиновые Кислоты Res
41:1953–1964. doi: 10.1093/нар/gks1287. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нуклеиновые Кислоты Res
41:1953–1964. doi: 10.1093/нар/gks1287. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Thiaville PC, Iwata-Reuyl D, de Crécy-Lagard V. 2014. Разнообразие путей биосинтеза треонилкарбамоиладенозина (t6A), универсальной модификации тРНК. РНК Биол 11: 1529–1539. дои: 10.4161/15476286.2014.992277. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Deutsch C, El Yacoubi B, de Crécy-Lagard V, Iwata-Reuyl D. 2012. Биосинтез треонилкарбамоиладенозина (t6A), универсального нуклеозида тРНК. J Биол Хим 287:13666–13673. doi: 10.1074/jbc.M112.344028. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
81. Гото-Ито С., Ито Т., Исии Р., Муто Ю., Бессё Ю., Йокояма С. 2008. Кристаллическая структура архейной тРНК (m1G37) метилтрансферазы aTrm5. Белки 72:1274–1289. doi: 10.1002/прот.22019. [PubMed] [CrossRef] [Google Scholar]
82. Suzuki Y, Noma A, Suzuki T, Senda M, Senda T, Ishitani R, Nureki O.
2007.
Кристаллическая структура радикального фермента SAM, катализирующего образование трициклических модифицированных оснований в тРНК. Джей Мол Биол
372: 1204–1214. doi: 10.1016/j.jmb.2007.07.024. [PubMed] [CrossRef] [Академия Google]
Джей Мол Биол
372: 1204–1214. doi: 10.1016/j.jmb.2007.07.024. [PubMed] [CrossRef] [Академия Google]
83. Умицу М., Нисимасу Х., Нома А., Сузуки Т., Ишитани Р., Нуреки О. 2009. Структурная основа AdoMet-зависимой реакции переноса аминокарбоксипропила, катализируемой ферментом, синтезирующим тРНК-вибутозин, TYW2. Proc Natl Acad Sci U S A 106:15616–15621. doi: 10.1073/pnas.0905270106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Grosjean H, Gaspin C, Marck C, Decatur WA, de Crécy-Lagard V. 2008. RNomics и Modomics у галофильных архей Haloferax volcanii: идентификация генов модификации РНК. Геномика BMC 9:470. дои: 10.1186/1471-2164-9-470. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Blaby IK, Phillips G, Blaby-Haas CE, Gulig KS, El Yacoubi B, de Crécy-Lagard V.
2010.
К системному подходу в генетическом анализе архей: ускорение конструирования мутантов и фенотипический анализ у Haloferax volcanii. Археи
2010:1. дои: 10.1155/2010/426239. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Spears JL, Gaston KW, Alfonzo JD. 2011. Анализ редактирования тРНК в нативных и синтетических субстратах. Методы Мол Биол 718:209–226. doi: 10.1007/978-1-61779-018-8_13. [PubMed] [CrossRef] [Google Scholar]
87. Хаузер В.М., Баттерер А., Аддепалли Б., Лимбах П.А. 2015. Комбинирование рекомбинантной рибонуклеазы U2 и протеинфосфатазы для картирования модификации РНК методом жидкостной хроматографии-масс-спектрометрии. Анальная биохимия 478:52–58. doi: 10.1016/j.ab.2015.03.016. [PubMed] [CrossRef] [Google Scholar]
88. Аддепалли Б., Леснер Н.П., Лимбах П.А. 2015. Обнаружение модификаций нуклеозидов РНК с помощью уридин-специфической рибонуклеазы MC1 из Momordica charantia. РНК 21: 1746–1756. doi: 10.1261/РНК.052472.115. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Аддепалли Б., Венера С., Такур П., Лимбах П.А.
2017.
Новая рибонуклеазная активность кузативина из Cucumis sativus для картирования нуклеозидных модификаций в РНК.

 Выдержка в газовой среде с целью насыщения материала азотом. Происходит при температуре 500-600 градусов, в течение 10-40 минут. Процесс способствует укреплению поверхностных слоёв.
Выдержка в газовой среде с целью насыщения материала азотом. Происходит при температуре 500-600 градусов, в течение 10-40 минут. Процесс способствует укреплению поверхностных слоёв. Сталь HSS TiN отличается высокими показателями прочности и термоустойчивости.
Сталь HSS TiN отличается высокими показателями прочности и термоустойчивости. 75
75 5
5 10
10 2
2 20
20 5-4
5-4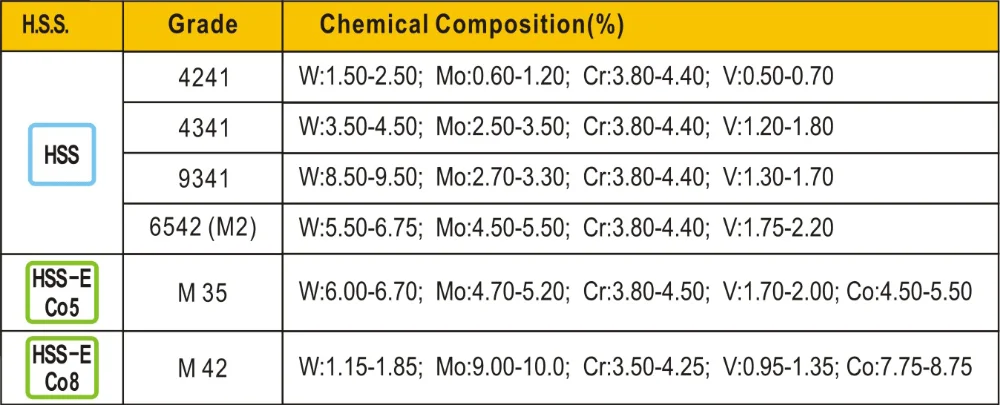 58-0.95
58-0.95 Покрытие повышает коррозийную устойчивость и исключает перегрев даже при высоких скоростях резания.
Покрытие повышает коррозийную устойчивость и исключает перегрев даже при высоких скоростях резания.




