таблица или схема постоянной валентности в соединениях и как ее определить по формулам в 8 классе
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0.
Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Валентность химических элементов (Таблица)
Как можно определить валентность в соединениях:
- Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
- Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- Высшая валентность всегда равна № группы.
- Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.

- У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | Beh3 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, Ch5 |
| 7 | Азот / Nitrogen | N | III, IV | Nh4 |
| 8 | Кислород / Oxygen | O | II | h3O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | Ph4, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | h3S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | Cah3 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 | Титан / Titanium | Ti | II, III, IV | Ti2O3, Tih5 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, h4AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | h3SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, IV, V | SbF5, Sbh4 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | Teh3, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | Lah4 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, Pbh5 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Источник: https://infotables. ru/khimiya/1071-valentnost-khimicheskikh-elementov
ru/khimiya/1071-valentnost-khimicheskikh-elementov
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
- График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
- При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
- Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т. е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
Степень окисления химических элементов в простых веществах всегда равна нулю.
Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
- низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.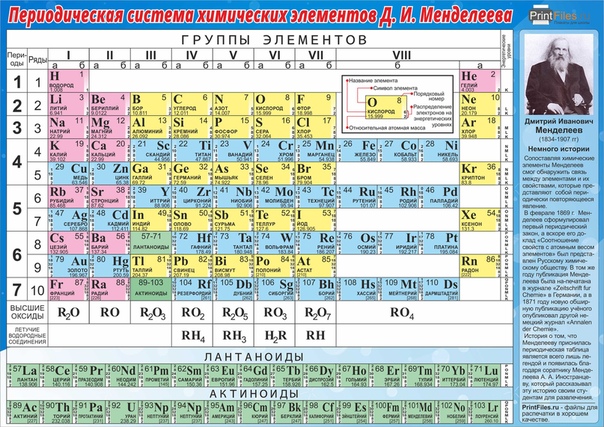
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
- неспаренных электронов
- неподеленных электронных пар на орбиталях валентных уровней
- пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II.
Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня.
Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
- Для углерода возможны валентности II, III, IV
- Наиболее распространенная валентность углерода в соединениях IV
- В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (Nh4), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Действительно, валентность, равная трём, наблюдается в молекулах аммиака (Nh4), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар.
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е.
для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей.
Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
Резюмируя информацию по валентным возможностям атома азота:
- Для азота возможны валентности I, II, III и IV
- Валентности V у азота не бывает!
- В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).

- В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония Nh5+, азотная кислота и д.р).
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/jelektrootricatelnost-stepen-okislenija-valentnost
что дает хром, никель и молибден
Хром, никель и молибден являются важнейшими легирующими элементами сталей. Их применяют в различных сочетаниях и получают различные категории легированных сталей: хромистые, хромоникелевые, хромоникельмолибденовые и тому подобные легированные стали.
Влияние хрома на свойства сталей
Стремление хром образовывать карбиды является средним среди других карбидообразующих легирующих элементов. При низком соотношении Cr/C содержания хрома по отношению к железу образуется только цементит вида (Fe,Cr)3C. С увеличением отношения содержания хрома и углерода в стали Cr/C появляются хромистые карбиды вида (Cr,Fe)7C3 или (Cr,Fe)23C6 или оба. Хром повышает способность сталей к термическому упрочнению, их стойкость к коррозии и окислению, обеспечивает повышение прочности при повышенных температурах, а также повышает сопротивление абразивному износу высокоуглеродистых сталей.
Хром повышает способность сталей к термическому упрочнению, их стойкость к коррозии и окислению, обеспечивает повышение прочности при повышенных температурах, а также повышает сопротивление абразивному износу высокоуглеродистых сталей.
Карбиды хрома являются и износостойкими. Именно они обеспечивают стойкость стальным лезвиям – не зря из хромистых сталей изготавливают лезвия ножей. Сложные хроможелезистые карбиды входят в твердый раствор аустенита очень медленно – поэтому при нагреве таких сталей под закалку требуется более длительная выдержка при температуре нагрева. Хром по праву считается самым важным легирующим элементом в сталях. Добавление хрома в стали побуждает примеси, такие как фосфор, олово, сурьма и мышьяк сегрегировать к границам зерен, что может вызвать в сталях отпускную хрупкость.
Влияние никеля на свойства сталей
Никель не образует в сталях карбидов. В сталях он является элементом, способствующим образованию и сохранению аустенита. Никель повышает упрочняемость сталей.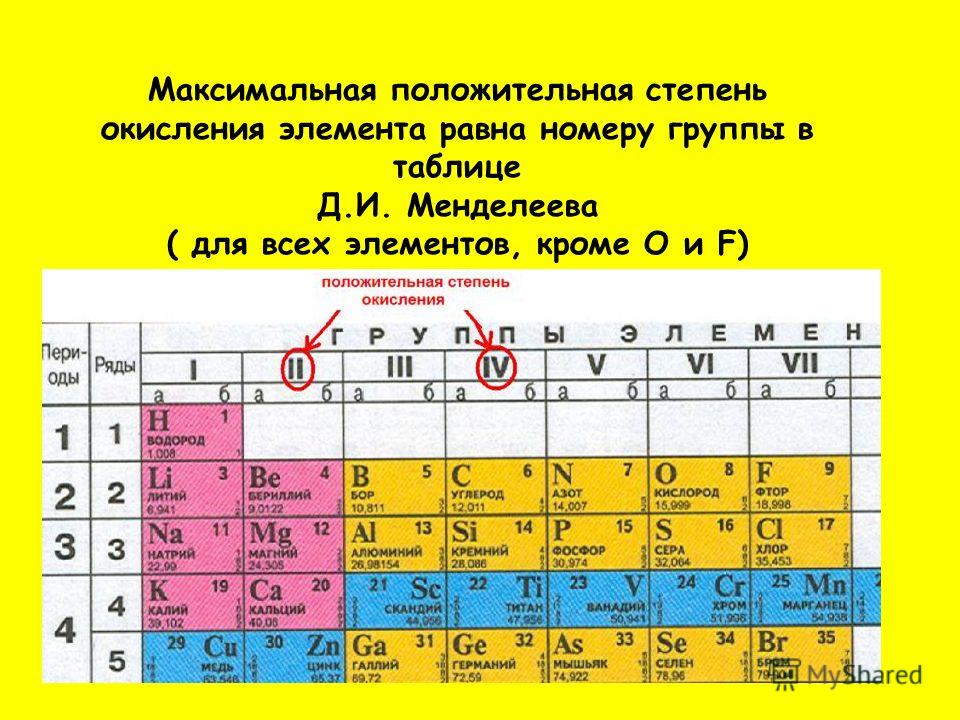 В комбинации с хромом и молибденом никель еще больше повышает способность сталей к термическому упрочнению, способствует повышению вязкости и усталостной прочности сталей. Растворяясь в феррите никель повышает его вязкость. Никель увеличивает сопротивление коррозии хромоникелевых аустенитных сталей в неокисляющих кислотных растворах.
В комбинации с хромом и молибденом никель еще больше повышает способность сталей к термическому упрочнению, способствует повышению вязкости и усталостной прочности сталей. Растворяясь в феррите никель повышает его вязкость. Никель увеличивает сопротивление коррозии хромоникелевых аустенитных сталей в неокисляющих кислотных растворах.
Влияние молибдена на свойства сталей
Молибден с готовностью образует в сталях карбиды. Он растворяется в цементите только немного. Молибден образует карбиды молибдена, как только содержание углерода в стали становится достаточно высоким. Молибден способен обеспечивать дополнительное термическое упрочнение в ходе отпуска закаленных сталей. Он повышает сопротивление сталей ползучести низколегированных при высоких температурах.
Добавки молибдена способствуют измельчению зерна сталей, повышают упрочняемость сталей термической обработкой, увеличивают усталостную прочность сталей. Легированные стали с содержанием молибдена 0,20-0,40 % или такое же количество ванадия замедляют возникновение отпускной хрупкости, но не устраняют ее полностью. Молибден повышает коррозионную стойкость сталей и поэтому широко применяется в высоколегированных ферритных нержавеющих сталях и в хромоникелевых аустенитных нержавеющих сталях. Высокое содержание молибдена снижает склонность нержавеющей стали к точечной (питтинговой) коррозии. Молибден оказывает очень сильное упрочнение твердого раствора аустенитных сталей, которые применяются при повышенных температурах.
Молибден повышает коррозионную стойкость сталей и поэтому широко применяется в высоколегированных ферритных нержавеющих сталях и в хромоникелевых аустенитных нержавеющих сталях. Высокое содержание молибдена снижает склонность нержавеющей стали к точечной (питтинговой) коррозии. Молибден оказывает очень сильное упрочнение твердого раствора аустенитных сталей, которые применяются при повышенных температурах.
Источник: Steel Heat Treatment: Metallurgy and Technologies, ed. G. E. Totten, 2006
| No. | Сим-вол | Латинское название | Русское название | Английское название | Транскрипция |
| 1 | H | Hydrogenium | Водород | Hydrogen | [ ˈhaɪdrədʒən ] |
| 2 | He | Helium | Гелий | Helium | [ ˈhiːlɪəm ] |
| 3 | Li | Lithium | Литий | Lithium | [ ˈlɪθiəm ] |
| 4 | Be | Beryllium | Бериллий | Beryllium | [ bəˈrɪliəm ] |
| 5 | B | Borum | Бор | Boron | [ ˈbɔːrɒn ] |
| 6 | C | Carboneum | Углерод | Carbon | [ ˈkɑːbən ] |
| 7 | N | Nitrogenium | Азот | Nitrogen | [ ˈnaɪtrədʒən ] |
| 8 | O | Oxygenium | Кислород | Oxygen | [ ˈɒksɪdʒən ] |
| 9 | F | Fluorum | Фтор | Fluorine | [ ˈflʊəriːn ] |
| 10 | Ne | Neon | Неон | Neon | [ ˈniːɒn ] |
| 11 | Na | Natrium | Натрий | Sodium | [ ˈsəʊdɪəm ] |
| 12 | Mg | Magnesium | Магний | Magnesium | [ mæɡˈniːzɪəm ] |
| 13 | Al | Aluminium | Алюминий | Aluminum | [ əˈluːmɪnəm ] |
| 14 | Si | Silicium | Кремний | Silicon | [ ˈsɪlɪkən ] |
| 15 | P | Phosphorus | Фосфор | Phosphorus | [ ˈfɒsfərəs ] |
| 16 | S | Sulfur | Сера | Sulfur | [ ˈsəlfə ] |
| 17 | Cl | Chlorum | Хлор | Chlorine | [ ˈklɔːriːn ] |
| 18 | Ar | Argon | Аргон | Argon | [ ˈɑːɡɒn ] |
| 19 | K | Kalium | Калий | Potassium | [ pəˈtæsɪəm ] |
| 20 | Ca | Calcium | Кальций | Calcium | [ ˈkælsɪəm ] |
| 21 | Sc | Scandium | Скандий | Scandium | [ ˈskændɪəm ] |
| 22 | Ti | Titanium | Титан | Titanium | [ t(a)ɪ’teɪnɪəm ] |
| 23 | V | Vanadium | Ванадий | Vanadium | [ vəˈneɪdiəm ] |
| 24 | Cr | Chromium | Хром | Chromium | [ ˈkrəʊmɪəm ] |
| 25 | Mn | Manganum | Марганец | Manganese | [ ˈmæŋɡəniːz ] |
| 26 | Fe | Ferrum | Железо | Iron | [ ˈaɪən ] |
| 27 | Co | Cobaltum | Кобальт | Cobalt | [ ˈkəʊbɔːlt ] |
| 28 | Ni | Niccolum | Никель | Nickel | [ ˈnɪkəl ] |
| 29 | Cu | Cuprum | Медь | Copper | [ ˈkɒpə ] |
| 30 | Zn | Zincum | Цинк | Zinc | [ zɪŋk ] |
| 31 | Ga | Gallium | Галлий | Gallium | [ ˈɡæliəm ] |
| 32 | Ge | Germanium | Германий | Germanium | [ dʒɜːˈmeɪniəm ] |
| 33 | As | Arsenicum | Мышьяк | Arsenic | [ ˈɑːsnɪk ] |
| 34 | Se | Selenium | Селен | Selenium | [ sɪˈliːnɪəm ] |
| 35 | Br | Bromum | Бром | Bromine | [ ˈbrəʊmiːn ] |
| 36 | Kr | Krypton | Криптон | Krypton | [ ˈkrɪptɒn ] |
| 37 | Rb | Rubidium | Рубидий | Rubidium | [ rʊˈbɪdiəm ] |
| 38 | Sr | Strontium | Стронций | Strontium | [ ˈstrɒntɪəm ] |
| 39 | Y | Yttrium | Иттрий | Yttrium | [ ˈɪtriəm ] |
| 40 | Zr | Zirconium | Цирконий | Zirconium | [ zɜːˈkəʊniəm ] |
| 41 | Nb | Niobium | Ниобий | Niobium | [ naɪ’əubɪəm ] |
| 42 | Mo | Molybdaenum | Молибден | Molybdenum | [ məˈlɪbdənəm ] |
| 43 | Tc | Technetium | Технеций | Technetium | [ tek’niːʃɪəm ] |
| 44 | Ru | Ruthenium | Рутений | Ruthenium | [ ruːˈθiːnjəm ] |
| 45 | Rh | Rhodium | Родий | Rhodium | [ ˈrəʊdiəm ] |
| 46 | Pd | Palladium | Палладий | Palladium | [ pəˈleɪdiəm ] |
| 47 | Ag | Argentum | Серебро | Silver | [ ˈsɪlvə ] |
| 48 | Cd | Cadmium | Кадмий | Cadmium | [ ˈkædmɪəm ] |
| 49 | In | Indium | Индий | Indium | [ ˈɪndiəm ] |
| 50 | Sn | Stannum | Олово | Tin | [ ˈtɪn ] |
| 51 | Sb | Stibium | Сурьма | Antimony | [ ˈæntɪməni ] |
| 52 | Te | Tellurium | Теллур | Tellurium | [ teˈlʊriəm ] |
| 53 | I | Jodum | Иод | Iodine | [ ˈaɪədiːn ] |
| 54 | Xe | Xenon | Ксенон | Xenon | [ ˈzenɒn ] [ˈziːnɒn ] |
| 55 | Cs | Caesium | Цезий | Cesium | [ ˈsiːziəm ] |
| 56 | Ba | Barium | Барий | Barium | [ ˈbeəriəm ] |
| 57 | La | Lanthanum | Лантан | Lanthanum | [ ˈlænθənəm ] |
| 58 | Ce | Cerium | Церий | Cerium | [ ˈsɪərɪəm ] |
| 59 | Pr | Praseodymium | Празеодим | Praseodymium | [ˌpreɪziːəʊˈdɪmɪəm] |
| 60 | Nd | Neodymium | Неодим | Neodymium | [ ˌniːəu’dɪmɪəm ] |
| 61 | Pm | Promethium | Прометий | Promethium | [ prəˈmiːθiəm ] |
| 62 | Sm | Samarium | Самарий | Samarium | [ səˈmeɪrɪəm ] |
| 63 | Eu | Europium | Европий | Europium | [ jʊˈropiəm ] |
| 64 | Gd | Gadolinium | Гадолиний | Gadolinium | [ ˌɡædɒˈlɪnɪəm ] |
| 65 | Tb | Terbium | Тербий | Terbium | [ ˈtɜːbɪəm ] |
| 66 | Dy | Dysprosium | Диспрозий | Dysprosium | [ dɪsˈprəʊʃɪəm ] |
| 67 | Ho | Holmium | Гольмий | Holmium | [ ˈholmiəm ] |
| 68 | Er | Erbium | Эрбий | Erbium | [ ˈɜːbiəm ] |
| 69 | Tm | Thulium | Тулий | Thulium | [ ˈθjuːlɪəm ] |
| 70 | Yb | Ytterbium | Иттербий | Ytterbium | [ ɪˈtɜːbjəm ] |
| 71 | Lu | Lutetium | Лютеций | Lutetium | [ lu:ʹti:ʃjəm ] |
| 72 | Hf | Hafnium | Гафний | Hafnium | [ ˈhæfniəm ] |
| 73 | Ta | Tantalum | Тантал | Tantalum | [ ˈtæntələm ] |
| 74 | W | Wolfram | Вольфрам | Tungsten | [ ˈtʌŋstən ] |
| 75 | Re | Rhenium | Рений | Rhenium | [ ˈriːniəm ] |
| 76 | Os | Osmium | Осмий | Osmium | [ ˈɒzmiəm ] |
| 77 | Ir | Iridium | Иридий | Iridium | [ ɪˈrɪdɪəm ] |
| 78 | Pt | Platinum | Платина | Platinum | [ ˈplætɪnəm ] |
| 79 | Au | Aurum | Золото | Gold | [ ɡəʊld ] |
| 80 | Hg | Hydrargyrum | Ртуть | Mercury | [ ˈmɜːkjʊri ] |
| 81 | Tl | Thallium | Таллий | Thallium | [ ˈθæliəm ] |
| 82 | Pb | Plumbum | Свинец | Lead | [ led ] |
| 83 | Bi | Bismuthum | Висмут | Bismuth | [ ˈbɪzməθ ] |
| 84 | Po | Polonium | Полоний | Polonium | [ pəˈləʊniəm ] |
| 85 | At | Astatium | Астат | Astatine | [ ‘æstətiːn ] |
| 86 | Rn | Radon | Радон | Radon | [ ˈreɪdɒn ] |
| 87 | Fr | Francium | Франций | Francium | [ ‘frænsɪəm ] |
| 88 | Ra | Radium | Радий | Radium | [ ˈreɪdɪəm ] |
| 89 | Ac | Actinium | Актиний | Actinium | [ ækˈtɪnɪəm ] |
| 90 | Th | Thorium | Торий | Thorium | [ ˈθɔːriəm ] |
| 91 | Pa | Protactinium | Протактиний | Protactinium | [ ˌprəʊtækˈtɪniəm ] |
| 92 | U | Uranium | Уран | Uranium | [ jʊˈreɪnɪəm ] |
| 93 | Np | Neptunium | Нептуний | Neptunium | [ nepˈtjuːniəm ] |
| 94 | Pu | Plutonium | Плутоний | Plutonium | [ pluːˈtəʊnɪəm ] |
| 95 | Am | Americium | Америций | Americium | [ ˌæməˈrɪsiəm ] |
| 96 | Cm | Curium | Кюрий | Curium | [ ˈkjʊərɪəm ] |
| 97 | Bk | Berkelium | Берклий | Berkelium | [ bɜː’kiːlɪəm ] |
| 98 | Cf | Californium | Калифорний | Californium | [ ˌkælɪˈfɔːnjəm ] |
| 99 | Es | Einsteinium | Эйнштейний | Einsteinium | [ ˌaɪn’staɪnɪəm ] |
| 100 | Fm | Fermium | Фермий | Fermium | [ ˈfermiəm ] |
| 101 | Md | Mendelevium | Менделевий | Mendelevium | [ ˌmendəˈliːviəm ] |
| 102 | No | Nobelium | Нобелий | Nobelium | [ noˈbeliəm ] |
| 103 | Lr | Lawrencium | Лоуренсий | Lawrencium | [ lɒˈrensiəm ] |
| 104 | Rf | Rutherfordium | Резерфордий | Rutherfordium | [ ˌrʌðə’fɔːdɪəm ] |
| 105 | Db | Dubnium | Дубний | Dubnium | [ ‘dʌbnɪəm ] |
| 106 | Sg | Seaborgium | Сиборгий | Seaborgium | [ ‘siːbɔːgɪəm ] |
| 107 | Bh | Bohrium | Борий | Bohrium | [ ‘bɔrɪəm ] |
| 108 | Hs | Hassium | Хассий | Hassium | [ ‘hæsɪəm ] |
| 109 | Mt | Meitnerium | Мейтнерий | Meitnerium | [ ˌmaɪt’nɪərɪəm ] |
Калькулятор ЭДС гальванического элемента
Калькулятор ЭДС гальванического элемента – это простой инструмент, который предоставляет вам значение электродвижущей силы (EMF) для любой гальванической ячейки с заданным потенциалом электродов. Если вы немного запутались со всеми этими терминами, не волнуйтесь!
Если вы немного запутались со всеми этими терминами, не волнуйтесь!
В статье ниже вы найдете краткое описание того, что такое ЭДС, как рассчитать ЭДС и примеры источников электродвижущей силы. Более того, мы подготовили объяснение окислительно-восстановительной реакции и гальванического элемента. Краткое пошаговое руководство демонстрирует использование калькулятора.
Что такое ЭДС?
ЭДС – это сокращение от электродвижущей силы. По определению, ЭДС – это сила или электрическое давление, которое генерирует ток в цепи. Единицы измерения ЭДС в вольтах [В].
Чтобы лучше понять это определение, рассмотрим типичную гальваническую ячейку, состоящую из двух электродов. Электродвижущая сила – это разность потенциалов между ними.
Кроме того, электродвижущая сила гальванического элемента определяет способность электрохимического элемента вызывать поток электронов через электрическую цепь.
Уравнение ЭДС
Электродвижущая сила электрохимической ячейки может быть рассчитана с использованием уравнения:
EMFcell [V] = Ecathode [V] – Eanode [V]
где Ecathode – это потенциал катода (в вольтах), а Eanode – это потенциал анода (в вольтах). Помните, что в ячейке потенциал катода выше, чем потенциал анода.
Помните, что в ячейке потенциал катода выше, чем потенциал анода.
Электропотенциал анода и катода
Если вы хотите найти потенциал металлического электрода, один из способов – проверить гальванический ряд и найти конкретный металл в таблице. Второй способ – рассчитать его, используя уравнение Нерста, также известное как уравнение потенциала ячейки. Эта формула позволяет рассчитать восстановительный потенциал полуклеточной или полной клеточной реакции.
В таблице ниже вы можете найти электропотенциал металлов:
Стандартные электродные потенциалы металлов при 25 °С
Электрод | Электродная реакция | Потенциалы Е°, В |
|---|---|---|
Li / Li+ | Li+ + e–= Li | -3,045 |
Rb / Rb+ | Rb+ + e–= Rb | -2,925 |
K / K+ | K+ + e–= K | -2,924 |
Cs / Cs+ | Cs+ + e–= Cs | -2,923 |
Ba / Ba2+ | Ba2+ + 2e–= Ba | -2,905 |
Sr / Sr2+ | Sr2+ + 2e–= Sr | -2,888 |
Ca / Ca2+ | Ca2+ + 2e–= Ca | -2,866 |
Na / Na+ | Na+ + e–= Na | -2,714 |
Mg / Mg2+ | Mg2+ + 2e–= Mg | -2,363 |
Sc / Sc3+ | Sc3+ +3e–= Sc | -2,077 |
Be / Be2+ | Be2+ + 2e–= Be | -1,847 |
Al / Al3+ | Al3+ + 3e–= Al | -1,660 |
Mn / Mn2+ | Mn2+ + 2e–= Mn | -1,179 |
Cr / Cr2+ | Cr2+ + 2e–= Cr | -0,913 |
Zn / Zn2+ | Zn2+ + 2e–= Zn | -0,760 |
Fe / Fe2+ | Fe2+ + 2e–= Fe | -0,440 |
Cd / Cd2+ | Cd2+ + 2e–= Cd | -0,400 |
Co / Co2+ | Co2+ + 2e–= Co | -0,277 |
Ni / Ni2+ | Ni2+ + 2e–= Ni | -0,250 |
Sn / Sn2+ | Sn2+ + 2e–= Sn | -0,136 |
Pb / Pb2+ | Pb2+ + 2e–= Pb | -0,126 |
h3 / H+ | 2H+ + 2e–= H2 | 0,000 |
Sb / Sb3+ | Sb3+ + 3e–= Sb | +0,2 |
Bi / Bi3+ | Bi3+ + 3e–= Bi | +0,23 |
Cu / Cu2+ | Cu2+ + 2e–= Cu | +0,337 |
Hg / Hg+ | Hg+ + 1e–= Hg | +0,788 |
Ag / Ag+ | Ag+ + e–= Ag | +0,799 |
Pd / Pd2+ | Pd2+ 2e–= Pd | +0,987 |
Pt / Pt2+ | Pt2+ + 2e–= Pt | +1,188 |
Au / Au+ | Au+ + e–= Au | +1,692 |
Как рассчитать ЭДС?
Взгляните на пример расчета ЭДС ниже.
Давайте рассмотрим ячейку Даниэля – простую электрохимическую ячейку, изобретенную в 1836 году Джоном Фредериком Даниэлем (британский химик и метеоролог). В этой ячейке медь погружается в раствор сульфата меди (II), а цинк – в раствор сульфата цинка.
Схема ячейки: (-) Zn | Zn2 + || Cu2 + | Cu (+)
Проверьте потенциал металла: электродный потенциал цинка составляет -0,76 В, а меди – +0,34 В ⇒ из-за более низкого потенциала цинк является анодом, а медь – катодом. Введите эти значения в наш калькулятор.
Рассчитайте значение ЭДС электрохимической ячейки, используя уравнение:
EMFcell = +0,34 В – (-0,76 В) = 1,10 В
Электродвижущая сила ячейки Даниэля равна 1,10 вольт.
Источники электродвижущей силы
Ниже вы можете найти несколько примеров источников ЭМП:
- батареи
- генераторы переменного тока
- гальванические элементы
- солнечные батареи
- топливные элементы
- термопары
- некоторые живые организмы (например, электрический угорь)
Каждый из перечисленных выше источников ЭДС содержит источник энергии, который вызывает поток электрических зарядов. Этими источниками могут быть химические процессы (в батареях, топливе и гальванических элементах), механические силы (в генераторах), электромагнитное излучение, излучаемое Солнцем (в солнечных элементах) и разность температур (в термопарах).
Типы электрохимических ячеек
Электрохимическая ячейка является одним из видов источников энергии. Его можно создать, поместив металлические электроды в электролит, где химическая реакция генерирует или использует электрический ток.
Электрохимические элементы, которые генерируют электрический ток, называются гальваническими элементами (названными в честь их изобретателя, итальянского физика Алессандро Вольта) или гальваническими элементами (названными в честь итальянского физика и врача Луиджи Гальвани).
Обычные батареи состоят из одного или нескольких таких элементов. В других электрохимических элементах электрический ток, подаваемый извне, используется для запуска химической реакции (которая не должна происходить самопроизвольно).
Окислительно-восстановительная реакция
Процессы восстановления и окисления происходят только вместе (невозможно, чтобы эти реакции происходили отдельно). Вот почему окислительно-восстановительные реакции могут быть описаны как две полуреакции, одна представляет процесс окисления, а другая – процесс восстановления. Давайте посмотрим на это на примере ячейки Даниэля.
В ячейке Даниэля медь погружается в раствор сульфата меди (II), а цинк – в раствор сульфата цинка. В этой ячейке цинк действует как анод (из-за более низкого электрического потенциала), а медь действует как катод (из-за более высокого электропотенциала):
E⁰ цинкового электрода = -0,76 В
E⁰ медного электрода = +0,34 В
Общая химическая реакция клетки Даниэля: Zn (s) + Cu2⁺ (aq) → Zn²⁺ (aq) + Cu (s)
Окисление (на аноде): Zn (s) → Zn²⁺ (aq) + 2e⁻
Восстановление (на катоде): Cu2⁺ (aq) + 2e⁻ → Cu (s)
Количество электронов, потерянных восстановителем, равно числу электронов, полученных окислителем (для любой окислительно-восстановительной реакции).
Частей Периодической таблицы
Разница в электроотрицательности двух связанных элементов определяет, какой тип связи они сформируют. Когда атомы с разницей электроотрицательностей больше чем две единицы соединяются вместе, то образуется связь ионная связь , в которой более электроотрицательный элемент имеет отрицательный заряд, а менее электроотрицательный элемент имеет положительный заряд.(По аналогии вы можете думать об этом как о игра в перетягивание каната, в которой одна команда достаточно сильна, чтобы вытащить веревку подальше от другой команды.) Например, натрий имеет электроотрицательность 0,93, а хлор имеет электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионный связь, в которой хлор забирает электрон у натрия, с образованием катиона натрия Na + и хлорид-аниона, Класс – .Определенные ионы натрия и хлорида не являются «связаны» вместе, но они очень сильно привлекают друг друга из-за противоположные заряды и образуют прочную кристаллическую решетку.
Когда атомы с разностью электроотрицательностей менее двух единицы соединяются вместе, образуемая связь представляет собой ковалентную связь связь , в которой электроны разделяют оба атома. Когда два одного и того же атома делить электроны ковалентной связью, между ними нет разницы в электроотрицательности, и электроны в ковалентной связи делятся на поровну – что есть симметричное распределение электронов между связанными атомами.Эти связи неполярные. ковалентные связи . (По аналогии вы можете думать об этом как о игра в перетягивание каната между двумя одинаково сильными командами, в которой веревка не двигается.) Например, когда два хлора атомы соединены ковалентной связью, электроны проводят так же много времени близко к одному атому хлора, как они делают к другому, и полученная молекула неполярна:
Квантовые числа и электронные конфигурации
Квантовые числа и электронные конфигурацииКвантовые числа и электрон Конфигурации
Квантовые числа
Модель Бора была одномерной моделью, которая использовала одно квантовое число для описания распределение электронов в атоме.Единственная важная информация – это размер . орбиты, которая описывалась квантовым числом n . Модель Шредингера позволил электрону занять трехмерное пространство. Следовательно, потребовалось три координаты или три квантовых числа , чтобы описать орбитали, на которых электроны может быть найден.
Три координаты, которые происходят из волновых уравнений Шредингера, являются главными ( n ), угловые ( l ) и магнитные ( m ) квантовые числа.Эти квантовые числа описывают размер, форму и ориентацию в пространстве орбиталей атома.
Главное квантовое число ( n ) описывает размер орбитали. Например, орбитали, для которых n = 2, больше, чем те, для которых n = 1. Поскольку они имеют противоположные электрические заряды, электроны притягиваются к ядру атом. Следовательно, для возбуждения электрона с орбитали, на которой электрон приближается к ядру ( n = 1) на орбиталь, в которой он находится дальше из ядра ( n = 2).Поэтому главное квантовое число косвенно описывает энергию орбитали.
Угловое квантовое число ( l ) описывает форму орбитали. Орбитали имеют форму, которую лучше всего описать как сферическую ( l = 0), полярную ( l = 0). = 1) или клеверный лист ( l = 2). Они могут даже принимать более сложные формы, поскольку углового квантового числа становится больше.
Существует только один способ ориентирования сферы ( l = 0) в пространстве.Однако орбитали полярной ( l = 1) или клеверной ( l = 2) формы могут указывают в разные стороны. Поэтому нам нужно третье квантовое число, известное как магнитное число . квантовое число ( м ), чтобы описать ориентацию в пространстве определенного орбитальный. (Его называют магнитным квантовым числом из-за влияния различных ориентации орбиталей впервые наблюдались в присутствии магнитного поля.)
Правила, регулирующие допустимые комбинации Квантовые числа
- Три квантовых числа ( n , l и m ), которые описывают орбитальную являются целыми числами: 0, 1, 2, 3 и т. д.
- Главное квантовое число ( n ) не может быть нулевым. Допустимые значения n поэтому равны 1, 2, 3, 4 и так далее.
- Угловое квантовое число ( l ) может быть любым целым числом от 0 до n – 1. Если n = 3, например, l может быть 0, 1 или 2.
- Магнитное квантовое число ( m ) может быть любым целым числом от – l и + л . Если l = 2, m может иметь значение -2, -1, 0, +1 или +2.
Оболочки и подоболочки орбиталей
Орбитали с одинаковым значением главного квантового числа образуют оболочку .Орбитали внутри оболочки делятся на подоболочек , которые имеют такое же значение угловое квантовое число. Химики описывают оболочку и подоболочку, в которых орбитальный принадлежит с двухсимвольным кодом, например 2 p или 4 f . Первый персонаж обозначает оболочку ( n = 2 или n = 4). Второй символ обозначает подоболочка. По соглашению следующие строчные буквы используются для обозначения различных подоболочки.
| с : | л = 0 | |
| п. : | л = 1 | |
| д : | л = 2 | |
| f : | л = 3 |
Хотя в первых четырех буквах нет шаблона ( s , p , d , f ), буквы перемещаются в алфавитном порядке с этой точки ( g , h и т. д.).Несколько допустимых комбинаций квантовых чисел n и l показаны на рисунок ниже.
Третье правило, ограничивающее допустимые комбинации n , l и m квантовые числа имеют важное следствие. Он заставляет количество подоболочек в оболочке быть равным главному квантовому числу оболочки. Корпус n = 3, для Например, содержит три подоболочки: 3 s , 3 p и 3 d орбиталей.
Возможные комбинации квантовых чисел
В оболочке n = 1 только одна орбиталь, потому что в ней только один путь. который сфера может быть ориентирована в пространстве. Единственная допустимая комбинация квантовых чисел для которого n = 1 следующее.
В оболочке n = 2 четыре орбитали.
| 2 | 1 | –1 | ||||
| 2 | 1 | 0 | 2п | |||
| 2 | 1 | 1 |
В подоболочке 2 s только одна орбиталь.Но есть три орбитали в подоболочка 2 p , потому что существует три направления, в которых орбитальная оболочка p может точка. Одна из этих орбиталей ориентирована по оси X , другая – по оси Y . ось, а третья – по оси Z системы координат, как показано на рисунке ниже. Следовательно, эти орбитали известны как 2 p x , 2 p y , и 2 p z орбиталей.
В оболочке n = 3 девять орбиталей.
| n | л | м | ||||
| 3 | 0 | 0 | 3 с | |||
| 3 | 1 | –1 | ||||
| 3 | 1 | 0 | 3 п. | |||
| 3 | 1 | 1 | ||||
| 3 | 2 | -2 | ||||
| 3 | 2 | –1 | 3 г | |||
| 3 | 2 | 0 | ||||
| 3 | 2 | 1 | ||||
| 3 | 2 | 2 |
В подоболочке 3 s имеется одна орбиталь, а в подоболочке 3 p – три орбитали. подоболочка.Однако оболочка n = 3 также включает в себя 3 орбитали d .
Пять различных ориентаций орбиталей в подоболочке 3 d показаны на рисунок ниже. Одна из этих орбиталей лежит в плоскости XY самолета XYZ . системы координат и называется орбитальной 3 d xy . 3 d xz и 3 d yz орбитали имеют одинаковую форму, но лежат между осями система координат в плоскостях XZ и YZ .Четвертая орбиталь в этом подоболочка лежит вдоль осей X и Y и называется 3 d x 2 – y 2 орбитальный. Большая часть пространства, занимаемого пятой орбиталью, лежит вдоль оси Z и эта орбиталь называется орбиталью 3 d z 2 .
Число орбиталей в оболочке – это квадрат главного квантового числа: 1 2 = 1, 2 2 = 4, 3 2 = 9.В подоболочке s ( l ) имеется одна орбиталь. = 0), три орбитали в подоболочке p ( l = 1) и пять орбиталей в подоболочке d подоболочка ( л, = 2). Таким образом, количество орбиталей в подоболочке равно 2 ( l ) + 1.
Прежде чем мы сможем использовать эти орбитали, нам нужно знать количество электронов, которые могут занимают орбиталь и как их можно отличить друг от друга. Экспериментальный данные свидетельствуют о том, что орбиталь может содержать не более двух электронов.
Чтобы различать два электрона на орбитали, нам нужен четвертый квант количество. Это называется спиновым квантовым числом ( s ), потому что электроны ведут себя как если бы они вращались либо по часовой стрелке, либо против часовой стрелки. Один из электронам на орбитали произвольно назначается квантовое число s +1/2, другому присваивается квантовое число с -1/2. Таким образом, требуется три квантовых числа чтобы определить орбитальное, но четыре квантовых числа, чтобы идентифицировать один из электронов, который может занимают орбиталь.
Допустимые комбинации квантовых чисел n , l и m для Первые четыре оболочки приведены в таблице ниже. Для каждой из этих орбиталей есть два допустимые значения спинового квантового числа, с .
Сводка допустимых комбинаций квантовой Номера
| n | л | м | Обозначение подоболочки | Число орбиталей в подоболочке | Число электронов, необходимых для заполнения подоболочки | Общее количество электронов в подоболочке | |||||
| 1 | 0 | 0 | 1с | 1 | 2 | 2 | |||||
| 2 | 0 | 0 | 2с | 1 | 2 | ||||||
| 2 | 1 | 1,0, -1 | 2п | 3 | 6 | 8 | |||||
| 3 | 0 | 0 | 3с | 1 | 2 | ||||||
| 3 | 1 | 1,0, -1 | 3 пол. | 3 | 6 | ||||||
| 3 | 2 | 2,1,0, -1, -2 | 3д | 5 | 10 | 18 | |||||
| 4 | 0 | 0 | 4s | 1 | 2 | ||||||
| 4 | 1 | 1,0, -1 | 4 пол. | 3 | 6 | ||||||
| 4 | 2 | 2,1,0, -1, -2 | 4д | 5 | 10 | ||||||
| 4 | 3 | 3,2,1,0, -1, -2, -3 | 4f | 7 | 14 | 32 | |||||
Относительные энергии атомных орбиталей
Из-за силы притяжения между объектами с противоположным зарядом наибольшая важным фактором, влияющим на энергию орбитали, является ее размер и, следовательно, значение главного квантового числа n .Для атома, содержащего только один электрон, нет разницы между энергиями разных подоболочек внутри оболочки. В 3 s , 3 p и 3 d орбитали, например, имеют одинаковую энергию в атом водорода. Модель Бора, которая определяла энергии орбит в терминах ничего больше, чем расстояние между электроном и ядром, поэтому работает для этого атом.
Однако атом водорода необычен.Как только атом содержит более одного электрона разные подоболочки больше не имеют одинаковой энергии. Внутри данной оболочки орбитали s всегда имеют самую низкую энергию. Энергия подоболочек постепенно становится больше по мере увеличения значения углового квантового числа.
Относительные энергии: с < p < d < f
В результате два фактора контролируют энергию орбиты для большинства атомы: размер орбитали и ее форма, как показано на рисунке ниже.
Можно сконструировать очень простое устройство для оценки относительной энергии атомных орбиталей. Допустимые комбинации n и l квант числа организованы в таблицу, как показано на рисунке ниже, а стрелки нарисованы на 45 углы градусов, указывающие на нижний левый угол таблицы.
Затем считывают порядок увеличения энергии орбиталей, следуя этим стрелки, начиная с верхней части первой строки и затем переходя ко второй, третьей, четвертые строки и так далее.Эта диаграмма предсказывает следующий порядок увеличения энергии для атомных орбиталей.
1 с <2 с <2 p <3 с <3 p <4 с <3 с <4 с <5 с <4 с <5 с <6 с <4 с <5 с <6 с <7 с <5 с <6 d <7 p <8 s …
Электронные конфигурации, принцип Ауфбау, Вырожденные орбитали и правило Хунда
Электронная конфигурация атома описывает орбитали, занятые электроны на атоме. В основе этого прогноза лежит правило, известное как aufbau. принцип , который предполагает, что электроны добавляются к атому по одному, начиная с самой низкой энергетической орбиталью, пока все электроны не будут помещены в соответствующий орбитальный.
Атом водорода ( Z = 1) имеет только один электрон, который переходит в наименьшую энергию орбитальный, 1 s орбитальный. На это указывает надстрочный индекс «1». после символа орбиты.
H ( Z = 1): 1 с 1
Следующий элемент имеет два электрона, и второй электрон заполняет 1 s орбитали. потому что есть только два возможных значения спинового квантового числа, используемого для различения между электронами на орбитали.
He ( Z = 2): 1 с 2
Третий электрон переходит на следующую орбиталь на энергетической диаграмме, 2 с орбитальный.
Li ( Z = 3): 1 с 2 2 с 1
Четвертый электрон заполняет эту орбиталь.
Be ( Z = 4): 1 с 2 2 с 2
После заполнения орбиталей 1 с и 2 с , следующая наименьшая энергия орбитали – это три орбитали 2 p .Пятый электрон, следовательно, переходит в один из эти орбитали.
B ( Z = 5): 1 с 2 2 с 2 2 p 1
Когда приходит время добавить шестой электрон, конфигурация электронов очевидна.
C ( Z = 6): 1 с 2 2 с 2 2 с 2
Однако в подоболочке 2 p есть три орбитали.Второй электрон попадает на ту же орбиталь, что и первый, или переходит на одну из других орбиталей в эта подоболочка?
Чтобы ответить на этот вопрос, нам нужно понять концепцию вырожденных орбиталей . По По определению, орбитали вырождены , когда они имеют одинаковую энергию. Энергия орбиталь зависит как от ее размера, так и от формы, потому что электрон тратит больше время дальше от ядра атома по мере того, как орбиталь становится больше или форма становится более сложным.Однако в изолированном атоме энергия орбитали не зависят от направления, в котором он указывает в пространстве. Орбитали, которые отличаются только своим ориентация в пространстве, например 2 p x , 2 p y и 2 p z орбитали, следовательно, вырождены.
Электроны заполняют вырожденные орбитали в соответствии с правилами, впервые сформулированными Фридрихом Хундом. Hund’s Правила можно резюмировать следующим образом.
- Один электрон добавляется к каждой из вырожденных орбиталей в подоболочке перед двумя электроны добавляются к любой орбитали подоболочки.
- Электроны добавляются к подоболочке с тем же значением спинового квантового числа, пока каждая орбиталь подоболочки имеет по крайней мере один электрон.
Когда приходит время поместить два электрона в подоболочку 2 p , мы помещаем один электрон на каждую из двух этих орбиталей.(Выбор между 2 р х , 2 p y и 2 p z орбитали являются произвольными.)
C ( Z = 6): 1 с 2 2 с 2 2 p x 1 2 п y 1
Тот факт, что оба электрона в подоболочке 2 p имеют одинаковый спин квантовое число может быть показано представлением электрона, для которого с = +1/2 с
стрелка вверх и электрон, для которого с = -1/2 со стрелкой, указывающей вниз.
Таким образом, электроны на орбиталях 2 p на углероде могут быть представлены как следует.
Когда мы дойдем до N ( Z = 7), мы должны поместить по одному электрону в каждый из трех вырожденные 2 p орбиталей.
| N ( Z = 7): | 1 с 2 2 с 2 2 с 3 |
Поскольку каждая орбиталь в этой подоболочке теперь содержит один электрон, следующий электрон добавленный к подоболочке должен иметь противоположное квантовое число спина, тем самым заполняя одно из орбитали 2 p .
| O ( Z = 8): | 1 с 2 2 с 2 2 с 4 |
Девятый электрон заполняет вторую орбиталь этой подоболочки.
| F ( Z = 9): | 1 с 2 2 с 2 2 с 5 |
Десятый электрон завершает подоболочку 2 p .
| Ne ( Z = 10): | 1 с 2 2 с 2 2 с 6 |
Есть что-то необычно стабильное в атомах, таких как He и Ne, у которых есть электроны. конфигурации с заполненными оболочками орбиталей.Поэтому по соглашению мы пишем сокращенные электронные конфигурации с точки зрения количества электронов за пределами предыдущий элемент с электронной конфигурацией заполненной оболочки. Электронные конфигурации следующие два элемента в периодической таблице, например, можно было бы записать следующим образом.
Na ( Z = 11): [Ne] 3 с 1
Mg ( Z = 12): [Ne] 3 с 2
Процесс aufbau можно использовать для прогнозирования электронной конфигурации элемента.Фактическая конфигурация, используемая элементом, должна быть определена экспериментально. В экспериментально определенные электронные конфигурации для элементов первых четырех рядов периодической таблицы Менделеева приведены в таблице в следующем разделе.
Электронные конфигурации элементов
(элементы 1-го, 2-го, 3-го и 4-го ряда)
| Атомный номер | Обозначение | Электронная конфигурация | ||
| 1 | H | 1 с 1 | ||
| 2 | He | 1 с 2 = [He] | ||
| 3 | Li | [He] 2 с 1 | ||
| 4 | Be | [He] 2 с 2 | ||
| 5 | B | [He] 2 с 2 2 с 1 | ||
| 6 | С | [He] 2 с 2 2 с 2 | ||
| 7 | N | [He] 2 с 2 2 с 3 | ||
| 8 | O | [He] 2 с 2 2 с 4 | ||
| 9 | Ф | [He] 2 с 2 2 с 5 | ||
| 10 | Ne | [He] 2 с 2 2 p 6 = [Ne] | ||
| 11 | Na | [Ne] 3 с 1 | ||
| 12 | мг | [Ne] 3 с 2 | ||
| 13 | Al | [Ne] 3 с 2 3 с 1 | ||
| 14 | Si | [Ne] 3 с 2 3 с 2 | ||
| 15 | -П, | [Ne] 3 с 2 3 с 3 | ||
| 16 | S | [Ne] 3 с 2 3 с 4 | ||
| 17 | Класс | [Ne] 3 с 2 3 с 5 | ||
| 18 | Ar | [Ne] 3 с 2 3 p 6 = [Ar] | ||
| 19 | К | [Ar] 4 с 1 | ||
| 20 | Ca | [Ar] 4 с 2 | ||
| 21 | SC | [Ar] 4 с 2 3 d 1 | ||
| 22 | Ti | [Ar] 4 с 2 3 d 2 | ||
| 23 | В | [Ar] 4 с 2 3 d 3 | ||
| 24 | Cr | [Ar] 4 с 1 3 d 5 | ||
| 25 | Mn | [Ar] 4 с 2 3 d 5 | ||
| 26 | Fe | [Ar] 4 с 2 3 d 6 | ||
| 27 | Co | [Ar] 4 с 2 3 d 7 | ||
| 28 | Ni | [Ar] 4 с 2 3 d 8 | ||
| 29 | Cu | [Ar] 4 с 1 3 d 10 | ||
| 30 | Zn | [Ar] 4 с 2 3 d 10 | ||
| 31 | Ga | [Ar] 4 s 2 3 d 10 4 p 1 | ||
| 32 | Ge | [Ar] 4 s 2 3 d 10 4 p 2 | ||
| 33 | как | [Ar] 4 s 2 3 d 10 4 p 3 | ||
| 34 | SE | [Ar] 4 s 2 3 d 10 4 p 4 | ||
| 35 | Br | [Ar] 4 s 2 3 d 10 4 p 5 | ||
| 36 | Кр | [Ar] 4 s 2 3 d 10 4 p 6 = [Kr] | ||
Исключения из прогнозируемых электронных конфигураций
Есть несколько шаблонов электронных конфигураций, перечисленных в таблице в предыдущий раздел.Одним из наиболее поразительных является поразительный уровень согласия между эти конфигурации и конфигурации, которые мы могли бы спрогнозировать. Есть только два Исключения среди первых 40 элементов: хром и медь.
Строгое соблюдение правил процесса aufbau предсказывает следующее: электронные конфигурации для хрома и меди.
| предсказанные электронные конфигурации: | Cr ( Z = 24): [Ar] 4 с 2 3 d 4 | |
| Cu ( Z = 29): [Ar] 4 с 2 3 d 9 |
Экспериментально определенные конфигурации электронов для этих элементов слегка другой.
| актуальные электронные конфигурации: | Cr ( Z = 24): [Ar] 4 с 1 3 d 5 | |
| Cu ( Z = 29): [Ar] 4 с 1 3 d 10 |
В каждом случае один электрон был переведен с орбитали 4 s на орбиталь 3 d орбитали, хотя предполагается, что орбитали 3 d находятся на более высоком уровне, чем 4 с по орбите.
Как только мы выйдем за пределы атомного номера 40, разница между энергиями соседних орбитали достаточно малы, чтобы переносить электрон с одного орбитально к другому. Большинство исключений из электронной конфигурации, предсказанных из поэтому показанная ранее диаграмма aufbau встречается среди элементов с атомными номерами больше 40. Хотя заманчиво сосредоточить внимание на горстка элементов, электронные конфигурации которых отличаются от предсказанных с диаграммой aufbau удивительно то, что эта простая диаграмма работает для очень многих элементы.
Электронные конфигурации и периодическая таблица
Когда данные электронной конфигурации расположены так, что мы можем сравнивать элементы в одном из горизонтальные строки периодической таблицы, мы обнаруживаем, что эти строки обычно соответствуют заполнение оболочки орбиталей. Вторая строка, например, содержит элементы в которой заполнены орбитали в оболочке n = 2.
| Li ( Z = 3): | [He] 2 с 1 | |
| Be ( Z = 4): | [He] 2 с 2 | |
| B ( Z = 5): | [He] 2 с 2 2 с 1 | |
| C ( Z = 6): | [He] 2 с 2 2 с 2 | |
| N ( Z = 7): | [He] 2 с 2 2 с 3 | |
| O ( Z = 8): | [He] 2 с 2 2 с 4 | |
| F ( Z = 9): | [He] 2 с 2 2 с 5 | |
| Ne ( Z = 10): | [He] 2 с 2 2 с 6 |
В вертикальных столбцах или группах периодических стол тоже.Элементы в группе имеют схожую конфигурацию самых внешних электроны. Это соотношение можно увидеть, посмотрев на электронные конфигурации элементы в столбцах по обе стороны периодической таблицы.
| Группа IA | Группа VIIA | |||||
| H | 1 с 1 | |||||
| Ли | [He] 2 с 1 | Ф | [He] 2 с 2 2 с 5 | |||
| Na | [Ne] 3 с 1 | Класс | [Ne] 3 с 2 3 с 5 | |||
| К | [Ar] 4 с 1 | Br | [Ar] 4 s 2 3 d 10 4 p 5 | |||
| руб. | [Kr] 5 с 1 | I | [Kr] 5 s 2 4 d 10 5 p 5 | |||
| CS | [Xe] 6 с 1 | по адресу | [Xe] 6 s 2 4 f 14 5 d 10 6 p 5 |
На рисунке ниже показана взаимосвязь между периодической таблицей и орбиталями. заполняется во время процесса aufbau.Два столбца в левой части периодической таблица соответствует заполнению орбитали s . Следующие 10 столбцов включают элементы, в которых заполнены пять орбиталей в подоболочке d . Шесть столбцов на справа представляют заполнение трех орбиталей в подоболочке p . Наконец, 14 столбцов внизу таблицы соответствуют заполнению семи орбиталей в подоболочка f .
Элемент Kimyvi – Википедия
Элемент Kimyvi elementlərin müasir dövri cədvəliKimyəvi элемент – eyni cins atomlardan ibarət olan, fiziki və ya kimyəvi yollarla özündən daha sadə və fərqli maddələrə ayrıla bilməyən saf maddəlir element deyyr element deyyr element.Məsələn су бир элемент дейил. Lakin suyun elektrolizindən əldə edilən hidrogen və oksigen elementdirlər.
Elementi meydana gətirən bütün atomların böyüklükləri və atomların arasındakı uzaqlıq eynidir. Lakin бир elementin atomları ilə başqa bir elementin atomlarının böyüklükləri və atomları arasındakı məsafə fərqlidir. Eyni elementdən düzəldiln fərqli maddələr də eyni cins atomlardan meydana gəlirlər. Elementi meydana gətirən atomların bir-birinə olan uzaqlığı elementin qatı, Maye və qaz halına gör dəyişə bilər.Canlı və cansız varlıqların hamısı elementlərdən meydana gəlirlər. Kimyəvi элемент nüvəsinin yükü eyni olan atom növüdür. Kimyəvi elementlər bir-biri ilə birləşərək bizi əhatə edən aləmin bütün mürəkkəb maddələrini əmələ gətirirlər. Hər бир kimyəvi элемент nüvəsində eyni sayda elektrik yükü və atom örtüyündə eyni sayda elektron olan atomlardan ibarətdir. Атом kimyəvi elementin bütün xassələrini özündə saxlayan ən kiçik hissəcikdir və bütün maddələrin ilkin materialıdır. Атом müsbət yüklü nüvədən və onun ətrafında hərəkət edən mənfi yüklü elektronlardan ibarətdir.Atomların nüvəsi isə proton və neytronlardan təşkil olunmuşdur. Протон müsbət yüklü, нейтрон isə yüksüz zərrəcikdir. Dövri sistemdə elementin sıra nömrəsi protonların sayını, kütlə ədədi isə nuklonların sayını göstərir. Proton və neytron birlikdə nuklon adlanır.
Dövri sistem cədvəlini 1 mart 1869-cu ildə rus alimi D.İ.Mendeleyev tərtib etmişdir. Həmin cədvəldə cəmi 63 элемента mövcud idi. Mendeleyev elementləri atom kütlələrinin artması sırası ilə yerləşdirərək dövri qanunu belə ifadə etmişdir: Kimyəvi elementlərin və onların əmələ gətirdiyi kimyəvi birlassıriMendeleyev bəzi hallarda bu qanundan kənara çıxaraq elementlərin cədvəldə yerini onların atom kütlələrinin artması ardıcıllıına deyil, xassələrinin qanunauyğun dəyişmşü gyişmşü gyişmsin. Даха сонра 1913-cü ildə ingilis alimi Mozli müəyyən etmişdir ki, elementlərin xassələri onların atom kütlələrinin artması ilə deyil, nüvələrinin yükü ilə bilavasitə müyyən. Dövri qanunun müasir ifadəsi belədir: Kimyəvi elementlərin və onların əmələ gətirdiyi birləşmələrin forma və xassələri atom yükündən dövri surətdə asılıdır.
Bəzi kimyəvi elementlər yer qabığında geniş yayılmışdır. Elementlərin yer qabıında yayılması miqdarının tədqiqi ilə ilk dəfə amerika alimi Klark məşğul olmuşdur. О, 50-летняя qədər elementin yer qabığında yayılmasını faizlə hesablamışdır. Elementlərin yer qabığında yayılma xarakteri və qanunauyğunluqları ilə geokimya elmi məşğul olur. Йер qabığında ən geniş yayılmış элемент oksigendir və kütləcə yarısını təkcə o təşkil edir. Ümumiyyətlə yer qabığında ən çox yayılmış elementlər bunlardır: O – 49,1%, Si – 26,0%, Al – 7,5%, Fe – 4,2%, Ca – 3,2%, Na – 2,4% , K – 2,3%, Mg – 2,3%, H – 1,0%, Ti – 0,9%.Kimyəvi elementlərin бир qrupu ümumi ад ilə “Надир elementlər” adlandırılır. Надир элемент dedikd, yer qabığında miqdarı adi elementlərdən xeyli az olan və xassələrinin lazımi dərəcədə öyrənilmməsi ilə əlaqədar olaraq, tətbiqi mər,, , Nb, Te, Cs, İn, Hf, Ta, Y, Tl, La v lantanoidlər. Надир elementlərin siyahısı sabit qalmayaraq tədricən dəyişir, yəni istehsalı və tətbiqi genişləndikcə onlar adi elementlər qrupuna keçir.Elementlərin canlı orqanizmdə yayılma xarakterinin öyrənilməsi ilə biokimya məşğul olur. İndiyə kimi canlı orqanizmdə 70-dən artıq elementin mövcudluğu müəyyən edilmişdir. Orqanizmdə O, C, H və N daha çox yayılmışdır. Bu dörd elementin orqanizmd atomlarının miqdar faizi belədir: H- 63%, O- 25,5%, C- 9,5%, N- 2%.
Hidrogen-H (haş) Оксиген-О (О) Карбон-С (Se) Азот-Н (En) Flüor-F (Флюор) Йод-Дж (йод) Бром-Бр (Бром) Кремний-Si (кремний) Барий-Ба (барий) Xlor-Cl (Xlor) Манкан-Мн (манкан) Раковина-Zn (Раковина) Натриум-Na (Натриум) Калиум-К Кальсиум-Ca Макнезиум-Мг Алюминиум-Al Дамир-Фе (Феррум) Мис-Ку (Купрум) Гюмюш-Аг (аргентиум) Kükürd-S (Es) Куршун-Пб (Куршун) Civə-Hg (Civə) Кызыл-Ау (Qızıl) Фосфор-П (Пе)
Elementlər Metallar, qeyri-Metallar və təsirsiz qazlar olmaqla üç əsas təsnifə bölünür.Dövri sistemdə yerləşən elementlər yuxarıdan aşağıya doğru qrupları, soldan sağa doğru isə dövrləri təşkil edir. Cədvəldə 7 dövr, 8 qrup var. Hidrogen atomu və ya qələvi Metalla başlayıb, təsirsiz qazla qurtaran və nüvələrinin yükünün artması sırası ilə üfüqi vəziyyətdə düzülmüş elementir r ardıcıllvıyna düzülmüş elementlər ardıcıllvırına düzülmüş Birinci üç dövr kiçik dövr, qalanları böyük dövr adlanır. Kiçik dövrlər bir sıradan, böyük dövrlər isə iki sıradan ibarətdir. Dövrün nömrəsi bu dövrdə yerləşən elementlərin atomlarındakı energetik səviyyələrin sayına bərabərdir.Qruplar və dövrlər ayrılıqda müvafiq olaraq əsas və əlavə yarımqruplara, böyük və kiçik dövrlər bölünür. Hm böyük, həm kiçik dövr elementlərindən təşkil olunmuş qrupa əsas yarımqrup (A qrupu) deyilir. Yalnız böyük dövr elementlərindən təşkil olunmuş qrupa isə, əlavə yarımqrup (B qrupu) deyilir.
Mlumdur ki, 110-дан чох кимюви элемент в 80-дэн чоху металлира эйддир. I, II, III qrupların həm əsas, həm də lavə yarımqruplarının (H və B-dan başqa), həmçinin IV, V, VI, VII və VIII qrupların əlavə yarımqrup elementlərindırısı.Dövri sistemdə əsas yarımqrupda yerləşən metallar bor-astat (B-At) diaqonalından aşağıda yerləşir. Metalların atomları xarici elektronlarını asan verir. Бу sbəbdən Metallar güclü reduksiyaedicilərdir və birləşmələrində yalnız müsbət oksidləşmə dərəcəsi göstərirlər. Onların reduksiyaedicilik xassəsi metalların aktivlik sırasında qızıldan kaliumadək artır. Aktivlik sırası üzrə isə reduksiyaedicilik azalır. Metalların aktivlik sırası belədir: Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, H 2 , Cu, Hg, Ag, Au.Həmçinin Metallar müxtəlif xassələrə (физики, kimyəvi, mexaniki, texnoloji və s.) Malikdir. Metalların istilik keçirməsi onların təbiətindən asılı olaraq dəyişir. Saf Metalların istilik keçirməsi yaxşı, bunlardan alınan rintilərin istilik keçirməsi isə aşağı olur. Həmçinin Metallar Elektrik keçirmə qabiliyyətinə də malikdir. Onların elektrik keçirməsi tərkib, temperatur vəstrukturundan asılı olaraq dəyişir. Temperatur artdıqca elektrik keçiriciliyi azalır. Temperatur azaldıqda isə əksinə, elektrik keçiriciliyi artır.Metalların hər birinin özünəməxsus ərimə temperaturu var. Ən aşağı ərimə temperaturu olan metal Civə-dir. Civənin ərimə temperaturu “-38,8290 ° C” -дир. Ən yüksək ərimə temperaturu olan metal isə Volfram-dır. Onun ərimə temperaturu 3422 ° C-реж. Qızdırıldıqda metalların bərk haldan maye halına keçmə temperaturuna ərimə temperaturu deyilir. Ərimə temperaturu 700 ° C-dək olan metallara asanəriyən, 700 ° C-dən yüksək olan Metallara isə çətinəriyn Metallar deyilir.
Dövri sistemdə olan elementlərin 16-sı qeyri-Metallara aiddir.Qeyri-metallar bərk halda бир qayda olaraq ya dielektrik, ya da elektrik cərəyanını və istiliyi pis keçirən, Plastikliyi və metal parıltısı olmayan kövrək maddələrdir. Bor və silisium yarımkeçirici xassəyə malikdir. Metallarla qarşılıqlı təsirdə qeyri-Metallar Hmişə oksidləşdirici olur, yəni özlrinə elektron birləşdirir. Ən güclü oksidləşdirici element flüordur. Flüorla qarşılıqlı təsirdə bütün elementlər oksidləşir, yəni reduksiyaedici olur. Çünki, Flüor ən yüksək elektromənfiliyi olan elementdir.Elementlərin elektromənfilikləri azaldıqca qeyri-metalların oksidləşdiricilik xassələri zəifləyir. Qeyri-Metallar oksigenlə turşu oksidləri əmələ gətirir. Elementlərin dövri sistemində qeyri-Metalların baş oksidlərinin xassələrinin dəyişməsi ümumi qaydaya əsasən soldan sağa doğru turşu xassələri artır, yuxarıdan aruşıya doğ.
Təsirsiz qazlar dövri sistemdə VIII qrupun əsas yarımqrupunda yerləşir. Bu qazlar oxşar kimyəvi quruluşa malik, çox aşağı kimyəvi reaktivliyi olan, qoxusuz, rəngsiz biratomlu qazlardır.Həmçinin ərimə və qaynama temperaturu da aşağı olub, sadəcə 10 ° C ilə fərqlənir. Бу elementləriən Sayı Metallar və Qeyri-Metallara nisbətən çox azdır. Cəmi 6 təsirsiz qaz var, həmin qazlar bunlardır: He, Ne, Ar, Kr, Xe, Rn.
Elementlərin elektron formullarının yazılışı zamanı energetik yarımsəviyyələrdəki elektronların sayı müvafiq hərfi işarlərin üst indeksində göstərilir. Elektronların Sayı eyni zamanda energetik səviyyə və yarımsəviyyələrdə göstərildikdə s, p, d, f hərflərinin əvvəlində müvafiq olaraq energetik səviyyəni yazr.
Elementlərin dövrlər üzr bəzi xassələri:
- Atom nüvəsinin yükü artır
- Xarici təbəqədə elektronların Sayı Artır
- Atomun radiusu azalır
- Elektromənfilik artır
- Metallıq xassələri zəifləyir, qeyri-metallıq xassələri güclənir
- Reduksiyaedicilik xassə azalır, oksidləşdirici xassə artır
Elementlərin A qrupları üzrə bəzi xassələri:
- Atom nüvəsinin yükü artır
- Xarici təbəqədə elektronların Sayı dəyişmir
- Atomun radiusu artır
- Elektromənfilik azalır
- Metallıq xassələri güclənir, qeyri-metallıq xassələri zəifləyir
- Reduksiyaedicilik xassə artır, oksidləşdirici xassə azalır
Kimyəvi elementlərin miqrasiyası yer qabıında və onun səthində gedən geokimyəvi proseslər nəticəsində elementlərin köçürülməsi və istənilən yerdəyişmənaKimyvi elementin xassələrindən (atomunun quruluşu, ölçüsü, valentliyi və b.) Asılı olan daxili; temperatur, təzyiq və mühitin tərkibi (qələvilik və ya turşluq, oksidləşmə-bərpaedici şərait və b.) nisbətindən asılı olan xarici miqrasiya amillərinı ayrı. Geokimyəvi şəraitdən asılı olaraq elementlərin miqrasiya qabiliyyətinin dəyişməsinə baxmayaraq, çox mütəhərrik, mütəhərrik və inert elementləri ayırmaq mümkünd. Burada elementin mütəhərrikliyi onun diffuziya əmsalının maksimal konsentrasiyaya hasili kimi başa düşülür.Ən yüksək miqrasiya qabiliyyəti olan elementlər – Cl, Br, J, N, B, Ra, Na; юкшук – K, Ca, Ge, U, Fe; орта – Al, Si, Mg,; ашагы – Zr, Nb, Ta, Sb; ən aşağı – platin qrupu metallarıdır. Kimyəvi elementlərin miqrasiyası qabiliyyəti, kimyəvi elementin ана süxurdan daşınma məsafəsi, Onun konsentrasiyasının azalma qradiyenti, müxtəlif mənşəli mineralların əmələ gəlməsində iştirakı, uçuculuğu və я Onun birləşmələrinin həll ОЛМА qabiliyyəti ilə qiymətləndirilir. Kimyəvi elementlərin miqrasiyası sərbəst atomlar (инертный газлар, civə buxarları), молекулар (азот, оксиген, су buxarları və b.), садə вə комплекс ионлар (məhlul və rintilər), nəhayət, kolloid hissəciklər (kül, lil hissəcikləri və b.) şəklində, yəni maye, qaz və bərkhaldı Kimyəvi elementlərin miqrasiyası bütün geoloji proseslərdə baş verir və təbiətdə maddələrin fasiləsiz dövranının əsasını təşkil edir.
| Atom nömrəsi | Ады | İşarsi | Dövrü | Sadə elektron formulu | Aqreqat halı | атом Нисби кютлёси |
|---|---|---|---|---|---|---|
| 1 | Hidrogen | H | 1 | 1 с 1 | Qaz | 1.0079 г / моль |
| 2 | гелий | He | 1 | 1 с 2 | Qaz | 4,0026 г / моль |
| 3 | Литий | Li | 2 | 2с 1 | Bərk | 6,941 г / моль |
| 4 | Бериллий | Be | 2 | 2 с 2 | Bərk | 9.01218 г / моль |
| 5 | Бор | B | 2 | 2с 2 2п 1 | Bərk | 10,81 г / моль |
| 6 | Карбон | С | 2 | 2с 2 2п 2 | Bərk | 12,011 г / моль |
| 7 | Азот | N | 2 | 2с 2 2п 3 | Qaz | 14.0067 г / моль |
| 8 | Оксиген | O | 2 | 2с 2 2п 4 | Qaz | 15,9994 г / моль |
| 9 | Flüor | F | 2 | 2с 2 2п 5 | Qaz | 18,998403 г / моль |
| 10 | Неон | Ne | 2 | 2с 2 2п 6 | Qaz | 20.179 г / моль |
| 11 | Натрий | Na | 3 | 3с 1 | Bərk | 22,98977 г / моль |
| 12 | Макнезиум | мг | 3 | 3с 2 | Bərk | 24,305 г / моль |
| 13 | Алюминиум | Al | 3 | 3 пол. 2 3 пол. 1 | Bərk | 26.98154 г / моль |
| 14 | Кремний | Si | 3 | 3 пол. 2 3 пол. 2 | Bərk | 28,0855 г / моль |
| 15 | Фосфор | P | 3 | 3 пол. 2 3 пол. 3 | Bərk | 30,97376 г / моль |
| 16 | Kükürd | S | 3 | 3 пол. 2 3 пол. 4 | Bərk | 32.06 г / моль |
| 17 | Xlor | Cl | 3 | 3 пол. 2 3 пол. 5 | Qaz | 35,453 г / моль |
| 18 | Arqon | Ar | 3 | 3 пол. 2 3 пол. 6 | Qaz | 39,948 г / моль |
| 19 | Калиум | К | 4 | 4с 1 | Bərk | 39.0983 г / моль |
| 20 | кальций | Ca | 4 | 4с 2 | Bərk | 40,08 г / моль |
| 21 | скандий | сбн | 4 | 4с 2 3d 1 | Bərk | 44,9559 г / моль |
| 22 | Титан | Ti | 4 | 4с 2 3д 2 | Bərk | 47.9 г / моль |
| 23 | Ванадий | В | 4 | 4с 2 3д 3 | Bərk | 50,9415 г / моль |
| 24 | Xrom | Cr | 4 | 4с 2 3д 4 | Bərk | 51,996 г / моль |
| 25 | Manqan | млн. | 4 | 4с 2 3д 5 | Bərk | 54.938 г / моль |
| 26 | Dmir | Fe | 4 | 4с 2 3д 6 | Bərk | 55,847 г / моль |
| 27 | Кобальт | Co | 4 | 4с 2 3д 7 | Bərk | 58,9332 г / моль |
| 28 | Никель | Ni | 4 | 4с 2 3д 8 | Bərk | 58.7 г / моль |
| 29 | Mis | Cu | 4 | 4с 2 3д 9 | Bərk | 63,546 г / моль |
| 30 | Раковина | Zn | 4 | 4с 2 3d 10 | Bərk | 65,38 г / моль |
| 31 | Каллий | Ga | 4 | 4s 2 3d 10 4p 1 | Bərk | 69.72 г / моль |
| 32 | Германий | Ge | 4 | 4s 2 3d 10 4p 2 | Bərk | 72,59 г / моль |
| 33 | Арсен | Как | 4 | 4s 2 3d 10 4p 3 | Bərk | 74,9216 г / моль |
| 34 | Селен | Se | 4 | 4s 2 3d 10 4p 4 | Bərk | 78.96 г / моль |
| 35 | Бром | руб. | 4 | 4s 2 3d 10 4p 5 | Мэй | 79,904 г / моль |
| 36 | Криптон | Кр | 4 | 4s 2 3d 10 4p 6 | Qaz | 83,8 г / моль |
| 37 | Рубидий | руб. | 5 | 5с 1 | Bərk | 85.4678 г / моль |
| 38 | Стронций | Sr | 5 | 5с 2 | Bərk | 87,62 г / моль |
| 39 | Иттриум | Y | 5 | 5с 2 4д 1 | Bərk | 88,9059 г / моль |
| 40 | Сиркониум | Zr | 5 | 5с 2 4д 2 | Bərk | 91.22 г / моль |
| 41 | Ниобий | Nb | 5 | 5с 2 4д 3 | Bərk | 92,9064 г / моль |
| 42 | Молибден | Пн | 5 | 5с 2 4д 4 | Bərk | 95,94 г / моль |
| 43 | Texnesium | Tc | 5 | 5с 2 4д 5 | Bərk | 98 г / моль |
| 44 | Рутений | Ru | 5 | 5с 2 4д 6 | Bərk | 101.07 г / моль |
| 45 | Родиум | Rh | 5 | 5с 2 4д 7 | Bərk | 102,9055 г / моль |
| 46 | Палладий | Pd | 5 | 5с 2 4д 8 | Bərk | 106,4 г / моль |
| 47 | Gümüş | Ag | 5 | 5с 2 4д 9 | Bərk | 107.868 г / моль |
| 48 | кадмий | Cd | 5 | 5с 2 4д 10 | Bərk | 112,41 г / моль |
| 49 | Индий | В | 5 | 5s 2 4d 10 5p 1 | Bərk | 114,82 г / моль |
| 50 | Калай | Sn | 5 | 5s 2 4d 10 5p 2 | Bərk | 118.69 г / моль |
| 51 | Stibium | Сб | 5 | 5s 2 4d 10 5p 3 | Bərk | 121,75 г / моль |
| 52 | Теллур | Te | 5 | 5s 2 4d 10 5p 4 | Bərk | 127,6 г / моль |
| 53 | Йод | I | 5 | 5s 2 4d 10 5p 5 | Bərk | 126.9045 г / моль |
| 54 | Ксенон | Xe | 5 | 5s 2 4d 10 5p 6 | Bərk | 131,3 г / моль |
| 55 | Сезиум | Cs | 6 | 6с 1 | Bərk | 132,9054 г / моль |
| 56 | Барий | Ba | 6 | 6с 2 | Bərk | 137.33 г / моль |
| 57 | Лантан | La | 6 | 6s 2 4f 1 | Bərk | 138,9055 г / моль |
| 58 | Serium | Ce | 6 | 6s 2 4f 2 | Bərk | 140,12 г / моль |
| 59 | Prazeodim | пр. | 6 | 6s 2 4f 3 | Bərk | 140.9077 г / моль |
| 60 | Neodim | Nd | 6 | 6s 2 4f 4 | Bərk | 144,24 г / моль |
| 61 | Прометий | вечера | 6 | 6s 2 4f 5 | Bərk | 145 г / моль |
| 62 | Самарий | см | 6 | 6s 2 4f 6 | Bərk | 150.4 г / моль |
| 63 | Европиум | Eu | 6 | 6s 2 4f 7 | Bərk | 151,96 г / моль |
| 64 | Кадолиний | Gd | 6 | 6s 2 4f 8 | Bərk | 157,25 г / моль |
| 65 | Тербий | Тб | 6 | 6s 2 4f 9 | Bərk | 158.9254 г / моль |
| 66 | Disprozium | Dy | 6 | 6s 2 4f 10 | Bərk | 162,5 г / моль |
| 67 | Гольмий | Хо | 6 | 6s 2 4f 11 | Bərk | 164,9304 г / моль |
| 68 | Эрбий | Er | 6 | 6s 2 4f 12 | Bərk | 167.26 г / моль |
| 69 | Тулиум | Тм | 6 | 6s 2 4f 13 | Bərk | 168,9342 г / моль |
| 70 | Иттербий | Yb | 6 | 6s 2 4f 14 | Bərk | 173,04 г / моль |
| 71 | Лютеиум | Lu | 6 | 6s 2 4f 14 5d 1 | Bərk | 174.967 г / моль |
| 72 | Гафний | Hf | 6 | 6s 2 4f 14 5d 2 | Bərk | 178,49 г / моль |
| 73 | Тантал | Ta | 6 | 6s 2 4f 14 5d 3 | Bərk | 180,9479 г / моль |
| 74 | Вольфрам | Вт | 6 | 6s 2 4f 14 5d 4 | Bərk | 183.85 г / моль |
| 75 | Renium | Re | 6 | 6s 2 4f 14 5d 5 | Bərk | 186,207 г / моль |
| 76 | Осмий | Ос | 6 | 6s 2 4f 14 5d 6 | Bərk | 190,2 г / моль |
| 77 | Иридиум | Ir | 6 | 6s 2 4f 14 5d 7 | Bərk | 192.22 г / моль |
| 78 | Platin | Pt | 6 | 6s 2 4f 14 5d 8 | Bərk | 195,09 г / моль |
| 79 | Qızıl | Au | 6 | 6s 2 4f 14 5d 9 | Bərk | 196,9665 г / моль |
| 80 | Civə | Hg | 6 | 6s 2 4f 14 5d 10 | Мэй | 200.59 г / моль |
| 81 | Таллиум | Tl | 6 | 6s 1 4f 14 5d 10 6p 1 | Bərk | 204,37 г / моль |
| 82 | Qurğuşun | Pb | 6 | 6s 1 4f 14 5d 10 6p 2 | Bərk | 207,2 г / моль |
| 83 | Висмут | Bi | 6 | 6s 1 4f 14 5d 10 6p 3 | Bərk | 208.9804 г / моль |
| 84 | полоний | Po | 6 | 6s 1 4f 14 5d 10 6p 4 | Bərk | 209 г / моль |
| 85 | Astat | в | 6 | 6s 1 4f 14 5d 10 6p 5 | Bərk | 210 г / моль |
| 86 | Радон | Rn | 6 | 6s 1 4f 14 5d 10 6p 6 | Bərk | 222 г / моль |
| 87 | Франсиум | Fr | 7 | 7с 1 | Bərk | 223 г / моль |
| 88 | Радий | Ra | 7 | 7с 2 | Bərk | 223 г / моль |
| 89 | Актиниум | Ac | 7 | 7с 2 5с 1 | Bərk | 227.0278 г / моль |
| 90 | Торий | Чт | 7 | 7с 2 5с 2 | Bərk | 232,0381 г / моль |
| 91 | Протактиний | Па | 7 | 7с 2 5с 3 | Bərk | 231,0359 г / моль |
| 92 | Уран | U | 7 | 7с 2 5с 4 | Bərk | 238.029 г / моль |
| 93 | Нептуний | Np | 7 | 7с 2 5с 5 | Bərk | 237,0482 г / моль |
| 94 | Плутоний | Pu | 7 | 7с 2 5с 6 | Bərk | 244 г / моль |
| 95 | Америсиум | Am | 7 | 7с 2 5с 7 | Bərk | 243 г / моль |
| 96 | Кюриум | см | 7 | 7с 2 5с 8 | Bərk | 247 г / моль |
| 97 | Берклиум | Bk | 7 | 7с 2 5с 9 | Bərk | 247 г / моль |
| 98 | калифорний | Cf | 7 | 7с 2 5с 10 | Bərk | 251 г / моль |
| 99 | Эйнштейнум | Es | 7 | 7с 2 5с 11 | Bərk | 252 г / моль |
| 100 | Фермий | Fm | 7 | 7с 2 5с 12 | 257 г / моль | |
| 101 | Менделевий | Md | 7 | 7с 2 5с 13 | 258 г / моль | |
| 102 | Нобелий | Нет | 7 | 7с 2 5с 14 | 259 г / моль | |
| 103 | Lourensium | Lr | 7 | 7s 2 5f 14 6d 1 | 260 г / моль | |
| 104 | Резерфордий | Rf | 7 | 7s 2 5f 14 6d 2 | 261 г / моль | |
| 105 | Дубний | Дб | 7 | 7с 2 5ж 14 6д 3 | 262 г / моль | |
| 106 | Сиборгий | Sg | 7 | 7s 2 5f 14 6d 4 | 263 г / моль | |
| 107 | Бор | Bh | 7 | 7s 2 5f 14 6d 5 | 262 г / моль | |
| 108 | Калий | Hs | 7 | 7s 2 5f 14 6d 6 | 265 г / моль | |
| 109 | Мейтнерий | тонн | 7 | 7s 2 5f 14 6d 7 | 266 г / моль | |
| 110 | Darmştadtium | Ds | 7 | 7s 2 5f 14 6d 8 | 271 г / моль | |
| 111 | Rentgenium | Rg | 7 | 7s 2 5f 14 6d 9 | 272 г / моль | |
| 112 | Копернисий | Cn | 7 | 7s 2 5f 14 6d 10 | 285 г / моль | |
| 113 | Нихоний | Nh | 7 | 7s 2 5f 14 6d 10 7p 1 | 286 г / моль | |
| 114 | Флеровий | эт. | 7 | 7s 2 5f 14 6d 10 7p 2 | 289 г / моль | |
| 115 | Московий | Mc | 7 | 7s 2 5f 14 6d 10 7p 3 | 289 г / моль | |
| 116 | Ливерморий | Ур. | 7 | 7s 2 5f 14 6d 10 7p 4 | 293 г / моль | |
| 117 | Tennessin | Ц | 7 | 7s 2 5f 14 6d 10 7p 5 | 294 г / моль | |
| 118 | Oqaneson | Ог | 7 | 7s 2 5f 14 6d 10 7p 6 | 294 г / моль |
Элемент периода 1 – Простая английская Википедия, бесплатная энциклопедия
Элемент периода 1 – это элемент в первом периоде (строке) периодической таблицы.Таблица Менделеева выстроена в ряды, чтобы показать повторяющиеся свойства элементов. Когда атомный номер увеличивается, элементы приобретают другие свойства. Новый ряд начинается, когда химические свойства повторяются. Это означает, что элементы в одной группе имеют похожие свойства. В первом периоде меньше элементов, чем в любых других периодах периодической таблицы. В первом периоде всего два элемента: водород и гелий. Мы можем объяснить, почему меньше элементов в первом ряду в современных теориях атомной структуры.Это потому, что в квантовой физике этот период заполняет орбиталь 1 с. Элементы периода 1 следуют правилу дуэта, им нужно всего два электрона, чтобы завершить свою валентную оболочку. Эти элементы могут удерживать только два электрона, оба на орбитали 1s. Следовательно, период 1 может иметь только два элемента.
Поскольку в периоде 1 всего два элемента, заметных периодических тенденций нет.
Положение элементов периода 1 в периодической таблице [изменить | изменить источник]
Хотя и водород, и гелий находятся в s-блоке, они не ведут себя аналогично другим элементам s-блока.Существует спор о том, где эти два элемента должны быть помещены в периодической таблице.
Водород [изменить | изменить источник]
Положение водорода иногда выше лития, [1] иногда выше углерода, [2] иногда выше фтора, [2] [3] иногда выше как лития, так и фтора (появляется дважды), [4] или плавает над другими элементами и не принадлежит ни к какой группе [4] в периодической таблице.
Гелий [изменить | изменить источник]
Гелий почти всегда находится над неоном (который находится в p-блоке) в периодической таблице, потому что это благородный газ. [1] Однако иногда они располагаются над бериллием, потому что они имеют аналогичную электронную конфигурацию. [5]
Водород [изменить | изменить источник]
Водород (обозначение: H ) – химический элемент. Его атомный номер 1. При стандартной температуре и давлении водород не имеет цвета, запаха и вкуса.Он относится к неметаллам и легко воспламеняется. Это двухатомный газ с молекулярной формулой H 2 . Его атомная масса 1,00794 а.е.м., что делает водород самым легким элементом. [6]
Водород – самый распространенный из химических элементов. Содержание водорода составляет примерно 75%. [7] Звезды главной последовательности в основном состоят из водорода в плазменном состоянии. Однако на Земле меньше водорода. Таким образом, водород промышленно производится из углеводородов (например,г. метан). Мы используем элементарный водород локально на производственной площадке. Крупнейшие рынки почти поровну поделены между модернизацией ископаемого топлива, например гидрокрекингом, и производством аммиака, в основном для рынка удобрений. Водород можно получить из воды с помощью процесса электролиза, но этот процесс значительно дороже коммерчески, чем производство водорода из природного газа. [8]
Самый распространенный изотоп водорода природного происхождения, известный как протий, имеет единственный протон и не имеет нейтронов. [9] В ионных соединениях он может принимать либо положительный заряд, становясь катионом, состоящим из чистого протона, либо отрицательный заряд, становясь анионом, известным как гидрид. Водород может образовывать соединения с большинством элементов и присутствует в воде и большинстве органических соединений. [10] Он играет особенно важную роль в кислотно-основной химии, в которой многие реакции включают обмен протонами между растворимыми молекулами. [11] Как единственный нейтральный атом, для которого уравнение Шредингера может быть решено аналитически, изучение энергетики и спектра атома водорода сыграло ключевую роль в развитии квантовой механики. [12]
Взаимодействие водорода с различными металлами очень важно в металлургии, поскольку многие металлы могут иметь водородное охрупчивание, [13] , а также при разработке безопасных способов его хранения для использования в качестве топлива. [14] Водород хорошо растворяется во многих соединениях, состоящих из редкоземельных металлов и переходных металлов. [15] и может растворяться как в кристаллических, так и в аморфных металлах. [16] На растворимость водорода в металлах влияют локальные искажения или примеси в кристаллической решетке металла. [17]
Гелий [изменить | изменить источник]
Гелий (He) – бесцветный, без запаха, вкуса, нетоксичный, инертный одноатомный химический элемент, который возглавляет ряд благородных газов в периодической таблице, и чей атомный номер равен 2. [18] Его точки кипения и плавления равны самый низкий среди элементов и существует только в виде газа, за исключением экстремальных условий. [19]
Гелий был открыт в 1868 году французским астрономом Пьером Янссеном, который первым обнаружил это вещество как неизвестную сигнатуру желтой спектральной линии в свете солнечного затмения. [20] В 1903 году большие запасы гелия были обнаружены на месторождениях природного газа в Соединенных Штатах, которые на сегодняшний день являются крупнейшим поставщиком газа. [21] Вещество используется в криогенике, [22] – в глубоководных дыхательных системах, [23] – для охлаждения сверхпроводящих магнитов, при датировании гелием, [24] для надувания баллонов, [25 ] для обеспечения подъемной силы в дирижаблях, [26] и в качестве защитного газа для промышленного использования, например, для дуговой сварки и выращивания кремниевых пластин. [27] Вдыхание небольшого количества газа временно изменяет тембр и качество человеческого голоса. [28] Поведение двух жидких фаз жидкого гелия-4, гелия I и гелия II, важно для исследователей, изучающих квантовую механику и явление сверхтекучести, в частности, [29] , а также для тех, кто изучает эффекты, которые температуры, близкие к абсолютному нулю, влияют на материю, например, при сверхпроводимости. [30]
Гелий – второй по легкости элемент и второй по распространенности в наблюдаемой Вселенной. [31] Большая часть гелия образовалась во время Большого взрыва, но новый гелий создается в результате ядерного синтеза водорода в звездах. [32] На Земле гелий относительно редок и создается в результате естественного распада некоторых радиоактивных элементов [33] , потому что испускаемые альфа-частицы состоят из ядер гелия. Этот радиогенный гелий улавливается природным газом с концентрацией до семи процентов по объему, [34] , из которого он извлекается в промышленных масштабах с помощью процесса низкотемпературного разделения, называемого фракционной перегонкой. [35]
- ↑ 1.0 1.1 «Международный союз теоретической и прикладной химии> Периодическая таблица элементов». ИЮПАК. Проверено 1 мая 2011.
- ↑ 2,0 2,1 Кронин, Маршалл В. (август 2003 г.). «Правильное место для водорода в Периодической таблице». Журнал химического образования . 80 (8): 947–951. DOI: 10.1021 / ed080p947.
- ↑ Винсон, Грег (2008).«Водород – это галоген». HydrogenTwo.com . Проверено 14 января, 2012.
- ↑ 4,0 4,1 Каес, Херб; Аткинс, Питер (2003). «Центральное место для водорода в Периодической таблице». Международная химия . Международный союз теоретической и прикладной химии. 25 (6): 14. Проверено 19 января 2012 г.
- ↑ Зима, Марк (1993–2011). “Таблица Менделеева”. Веб-элементы . Проверено 19 января 2012 года.
- ↑ «Водород – Энергия». Управление энергетической информации. Проверено 15 июля 2008.
- ↑ Палмер, Дэвид (13 ноября 1997 г.). «Водород во Вселенной». НАСА. Проверено 5 февраля 2008.
- ↑ Персонал (2007). «Основы водорода – Производство». Флоридский центр солнечной энергии. Проверено 5 февраля 2008.
- ↑ Салливан, Уолтер (1971-03-11). «Fusion Power по-прежнему сталкивается с серьезными трудностями». Нью-Йорк Таймс .
- ↑ «водород». Британская энциклопедия . 2008.
- ↑ Eustis, S.N .; Radisic, D; Bowen, KH; Бахож, РА; Гаранчик, М; Шентер, Г.К .; Гутовски, М (2008-02-15). “Электронно-управляемая кислотно-основная химия: перенос протонов от хлористого водорода к аммиаку”. Наука . 319 (5865): 936–939. Bibcode: 2008Sci … 319..936E. DOI: 10.1126 / science.1151614. PMID 18276886.
- ↑ «Зависящее от времени уравнение Шредингера». Британская энциклопедия . 2008.
- ↑ Роджерс, Х.С. (1999). «Водородная хрупкость металлов». Наука . 159 (3819): 1057–1064. Bibcode: 1968Sci … 159.1057R. DOI: 10.1126 / science.159.3819.1057. PMID 17775040.
- ↑ Christensen, C.H .; Нёрсков, Дж. и Йоханнесен, Т. (9 июля 2005 г.). «Сделать общество независимым от ископаемого топлива – датские исследователи открывают новые технологии». Технический университет Дании. Проверено 28 марта 2008. CS1 maint: несколько имен: список авторов (ссылка)
- ↑ Takeshita, T .; Уоллес, W.E. и Крейг, Р. (1974). «Растворимость водорода в соединениях 1: 5 между иттрием или торием и никелем или кобальтом». Неорганическая химия (элементы: иттрий, торий, никель, кобальт). 13 (9): 2282–2283. DOI: 10.1021 / ic50139a050. CS1 maint: несколько имен: список авторов (ссылка)
- ↑ Kirchheim, R .; Mutschele, T. и Kieninger, W. (1988). «Водород в аморфных и нанокристаллических металлах». Материаловедение и инженерия . 99 : 457–462. DOI: 10.1016 / 0025-5416 (88)
-1. CS1 maint: несколько имен: список авторов (ссылка) - ↑ Кирхгайм Р. (1988). «Растворимость и коэффициент диффузии водорода в дефектных и аморфных металлах». Успехи материаловедения . 32 (4): 262–325. DOI: 10.1016 / 0079-6425 (88) -2.
- ↑ «Гелий: самое необходимое». WebElements. Проверено 15 июля 2008.
- ↑ «Гелий: физические свойства».WebElements. Проверено 15 июля 2008.
- ↑ «Пьер Янссен». MSN Encarta. Проверено 15 июля 2008.
- ↑ Тайсс, Лесли (18 января 2007 г.). «Куда делся весь гелий?». Бюро землеустройства. Проверено 15 июля 2008.
- ↑ Тиммерхаус, Клаус Д. (2006-10-06). Криогенная инженерия: пятьдесят лет прогресса . Springer. ISBN 0-387-33324-X .
- ↑ Копел, М. (сентябрь 1966 г.). «Гелиевый голос расшифровывается». Аудио и электроакустика . 14 (3): 122–126. DOI: 10.1109 / TAU.1966.1161862.
- ↑ «Гелиевое датирование». Британская энциклопедия . 2008.
- ↑ Брейн, Маршалл. «Как работают гелиевые шары». Как это работает. Проверено 15 июля 2008.
Элементы в теле человека
Основные элементы и их роли
Элементы – это основные составляющие живого и неживого мира.Азот (N), сера (S), кислород (O), водород (H) и углерод (C) образуют органические соединения, то есть белки, углеводы, жиры и витамины.
Прил. 1/3 из 104 известных элементов являются важными для организмов компонентами, то есть структурными элементами скелета и мягких тканей, а также факторами, регулирующими многие физиологические функции, например свертывание крови, транспорт кислорода и активация ферментов.
Группы элементов
Эти элементы можно разделить на три группы:
элементов, необходимых для жизни, т.е.е. биоэлементы
нейтральных элементов, без которых метаболические процессы могут протекать нормально
токсичных элементов с неблагоприятным воздействием на организмы
Макро- и микроэлементы
Элементы, необходимые для правильного функционирования организма, классифицируются как макро- и микроэлементы.
Уровни макроэлементов в жидкостях и тканях организма превышают 1 мкг / г влажной ткани (мкг – одна миллионная часть грамма – 10-6 г)
Макроэлементы включают:
хлор (Cl)
фосфор (P)
магний (Mg)
калий (K)
натрий (Na)
и кальций (Ca)
Уровни микроэлементов (микроэлементов) в организме ниже 1 мкг / г влажной ткани.
Микроэлементы включают:
германий (Ge)
бор (B)
хром (Cr)
олово (Sn)
цинк (Zn)
фтор (F)
йод (I)
кобальт (Co)
кремний (Si)
литий (Li)
марганец (Mn)
медь (Cu)
молибден (Mo)
никель (Ni)
селен (Se)
ванадий (V)
железо (Fe)
Токсичные элементы включают:
алюминий ( Al)
таллий (Tl)
ртуть (Hg)
кадмий (Cd)
и свинец (Pb)
Токсичность химических элементов зависит от многих факторов; наиболее важными из них являются уровни содержания элемента в организме и время воздействия.Немалую роль играет способность организма устранять вредные элементы; такие функции выполняют почки, печень и пищеварительная система. Вредное влияние токсичных элементов зависит от способности организма восстанавливать их неблагоприятные воздействия.
Токсичные элементы имеют тенденцию накапливаться в паренхиматозных органах, особенно в печени, почках и поджелудочной железе.
При длительном воздействии токсичные элементы могут накапливаться и в других тканях, например.г. свинец и алюминий в костях, свинец, ртуть и алюминий в тканях мозга, и кадмий в корнях волос.
Определение элементов в теле
В результате развития науки и техники методы определения элементов становятся все более точными и точными. Атомно-абсорбционная спектрометрия (AAS), атомно-эмиссионная спектрометрия с индуктивно связанной плазмой (ICP-AES) или нейтронно-активационный анализ (NAA) могут обеспечить высокочувствительные результаты испытаний.
Современное аналитическое оборудование позволяет анализировать уровни элементов только на одном образце.Это позволяет измерить многие значения уровней элементов за короткое время на небольшом материале, что в случае биологических тестов имеет большое значение.
Лаборатория Биомол-Мед использует ИСП для определения элементов.
Физиологические жизненные процессы зависят не только от состава и концентрации отдельных элементов, но и от их пропорций в организме. Для отдельных участков тела существует точно определенный ионный баланс, который поддерживается стабильным. На основании пропорций между определенными элементами можно оценить метаболическую активность, а также правильность физиологических процессов.Между микроэлементами существуют синергетические и антагонистические отношения, которые напрямую влияют на обмен веществ в организме.
Во многих случаях поддержание правильных соотношений между отдельными элементами более важно, чем их правильная концентрация.
комбинаций элементалей – Диаграмма реакций | Genshin Impact
Ознакомьтесь с таблицей комбинаций элементалей для Genshin Impact. Изучите все элементарные реакции, синергию, реакции, комбинации, какие реакции использовать, лучшие комбинации и многое другое!
Проверьте все доступные персонажи в Genshin здесьКак вызвать элементальное комбо (реакция)
Нанести 2 стихийных статуса
Элементальная реакция происходит, когда противник поражен двумя или более стихийными статусами одновременно.В зависимости от реакции враги получат дополнительный урон, их защита будет понижена и многое другое. Эффективное использование этих реакций во время игры в Genshin значительно улучшит ваш опыт, поэтому мы рекомендуем внимательно их изучить!
Меняйте местами персонажей и используйте умения стихий
Самый простой способ вызвать реакцию – это переключаться между своими персонажами и использовать их умения стихий. Например, если вы примените статус Крио к врагу с помощью Каеи, переключитесь на Сянлин и примените атаку поджигателя, вы вызовете эффект расплавления, увеличивая нанесенный урон!
Вы тоже можете использовать природные элементы
Можно также использовать элементы, которые существуют в естественном мире, чтобы вызвать реакцию! Например, враги, которые находятся на воде, будут иметь статус воды, поэтому, если вы используете навык Электро, вы можете убить их электрическим током! Использование элементов, которые вы найдете в природе, может расширить ваши боевые горизонты!
Elemental Combo Chart и эффекты
Источник: этот пост на официальных форумах.
| Реакция | Элемент | Эффект |
|---|---|---|
| Vaporize | Pyro + Hydro | Увеличивает наносимый урон. |
| Перегружен | Pyro + Electro | Взрыв, нанося урон Pyro в области. Также может легко разрушить твердый объект. |
| Melt | Pyro + Cryo | Увеличивает наносимый урон. |
| Electro-Charged | Hydro + Electro | Наносит прерывистые электрические повреждения.Также разряжает электричество на цели, имеющие водный статус. |
| Frozen | Hydro + Cryo | Замораживает противников, делая их неспособными действовать. |
| Superconduct | Electro + Cryo | Наносит крио-урон в области, снижая физическое сопротивление врага. |
| Горящий | Dendro + Pyro | Периодически наносит урон Pyro. |
| Spread | Pyro Hydro Electro Cryo + Anemo | Наносит стихийный урон и распространяет стихийные эффекты. |
| Crystallize | Pyro Hydro Electro Cryo + Geo | Создает элементарный щит, поглощающий фиксированное количество урона. |
Рекомендуемые комбинации элементов (реакции)
Распространение (поджигание + анемо) очень мощное раннее
Распространение происходит, когда вы добавляете элемент анемо (ветер) к поджиганию, гидро-, электро или крио. Он наносит огромный урон и чрезвычайно полезен в начале игры, так как есть много врагов, слабых для стрельбы! Комбинация Pyro + Anemo чрезвычайно эффективна и настоятельно рекомендуется.
Сверхпроводимость (Электро + Крио) снижает защиту
Комбинация Электро и Крио – еще одна мощная комбинация, поскольку она не только нанесет большой крио-урон, но и снизит физическую защиту врага. Если у вас есть персонаж с мощными физическими атаками, используйте это вместе с ним!
Кристаллизация для мощного защитного усиления
Если вы добавите элемент Geo к Pyro, Hydro, Electro или Cryo, вы получите щит, который блокирует определенное количество урона.Если противник поражен несколькими статусами стихий, вы получите щит за каждого, кто попадает в цель, что делает его довольно мощным.
Это особенно полезно против больших боссов, которых нелегко сбить с ног, так как это позволяет вам немного отдохнуть от их тяжелых атак.
Детали эффекта реакции элементаля
Испарение
| Элементы | Pyro + Hydro |
|---|---|
| Эффект | Увеличивает наносимый урон. |
Комбинация Pyro и hydro вызовет эффект Vaporize. Сам эффект не наносит урона, но вместо этого он увеличивает наносимый вами урон!
Перегружено
| Elements | Pyro + Electro |
|---|---|
| Effect | Взрыв, нанося урон Pyro в области. Также может легко разрушить твердый объект. |
Используя Pyro и Electro вместе, вы можете перегрузить цель, вызывая мощный AoE-взрыв.Этот взрыв может также разрушить твердые материалы и предметы. Это действительно полезно против врагов, которые используют тяжелую броню для защиты!
Melt
| Elements | Pyro + Cryo |
|---|---|
| Effect | Увеличивает наносимый урон. |
Комбинация Pyro и Cryo вызовет эффект плавления. Как и в случае с испарением, это не наносит урон само по себе, но оно усиливает ваш последующий урон!
Electro-Charged
| Elements | Hydro + Electro |
|---|---|
| Effect | Наносит периодические электрические повреждения.Также разряжает электричество на цели, имеющие водный статус. |
Совместное использование элементов Hydro и Electro приведет к статусу Electro-Charged. Это будет наносить непрерывный урон противнику. Кроме того, если поблизости есть враги, у которых есть дебафф Wet, к ним будет разряжаться электричество, и они тоже получат урон.
Frozen
| Elements | Hydro + Cryo |
|---|---|
| Effect | Замораживает противников, делая их неспособными действовать. |
Объединение элементов Hydro и Cryo вместе заморозит врагов на месте, делая их неспособными что-либо делать. Вы сможете свободно атаковать их, что делает это полезным для сражений на воде. Вы также можете использовать крио-магию, чтобы проложить путь по водоемам!
Superconduct
| Elements | Electro + Cryo |
|---|---|
| Effect | Наносит крио-урон в области, снижая физическое сопротивление врага. |
Комбинация крио и электро вызывает эффект сверхпроводимости, нанося крио урон в области. Это также значительно снизит физическую защиту противников.
Горение
| Элементы | Dendro + Pyro |
|---|---|
| Effect | Наносит периодический урон Pyro. |
Дендро (Природа) и Поджигатель объединяются, чтобы произвести эффект Горения, который периодически наносит урон цели. Кроме того, если противник использует деревянный щит, он также сожжет его и оставит врага без защиты.
Распространение
Распространение может быть вызвано использованием анемо для эффектов состояния поджигателя, гидро, электро или крио.


