Нормы расхода электродов при сварке
Расход электродов при сварке влияет и на продолжительность, и на производительность рабочего процесса. Ведь отработавший свое штучный электрод нужно заменить новым источником присадочного материала. Поэтому опытные сварщики держат под руками достаточное количество электродов.
Причем электроды еще нужно приготовить, прокалив в сушилке не менее полутора-двух часов. И в этой статье мы расскажем вам, как определяется это «достаточное количество».
Вводные параметры
В качестве вводных данных при расчете количества расходуемых электродов фигурируют следующие параметры:
· Масса наплавки – вес металла, заполняющего стыковочный шов. Точный расчет наплавки приводится в технологической карте процесса сварки. А согласно грубым расчетам масса наплавки равна 1-1,5 процентам от общего веса металлоконструкции.
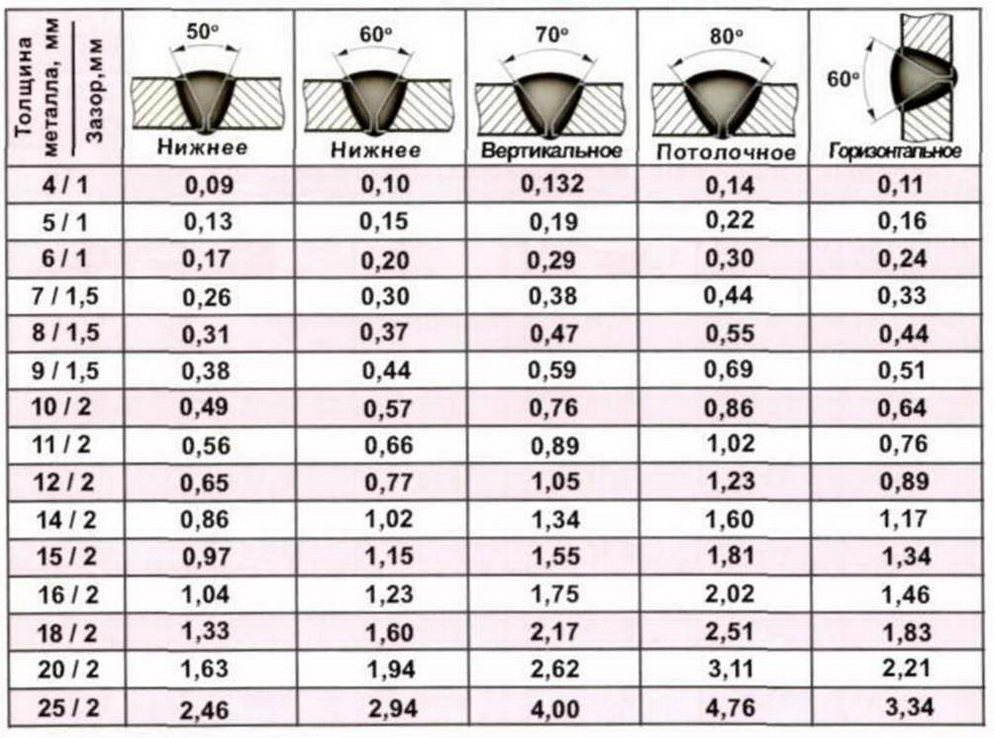
· Габариты сварочного шва, а точнее его длина. Ее измеряют с помощью рулетки по длине стыка. Причем результаты измерения нужно умножить на количество швов в разделе. Ведь глубокие стыки заваривают двумя-тремя швами, которые накладываются последовательно или параллельно.
Причем результаты измерения нужно умножить на количество швов в разделе. Ведь глубокие стыки заваривают двумя-тремя швами, которые накладываются последовательно или параллельно.
· Нормы расхода на один погонный метр сварочного шва. Этот параметр определяется, исходя из множества критериев. Поэтому подробную методику определения норм мы приведем ниже по тексту.
Норма расхода электродов на сварку
Норма расхода – это масса наплавки в сварочном шве длиной в один метр.
Причем существуют следующие нормы расхода:
· Операционная, которая вычисляется в зависимости от типа сварочной операции.
· Детальная, которую вычисляют по массе наплавки в процессе сварки одной детали.
· Узловая, которую вычисляют по массе наплавки в процессе сварки конкретного узла металлоконструкции.
То есть, на конкретную норму расхода влияет и технология сварки, и форма сварочного шва и общее количество швов в металлоконструкции, и многое другое. Поэтому конкретные нормы расхода нужно определять либо по теоретическим выкладкам (формулам), либо по практическим наблюдениям.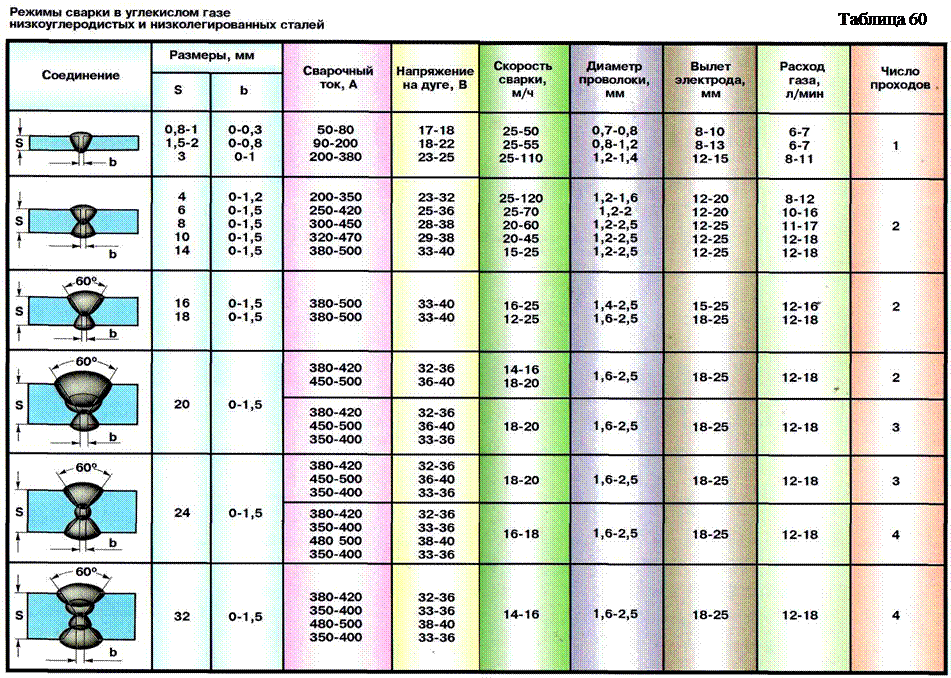
Расход электродов при сварке труб – теоретические расчеты
Теория процесса расчета расхода электродов заключается в вычислении нормы расхода на один метр шва и делении этой величины на вес одного электрода. В итоге мы получаем норму расхода не в килограммах наплавки, а в поштучном исчислении количества электродов. После этого поштучная норма умножается на метраж, и результат округляется до целого значения (в большую сторону).
Норма расхода в килограммах определяется по массе наплавленного металла: объем раздела длинной в один метр умножается на плотность металла. Причем для упрощения расчета объем раздела можно вычислить, как объем цилиндра с диаметром, равным большей (внешней) стороне стыка.
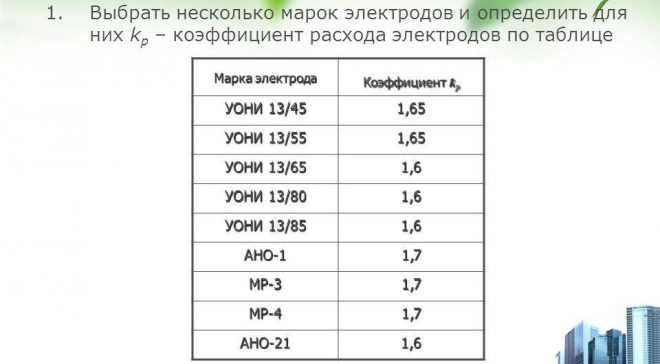
Полученное значение увеличивают в 1,4-1,8 раза (поправка на огарки от электродов). Причем каждая из шести групп электродов имеет свое значение упомянутого коэффициента. Поэтому конкретные цифры стоит поискать в справочнике.
Формула подсчетов расхода выглядит следующим образом:
Н=Мк,
Где Н – это нормированный расход на метровый сварочный шов, М — это масса наплавленного металла в шве, к – это коэффициент поправки на огарки.
Сварка электродом — расход на практике
Если вы не сторонник сложных вычислений, то наилучшим способом определения расхода электрода для вас будет следующая методика:
· Вы берете две детали из нужного вам материала и один электрод нужного вам типа.
· Детали размещаются на сварочном столе в определенном положении, которое будет характерно для реальной сварочной операции. То есть вы имитируете условия формирования нижнего, вертикального или полочного шва.
· После этого вам остается только заварить стык между деталями, используя для этих целей один электрод.
· Далее, вы промеряете длину сварочного шва, который получили с помощью одного электрода.
Полученное значение – длину шва из одного электрода – сопоставляют с общей длиной сварочных швов, выходя на рекомендуемое количество прутков с присадочным материалом.
Указанный способ работает ничуть не хуже, чем табличный расчет. А если повторить этот эксперимент три-четыре раза, то среднее значение окажется намного точнее. Но в любом случае отклонения практического способа от теоретического вычисления расхода – малозначительны.
Но в любом случае отклонения практического способа от теоретического вычисления расхода – малозначительны.
Обоснование стоимости сварных соединений от 10 катета и выше
При составлении коммерческих смет, если заказчик пытается экономить за счет удаления машин и механизмов, ресурсной части расценок, возможен вариант доказательства использования материала по фактически выполненным работам.
Рассмотрим пример из практики – нетиповой проект реконструируемого объекта: доказательство расхода электродов при применении монтажного сборника № 9 «Строительные металлические конструкции». Для этого используем ВСН 416-81 «Общие производственные нормы расхода материалов в строительстве».
Согласно сборнику ВСН 416-81 Сварочные работы, п. 10 «Производственные нормы расхода материала» электроды делятся на 4 группы с указанием коэффициента расхода. Электроды УОНИ-13/55 (электроды, применяемые для сварки металлоконструкций на стройке) относятся к группе электродов IV. Способ сварочных соединений в примере – тавровые без скоса кромок односторонние Т1.
Способ сварочных соединений в примере – тавровые без скоса кромок односторонние Т1.
В параграфе 13 «Соединения тавровые без скоса кромок односторонние Т1» таблица 013 «Нормы на 1 м шва» представлены нормы расхода электродов по катетам шва и категориям электродов (в данном случае IV группа).
Необходимо произвести монтаж стоек ограждений под конвейер. Доказательная база использования ресурсов (расход электродов при катете шва 12 мм) такова.
Пример 1. При монтаже стойки применялся катет шва 12 мм за 4 прохода длиной 8,2 м. Общий тоннаж 144 кг.
Согласно нормативу ВСН 416-81 таблицы 013, при катете шва 12 мм норма на 1 метр шва электродов УОНИ-13/55 равна 1,122 кг.
Длину катета 8,2 метра нужно умножить на норму расхода 1,122 кг = 9,2004 кг – норма расхода электродов УОНИ-13/55.
При монтаже стойки в смете заказчика использована расценка ФЕР09-03-030-01, где расход электродов на 0,144 т составляет 0,0006 т=0,6 кг, что не соответствует расходу электродов при катете шва 12 мм.
При применении расценки в смете ФЕР46-01-013-01 расход электродов при длине сварного шва 8,2 м составляет 7,8 кг.
При применении расценок на монтаж ФЕР09-03-030-01 и усиление ФЕР46-01-013-01 расход электродов в совокупности 0,6 + 7,8=8,4 кг, что более подходит к реальному расходу электродов.
Пример 2. Катет шва 12 мм за 4 прохода длиной 1,6 метра. Аналогичный расчет: при монтаже 0,024 т в расценке ФЕР09-03-030-01 расход электродов 0,0001 т = 0,1 кг. При усилении в КМ1-1 в расценке ФЕР46-01-013-01 расход электродов на 1,6 метра 0,0016 т = 1,6 кг.
При расчете по нормативу ВСН 416-81 расход электрода 1,6 * 1,122 = 1,7952 кг.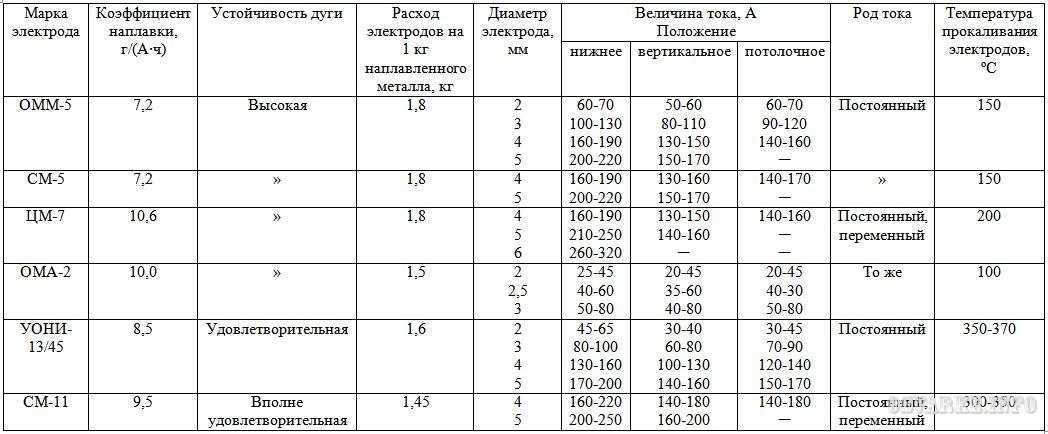
Пример 3. Сварка сплошным швом с катетом 12 мм за 2 прохода длинной 41 метр. Расход электродов 0,0017 т на вес 0,544 т. При расчетах по ВСН 416-81 на 12 катет при длине 41 метр расход электродов 46 кг. При применяемой расценке ФЕР09-03-002-13 на монтаж пластин для стыковки балок и расценке на усиление ФЕР46-01-013-01 расход электродов 1,7 кг + 41 кг = 42,7.
Данный вариант из практики подходит при финансировании частным инвестором (коммерческий подряд).
Таким образом, при составлении коммерческих смет, где заказчик удаляет из расценок ресурсы, не учитывает технологию производства работ, можно доказывать расчет неучтенных ресурсов, которые несет подрядчик.
Измерение потребления кислорода митохондриями с помощью электрода Кларка
- Список журналов
- Рукописи авторов HHS
- PMC8711122
Методы Мол Биол.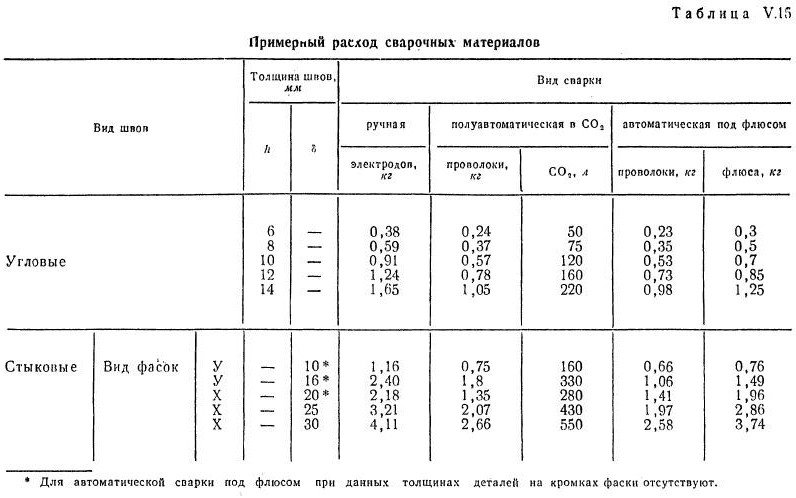 Авторская рукопись; доступно в PMC 2021 27 декабря.
Авторская рукопись; доступно в PMC 2021 27 декабря.
Опубликовано в окончательной редакции как:
Methods Mol Biol. 2012 г.; 837: 63–72.
DOI: 10.1007/978-1-61779-504-6_5
PMCID: PMC8711122
NIHMSID: NIHMS1762806
PMID: 22215541
. для запуска энергозатратных реакций в эукариотических организмах. Измерение скорости потребления кислорода изолированными митохондриями in vitro является полезным и ценным методом исследования и оценки митохондриальной дисфункции и заболеваний, поскольку АДФ-зависимое потребление кислорода напрямую отражает парное дыхание или окислительное фосфорилирование (OXPHOS). В этой главе описывается традиционный метод митохондриальной полярографии с использованием электрода Кларка для измерения парного дыхания в свежевыделенных митохондриях как из тканей млекопитающих, так и из тканей млекопитающих.0013 Drosophila melanogaster
Ключевые слова: Митохондрии, Полярография, Парное дыхание, Скорость потребления кислорода, Окислительное фосфорилирование
Анализ потребления кислорода изолированными митохондриями с помощью полярографии является хорошо зарекомендовавшей себя технологией, которая используется уже более 50 лет (1). Этот подход основан на фундаментальном биохимическом принципе окислительного фосфорилирования (OXPHOS), заключающемся в переносе электронов по дыхательной цепи (заключительной стадией является потребление молекулярного кислорода путем восстановления до H 2 O цитохром c оксидазой) функционально связан с фосфорилированием АДФ за счет генерации и использования протонного электрохимического градиента через внутреннюю мембрану митохондрий (2). Возможность измерения потребления кислорода интактными митохондриями, выделенными из тканей или клеток человека или из тканей животных, является важным инструментом для функционального анализа OXPHOS в контексте митохондриальной дисфункции и заболеваний (2-4). Митохондриальная полярография включает использование электрода Кларка для измерения содержания растворимого кислорода в замкнутой системе.
Этот подход основан на фундаментальном биохимическом принципе окислительного фосфорилирования (OXPHOS), заключающемся в переносе электронов по дыхательной цепи (заключительной стадией является потребление молекулярного кислорода путем восстановления до H 2 O цитохром c оксидазой) функционально связан с фосфорилированием АДФ за счет генерации и использования протонного электрохимического градиента через внутреннюю мембрану митохондрий (2). Возможность измерения потребления кислорода интактными митохондриями, выделенными из тканей или клеток человека или из тканей животных, является важным инструментом для функционального анализа OXPHOS в контексте митохондриальной дисфункции и заболеваний (2-4). Митохондриальная полярография включает использование электрода Кларка для измерения содержания растворимого кислорода в замкнутой системе.
В присутствии окисляемых субстратов в систему вводят свежевыделенные митохондрии и измеряют потребление кислорода в присутствии экзогенно добавленных АДФ и/или ингибиторов.
Приготовьте все растворы, используя сверхчистую воду (приготовленную путем очистки деионизированной воды обратным осмосом до достижения удельного сопротивления 18 МОм·см при 25°C). Подготовьте и храните все реагенты при комнатной температуре (если не указано иное). При утилизации отходов необходимо соблюдать все правила утилизации отходов.
2.1. Исходные растворы (см. примечание 1)
1 М маннит: растворить 91 г маннита в 300 мл сверхчистой воды и затем добавить воду до конечного объема 0,5 л (см. примечание 2).
0,5 М сахарозы: Растворите 85,6 г сахарозы в 300 мл сверхчистой воды и затем добавьте воды до конечного объема 0,5 л. : Растворите 59,6 г HEPES в 300 мл сверхчистой воды и доведите рН до 7,2 с помощью 10 М КОН. Добавьте воду до конечного объема 0,5 л.
0,4 М ЭГТА (этиленгликольтетрауксусная кислота): добавьте 15,2 г ЭГТА в 90 мл сверхчистой воды.
 Сначала добавьте 3,5 г гранул NaOH, а затем осторожно титруйте pH до 7,5, добавляя отдельные гранулы NaOH по мере необходимости (см. примечание 3). Добавьте воду до конечного объема 100 мл.
Сначала добавьте 3,5 г гранул NaOH, а затем осторожно титруйте pH до 7,5, добавляя отдельные гранулы NaOH по мере необходимости (см. примечание 3). Добавьте воду до конечного объема 100 мл.1 М Трис-HCl: Растворите 60,6 г основания Трис в 400 мл сверхчистой воды. Осторожно отрегулируйте pH до 7,2, используя концентрированную HCl. Добавьте воду до конечного объема 0,5 л.
1 M KCl: Растворите 37,3 г KCl в 400 мл ультрачистой воды. Добавьте воду до конечного объема 0,5 л.
1 M KH 2 PO 4 : Растворить 68 г KH 2 PO 4 в 400 мл ультрачистой воды. Доведите pH до 7,2 с помощью концентрированной HCl. Добавьте воды до конечного объема 0,5 л.
2.2. Оборудование и буфер для выделения митохондрий
Буфер для выделения митохондрий: 5 мМ HEPES (pH 7,2), 210 мМ маннит, 70 мМ сахароза, 1 мМ EGTA и 0,5% (масса/объем) BSA. Для приготовления 1 л соедините 210 мл 1 М маннита, 140 мл 0,5 М сахарозы, 10 мл 0,5 М HEPES, 2,5 мл 0,4 М ЭГТА и 5 г бычьего сывороточного альбумина (БСА, фракция V, не содержит жирных кислот).
 ). Добавьте ультрачистую воду до конечного объема 1 л. Фильтруйте и стерилизуйте буфер и храните при 4°C.
). Добавьте ультрачистую воду до конечного объема 1 л. Фильтруйте и стерилизуйте буфер и храните при 4°C.Стеклянный гомогенизатор Dounce (Kontes): Полезно иметь как минимум два размера гомогенизаторов Dounce (с соответствующими «плотными» и «свободными» стеклянными пестиками) для облегчения гомогенизации различного количества тканей. По нашему опыту, размеры 15, 7 и 2 мл обеспечивают достаточную емкость и гибкость для гомогенизации тканей млекопитающих, тканей мух и клеточных гранул.
Центрифуга с охлаждением и микроцентрифуга (настроенная на 4°C), центрифужные пробирки Oak Ridge на 50 мл и микроцентрифужные пробирки на 1,5 мл.
2.3. Реагенты для полярографии
Буфер для дыхания: 225 мМ маннит, 75 мМ сахароза, 10 мМ KCl, 10 мМ Трис-HCl (pH 7,2) и 5 мМ KH 2 PO 4 . Чтобы получить 0,5 л, соедините 112,5 мл 1 М маннита, 75 мл 0,5 М сахарозы, 5 мл 1 М KCl, 5 мл 1 М трис-HCl (pH 7,2) и 2,5 мл 1 М KH 2 .
 PO 4 (pH 7,2). Добавить ультрачистую воду до конечного объема 0,5 л. Профильтровать, стерилизовать, разлить на аликвоты по 50 мл и хранить при -20°C.
PO 4 (pH 7,2). Добавить ультрачистую воду до конечного объема 0,5 л. Профильтровать, стерилизовать, разлить на аликвоты по 50 мл и хранить при -20°C.Исходные растворы малата, глутамата, пирувата и сукцината (0,65 М): приготовьте 20 мл 0,65 М исходных растворов каждого, доведя рН до 7,2 с помощью 10 М КОН. Разлить на аликвоты по 150 мкл и хранить при температуре -80°C. Эти исходные растворы обычно стабильны в течение нескольких лет при хранении при температуре -80°C. Все они используются в рабочей концентрации 5 мМ (см. примечание 4).
АДФ (25 мМ): Приготовьте 20 мл исходного раствора 25 мМ АДФ (214 мг в 20 мл общего объема) и используйте разбавленный (1 М) КОН для доведения рН до 6,0–6,8, чтобы обеспечить длительную стабильность срока. Немедленно разделите на аликвоты по 150 мкл и храните при температуре -80°C (см. примечание 5). Обычно для стимуляции дыхания используют 125 нмоль АДФ на 200–300 мкг изолированных митохондрий.
6,5 мМ ДНФ (2,4-динитрофенол): Приготовьте 20 мл исходного раствора 6,5 мМ, поместив 24 мг ДНФ в 4 мл 1 М NaOH в полипропиленовой пробирке на 15 мл и полностью растворив нагреванием при 50°С.
 С в течение 20 мин. Отрегулируйте pH до нейтрального с помощью 1 M HCl, добавив ~ 3 мл. Проверяйте рН до достижения 7,2 (раствор ДНФ должен иметь полупрозрачный желтый цвет). Добавьте сверхчистую воду, чтобы получить окончательный объем 20 мл, разлейте на аликвоты по 150 мкл и храните при -80°C (см. примечание 6).
С в течение 20 мин. Отрегулируйте pH до нейтрального с помощью 1 M HCl, добавив ~ 3 мл. Проверяйте рН до достижения 7,2 (раствор ДНФ должен иметь полупрозрачный желтый цвет). Добавьте сверхчистую воду, чтобы получить окончательный объем 20 мл, разлейте на аликвоты по 150 мкл и храните при -80°C (см. примечание 6).
2.4. Оборудование для полярографии
Микрокислородный зонд Кларка (YSI LifeSciences, Yellow Springs, OH).
Микрокислородная камера с водяной рубашкой (0,65 мл) с магнитной мешалкой (YSI LifeSciences, Yellow Springs, OH) и стандартной водяной баней с циркуляцией.
Кислородный монитор (модель YSI 5300A, YSI LifeSciences, Yellow Springs, OH).
Электронный самописец PowerLab 4/30 плюс программное обеспечение для анализа LabChart (ADInstruments, Колорадо-Спрингс, Колорадо).
3.1. Выделение митохондрий из ткани
Препарируйте или соберите нужную ткань (см.
 примечание 7) и дважды промойте 2–5 мл охлажденного льдом PBS или буфера для выделения, чтобы удалить любой связанный мусор (см. примечание 8).
примечание 7) и дважды промойте 2–5 мл охлажденного льдом PBS или буфера для выделения, чтобы удалить любой связанный мусор (см. примечание 8).Измельчите ткань лезвием бритвы и поместите в предварительно охлажденный гомогенизатор Dounce. Добавьте до 10 мл буфера для выделения, затем гомогенизируйте, используя восемь-десять ручных проходов стеклянным пестиком (см. примечания 9 и 10).
Перенесите гомогенат в центрифужную пробирку на 50 мл (см. примечание 11).
Центрифуга при 1500 × g в течение 5 мин при 4°C.
Осторожно перелейте надосадочную жидкость в свежую пробирку, избегая переноса свободного материала из осадка, и отцентрифугируйте при 8000 × г в течение 15 мин при 4°C.
Удалите супернатант и промойте митохондриальную фракцию, суспендировав осадок в 25 мл буфера для выделения и повторив центрифугирование при 8000 × г в течение 15 мин при 4°С.
Суспензируйте промытый митохондриальный осадок в буфере для выделения (используйте 0,1 мл на грамм используемой ткани) и держите на льду при подготовке полярографической камеры (см.
 Подзаголовок 3.2 ниже). Определите концентрацию белка, используя любой из стандартных колориметрических методов, таких как анализ Брэдфорда (5) (см. примечание 12).
Подзаголовок 3.2 ниже). Определите концентрацию белка, используя любой из стандартных колориметрических методов, таких как анализ Брэдфорда (5) (см. примечание 12).
3.2. Подготовка оборудования для полярографии
Разберите и очистите микрокамеру, состоящую из пластиковой камеры объемом 650 мкл с магнитной мешалкой, входного и выходного портов для промывки камеры, порта для кислородного электрода, порта для введения образцов/ подложки в камеру и вращающийся запорный кран с прозрачным смотровым окном, прикрепленный к камере с помощью силиконовой смазки. Чтобы облегчить очистку от старой смазки, используйте ватный тампон, смоченный органическим растворителем, таким как ксилол или метанол. После очистки снова соберите камерный аппарат, включите циркуляционную водяную баню, чтобы нагреть и поддерживать температуру в камере с водяной рубашкой при 30°C, а также включите кислородный монитор, электронный самописец и компьютер.
Разморозьте аликвоту 50 мл дыхательного буфера и убедитесь, что она насыщается комнатным воздухом, встряхивая колбу на водяной бане при 30°C в течение не менее 30 мин.

Подготовьте кислородный зонд, покрыв кончик зонда каплей свежего раствора KCl (примерно наполовину насыщенного путем растворения 5,25 г KCl в 16 мл сверхчистой воды), затем накройте полиэтиленовую мембрану и закрепите уплотнительным кольцом, как указано в инструкции производителя (см. примечание 13).
Откалибруйте кислородный монитор и электронный регистратор данных, сначала сняв разъем датчика с монитора и установив нулевую точку для регистратора данных. Вставьте штекер зонда обратно в монитор, промойте чистую камеру несколькими миллилитрами уравновешенного буфера, затем заполните камеру буфером, закройте кран камеры и включите магнитную мешалку (см. примечание 14). Как только сигнал стабилизируется, откалибруйте кислородный монитор для 100% насыщения воздухом и установите максимальную точку на диаграммном самописце для правильного преобразования единиц измерения содержания кислорода (см. примечание 15).
3.3. Проведение митохондриальной полярографии
На льду оттаивают аликвоты субстратов (глутамат, малат, пируват и сукцинат), АДФ и ДНП.

Заполните камеру свежим дыхательным буфером и, как только стабилизируется исходный уровень (обычно через 1–3 мин), добавьте 5 мкл каждого из желаемых субстратов (см. примечание 4) и наблюдайте за записью в течение 2–5 мин пока исходный уровень не стабилизируется.
Добавьте в камеру 200–500 мкг свежевыделенных митохондрий (см. примечание 16). Должна быть низкая скорость потребления кислорода (состояние IV или АДФ-лимитирующая скорость), в первую очередь вызванная исходной эндогенной утечкой протонов через внутреннюю мембрану изолированных митохондрий (4).
Добавьте 5 мкл (125 нмоль) АДФ. Добавление АДФ должно стимулировать высокую скорость потребления кислорода (состояние III или скорость стимуляции АДФ), которая вернется к скорости исходного состояния IV, как только экзогенно добавленная АДФ будет поглощена OXPHOS (см. Примечание 17). Для хорошо сопряженных митохондрий скорость состояния III должна быть по крайней мере в три раза выше, чем скорость состояния IV (-) (см.
 примечание 18). После возобновления дыхания в состоянии IV в течение 1–2 минут (достаточно времени для точного измерения частоты дыхания) можно сделать второе добавление АДФ, что должно привести к такой же частоте дыхания в состоянии III и переходу обратно в состояние IV (пусть работает в течение 1 –2 мин).
примечание 18). После возобновления дыхания в состоянии IV в течение 1–2 минут (достаточно времени для точного измерения частоты дыхания) можно сделать второе добавление АДФ, что должно привести к такой же частоте дыхания в состоянии III и переходу обратно в состояние IV (пусть работает в течение 1 –2 мин).Открыть в отдельном окне
Идеализированный след полярографического сеанса. В момент времени «0» субстрат (5 мкМ глутамата + малата или сукцината) добавляют в камеру, полную насыщенного воздухом буфера для дыхания, и наблюдают стабильный базовый уровень. ( a ) Изолированные митохондрии добавляют до конечной концентрации 0,3 мг/мл. ( b ) Добавляется 125 нмоль АДФ, стимулируя скорость состояния III, которое переходит в состояние IV, как только экзогенный АДФ поглощается OXPHOS. ( c ) DNP (50 мкМ) добавляют для стимуляции максимальной скорости разобщения (UC).
Открыть в отдельном окне
Типичный полярографический след митохондрий личинок Drosophila с глутаматом + малатом в качестве субстрата.
 Показан полярографический эксперимент с использованием митохондрий, выделенных из личинок третьего возраста Drosophila melanogaster дикого типа . ( a ) Добавляют глутамат + малат (по 5 мкМ каждого). ( b ) Добавлены митохондрии личинок мух (0,3 мг/мл). ( c ) Добавляют 125 нмоль АДФ. ( d ) Добавляют ДНФ (50 мкМ).
Показан полярографический эксперимент с использованием митохондрий, выделенных из личинок третьего возраста Drosophila melanogaster дикого типа . ( a ) Добавляют глутамат + малат (по 5 мкМ каждого). ( b ) Добавлены митохондрии личинок мух (0,3 мг/мл). ( c ) Добавляют 125 нмоль АДФ. ( d ) Добавляют ДНФ (50 мкМ).Добавьте ДНФ до конечной концентрации 50 мкМ (см. примечание 6) и измерьте частоту несвязанного дыхания в течение не менее 2–3 минут, чтобы завершить анализ (см. примечание 19).
3.4. Анализ данных
Типичные параметры, определяемые с помощью митохондриальной полярографии, включают скорость в состоянии III, скорость в состоянии IV, RCR, несвязанную скорость и отношение АДФ/О (). RCR (коэффициент контроля дыхания или скорость состояния III/скорость состояния IV) является хорошим индикатором целостности внутренней мембраны изолированных митохондрий и чувствителен к выявлению дефектов OXPHOS, в то время как отношение АДФ/О является прямым отражением фосфорилирования.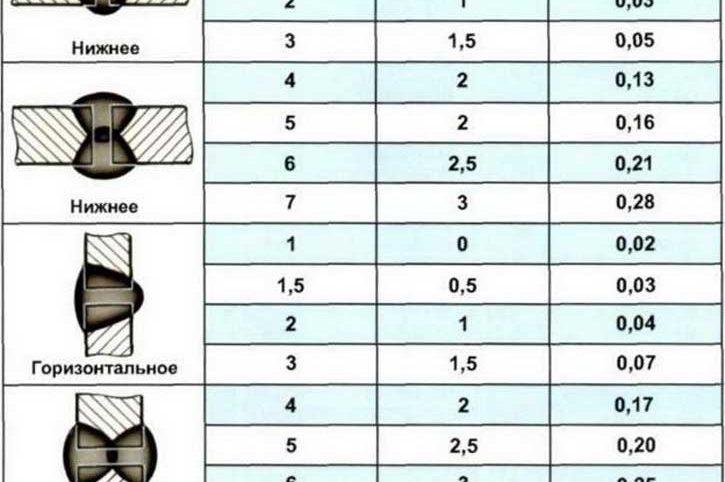
С помощью аналитического программного обеспечения LabChart, прилагаемого к цифровому самописцу, скорости потребления кислорода (т. е. состояние III, состояние IV и UC) измеряются по линейным фазам и нормализуются по содержанию белка (скорости выражены в нг атомарного кислорода). /мин/мг митохондриального белка).
Для соотношения АДФ/О количество АДФ, потребляемое в состоянии III (125 нмоль), делится на количество кислорода, потребляемого в состоянии III (нг атомарного кислорода).
Открыть в отдельном окне
Типичная полярографическая кривая митохондрий сердца крысы с сукцинатом в качестве субстрата.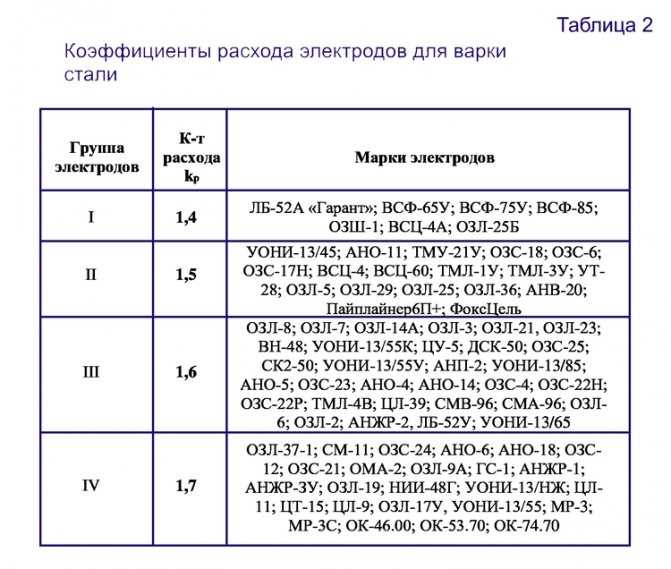 Показан полярографический эксперимент с использованием митохондрий, выделенных из сердца крысы дикого типа. ( a ) Добавляется сукцинат (5 мкМ). ( b ) Добавлены митохондрии сердца крысы (0,9 мг/мл). ( c ) Добавляют 125 нмоль АДФ. ( d ) Добавляют ДНФ (50 мкМ).
Показан полярографический эксперимент с использованием митохондрий, выделенных из сердца крысы дикого типа. ( a ) Добавляется сукцинат (5 мкМ). ( b ) Добавлены митохондрии сердца крысы (0,9 мг/мл). ( c ) Добавляют 125 нмоль АДФ. ( d ) Добавляют ДНФ (50 мкМ).
1. Все исходные растворы стерилизовать фильтрованием через вакуумный фильтр с размером пор 0,22 мкм и хранить при 4°C в течение 1–2 месяцев. Растворы также можно автоклавировать, за исключением растворов, содержащих сахарозу, которая карамелизуется и окрашивает раствор в коричневый цвет.
2. При хранении при 4°C маточный раствор маннита (или другие растворы, содержащие маннит) может выпадать из раствора в осадок. В этом случае просто нагрейте на водяной бане до 65°C, чтобы кристаллы растворились непосредственно перед использованием.
3. ЭГТА не растворяется должным образом без добавления основания. Как только pH достаточно повышается, EGTA быстро переходит в раствор. Будьте осторожны при титровании до pH 7,5, чтобы не перескочить.
Как только pH достаточно повышается, EGTA быстро переходит в раствор. Будьте осторожны при титровании до pH 7,5, чтобы не перескочить.
4. Исходные растворы имеют концентрацию 0,65 М, поэтому добавление 5 мкл исходного раствора в микрокамеру дает конечную концентрацию 5 мМ. Наиболее часто используемые субстраты включают малат, глутамат, пируват и сукцинат, и они окисляются с высокой скоростью во многих тканях и типах клеток млекопитающих (3, 4, 6-9).). Как правило, малат + глутамат или малат + пируват используются для анализа дыхания, специфичного для комплекса I, тогда как сукцинат используется для анализа дыхания, специфичного для комплекса II. Пальмитоилкарнитин (0,4 мМ) плюс малат (1 мМ) представляет собой пару субстратов, подходящую для оценки окисления жирных кислот. Аскорбат в сочетании с тетраметилфенилендиамином (ТМФД) для восстановления внутримитохондриального цитохрома  Важно следить за тем, чтобы рН субстратов и буфера оставался в пределах от 7,2 до 7,4. Большинство субстратов, используемых для полярографии, представляют собой органические кислоты, и добавление субстратов с ненейтральным pH может разъединить митохондрии.
Важно следить за тем, чтобы рН субстратов и буфера оставался в пределах от 7,2 до 7,4. Большинство субстратов, используемых для полярографии, представляют собой органические кислоты, и добавление субстратов с ненейтральным pH может разъединить митохондрии.
5. Точность концентрации АДФ важна, поскольку расчет отношения АДФ/О основан на предположении, что каждый микролитр АДФ содержит 25 нмоль.
6. Разобщители разрушают функциональную связь между дыхательной цепью и АТФ-синтазой, рассеивая протонный электрохимический градиент. Мы обычно используем DNP для полярографии, но другие протонные ионофоры, такие как карбонилцианид m -хлорфенилгидразон (CCCP) или карбонилцианид-9Также можно использовать 0013 p -трифторметоксифенилгидразон (FCCP). Исходный раствор ДНП составляет 6,5 мМ; поэтому добавление 5 мкл ДНФ к полному объему микрокамеры приведет к конечной концентрации 50 мкМ.
7. В целом, 1 г ткани млекопитающих обеспечивает выход 0,5–2 мг изолированных митохондрий, в зависимости от конкретной ткани. Для Drosophila , 100 взрослых мух или достаточное количество личинок третьего возраста, чтобы заполнить 1,5 мл Эппендорфа до 0,5 мл, даст примерно 0,5 мг митохондрий.
Для Drosophila , 100 взрослых мух или достаточное количество личинок третьего возраста, чтобы заполнить 1,5 мл Эппендорфа до 0,5 мл, даст примерно 0,5 мг митохондрий.
8. Чрезвычайно важно постоянно хранить все реагенты и образцы при температуре 4°C или на льду.
10. Ткани печени и головного мозга имеют минимальное количество соединительной ткани, поэтому восемь-десять ударов пестиком B («плотно прилегающим») обычно приводят к полной гомогенизации. Для тканей с более значительной соединительной тканью, таких как легкие, сердце, скелетные мышцы и почки, можно использовать лезвие бритвы для измельчения ткани на мелкие кусочки, чтобы облегчить гомогенизацию и улучшить выход митохондрий. Кроме того, для сердца и скелетных мышц пестик А («пестик со свободной посадкой») следует использовать для пяти начальных проходов, чтобы гарантировать полное разрушение соединительной ткани, после чего следует пять-шесть дополнительных проходов с использованием пестика В для завершения гомогенизации.
11. Для выделения митохондрий из взрослых особей дрозофилы или личинок мы используем пропитанную буфером марлю для фильтрации остатков экзоскелета взрослых особей или жира личинок из гомогената перед центрифугированием.
12. Обязательно учитывайте 0,5% BSA при определении концентрации белка. Либо вычтите его из общей концентрации, либо промойте и ресуспендируйте небольшую аликвоту митохондриального осадка в буфере, не содержащем BSA, перед измерением концентрации белка.
13. Требуется полиэтиленовая мембрана, обеспечивающая диффузию кислорода, но не метаболитов. Пластик из любого обычного пластикового пакета для сэндвичей на самом деле очень хорошо работает в качестве мембраны.
14. Избегайте попадания пузырьков воздуха в камеру, так как пузырьки вытесняют объем, уменьшая полезный объем камеры.
15. При объеме камеры 650 мкл, постоянной температуре 30°C и высоте над уровнем моря (давление 1 атм.) насыщенный воздухом буфер в камере будет содержать 312 нг атомарного кислорода (10 ).
16. Как правило, митохондрии следует добавлять до конечной концентрации белка 0,3–0,8 мг/мл, а выделенная суспензия митохондрий должна иметь минимальную концентрацию 10 мг/мл, чтобы свести к минимуму объем, добавляемый к камера.
17. Следует добавить достаточное количество митохондрий, чтобы обычный анализ занимал примерно 10–15 мин. Избегайте добавления слишком большого количества митохондрий, что приводит к тому, что анализ занимает менее 5 минут, и это слишком быстро, чтобы удобно добавлять АДФ или ингибиторы. Если анализ занимает более 20–25 минут, митохондрии дикого типа могут демонстрировать функциональное ухудшение. Оптимальное количество митохондрий должно быть определено эмпирически для каждой ткани. По нашему опыту оптимальная концентрация для митохондрий млекопитающих составляет 0,3–0,6 мг/мл, а для митохондрий дрозофилы составляет 0,45–0,9 мг/мл.
18. Отношение частоты в состоянии III к частоте в состоянии IV выражается как коэффициент контроля дыхания (RCR) и должно быть больше 3,0 для хорошо связанных митохондрий дикого типа (4). RCR менее 3,0 для митохондрий дикого типа чаще всего предполагает субоптимальную концентрацию митохондрий или техническую проблему с изоляцией митохондрий, которая повреждает целостность внутренней мембраны.
RCR менее 3,0 для митохондрий дикого типа чаще всего предполагает субоптимальную концентрацию митохондрий или техническую проблему с изоляцией митохондрий, которая повреждает целостность внутренней мембраны.
19. ДНП следует добавлять, пока в микрокамере остается не менее 30% от общего содержания кислорода. Это гарантирует, что максимальное несвязанное дыхание происходит в течение достаточного периода времени, чтобы можно было точно определить скорость (т. е. не менее 2 мин).
1. Chance B, and Williams GR (1955) Простой и быстрый анализ окислительного фосфорилирования, Nature 175, 1120–1121. [PubMed] [Google Scholar]
2. Brand MD, and Nicholls DG (2011) Оценка митохондриальной дисфункции в клетках, Biochem. Дж 435, 297–312. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Barrientos A (2002) Оценка активности OXPHOS in vivo и in organello, методы 26, 307–316. [PubMed] [Google Scholar]
4. Траунс И.А., Ким Ю.Л., Джун А.С. и Уоллес Д. К. (1996) Оценка митохондриального окислительного фосфорилирования в биопсиях мышц пациентов, лимфобластах и трансмитохондриальных клеточных линиях, Методы Энзимол
264, 484–509. [PubMed] [Google Scholar]
К. (1996) Оценка митохондриального окислительного фосфорилирования в биопсиях мышц пациентов, лимфобластах и трансмитохондриальных клеточных линиях, Методы Энзимол
264, 484–509. [PubMed] [Google Scholar]
5. Bradford MM (1976) Быстрый и чувствительный метод количественного определения количества белка в микрограммах с использованием принципа связывания белка с красителем, Anal Biochem. 72, 248–254. [PubMed] [Академия Google]
6. Пухович М.А., Варнес М.Е., Коэн Б.Х., Фридман Н.Р., Керр Д.С. и Хоппель С.Л. (2004) Анализ окислительного фосфорилирования: оценка интегрированной функциональной активности митохондрий скелетных мышц человека – тематические исследования, Митохондрия 4, 377–385. [PubMed] [Google Scholar]
7. Rasmussen UF, and Rasmussen HN (2000) Митохондрии четырехглавой мышцы человека: функциональная характеристика, Mol Cell Biochem 208, 37–44. [PubMed] [Google Scholar]
8. Rossignol R, Letellier T, Malgat M, Rocher C, and Mazat JP (2000) Изменения тканей в контроле окислительного фосфорилирования: значение для митохондриальных заболеваний, Biochem J
347
Ч. 1, 45–53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
1, 45–53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Wenchich L, Drahota Z, Honzik T, Hansikova H, Tesarova M, Zeman J, and Houstek J (2003) Полярографическая оценка активности митохондриальных ферментов в изолированных митохондриях и пермеабилизированных мышечных клетках человека с наследственными митохондриальными дефектами, Physiol Res 52, 781–788. [PubMed] [Google Scholar]
10. Трусдейл Г.А. и Даунинг А.Л. (1954) Растворимость кислорода в воде, природа. 173, 1236. [Google Scholar]
Китайский производитель графитовых электродов, графитовый порошок, поставщик углеродных добавок
Горячие продукты
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
графит
Цена на условиях ФОБ: 1350-3000 долларов США / Тонн
Мин. Заказ:
1 тонна
Заказ:
1 тонна
Свяжитесь сейчас
Популярные продукты
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Свяжитесь сейчас
Свяжитесь сейчас
Графитовый электрод
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
ПРОДУКЦИЯ
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Профиль компании
{{ util.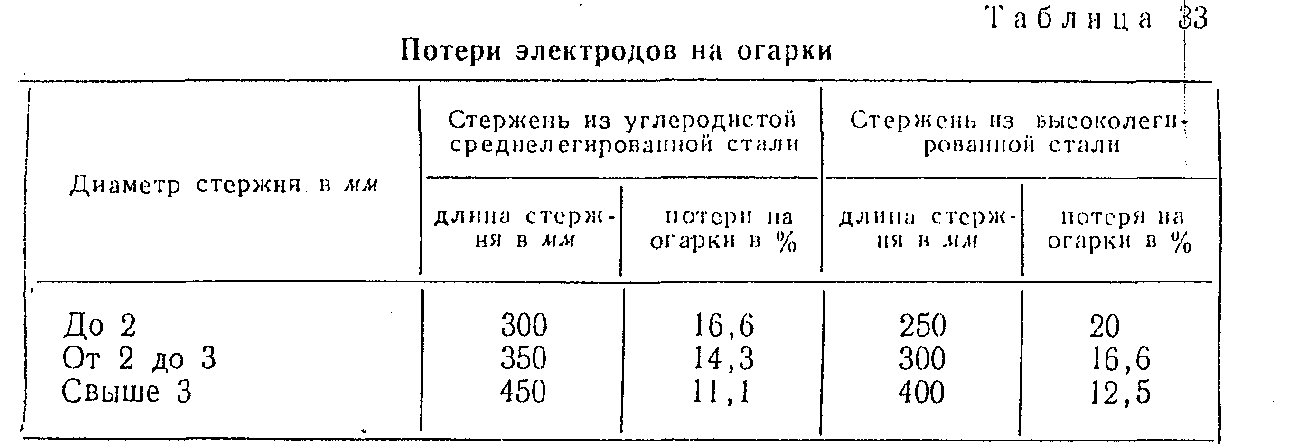 each(imageUrls, функция(imageUrl){}}
each(imageUrls, функция(imageUrl){}}
{{ }) }}
{{ если (изображениеUrls.length > 1){ }}
{{ } }}
| Вид бизнеса: | Производитель/завод, Торговая компания | |
| Деловой диапазон: | Металлургия, полезные ископаемые и энергетика | |
| Основные продукты: | Графитовый электрод
,
Графитовый порошок
,
Углеродная добавка
,
Углерода Райзер
,
карбюратор
,
ГПХ
,
. .. .. | |
| Сертификация системы менеджмента: | ИСО 9001 |
Linyi Yanjun Carbon Material Co., Ltd. является экспортной компанией компании Linyi County Lubei Carbon Co., Ltd., расположенной на Huaxing Road, в зоне экономического развития Hengyuan, округ Linyi, город Dezhou, провинция Шаньдун. У нас есть 7-летний опыт экспорта, и наша фабрика была основана в 2003 году, ее площадь составляет 100 000 квадратных метров, и в настоящее время на ней работает 200 человек.

 Сначала добавьте 3,5 г гранул NaOH, а затем осторожно титруйте pH до 7,5, добавляя отдельные гранулы NaOH по мере необходимости (см. примечание 3). Добавьте воду до конечного объема 100 мл.
Сначала добавьте 3,5 г гранул NaOH, а затем осторожно титруйте pH до 7,5, добавляя отдельные гранулы NaOH по мере необходимости (см. примечание 3). Добавьте воду до конечного объема 100 мл. ). Добавьте ультрачистую воду до конечного объема 1 л. Фильтруйте и стерилизуйте буфер и храните при 4°C.
). Добавьте ультрачистую воду до конечного объема 1 л. Фильтруйте и стерилизуйте буфер и храните при 4°C. PO 4 (pH 7,2). Добавить ультрачистую воду до конечного объема 0,5 л. Профильтровать, стерилизовать, разлить на аликвоты по 50 мл и хранить при -20°C.
PO 4 (pH 7,2). Добавить ультрачистую воду до конечного объема 0,5 л. Профильтровать, стерилизовать, разлить на аликвоты по 50 мл и хранить при -20°C. С в течение 20 мин. Отрегулируйте pH до нейтрального с помощью 1 M HCl, добавив ~ 3 мл. Проверяйте рН до достижения 7,2 (раствор ДНФ должен иметь полупрозрачный желтый цвет). Добавьте сверхчистую воду, чтобы получить окончательный объем 20 мл, разлейте на аликвоты по 150 мкл и храните при -80°C (см. примечание 6).
С в течение 20 мин. Отрегулируйте pH до нейтрального с помощью 1 M HCl, добавив ~ 3 мл. Проверяйте рН до достижения 7,2 (раствор ДНФ должен иметь полупрозрачный желтый цвет). Добавьте сверхчистую воду, чтобы получить окончательный объем 20 мл, разлейте на аликвоты по 150 мкл и храните при -80°C (см. примечание 6). примечание 7) и дважды промойте 2–5 мл охлажденного льдом PBS или буфера для выделения, чтобы удалить любой связанный мусор (см. примечание 8).
примечание 7) и дважды промойте 2–5 мл охлажденного льдом PBS или буфера для выделения, чтобы удалить любой связанный мусор (см. примечание 8).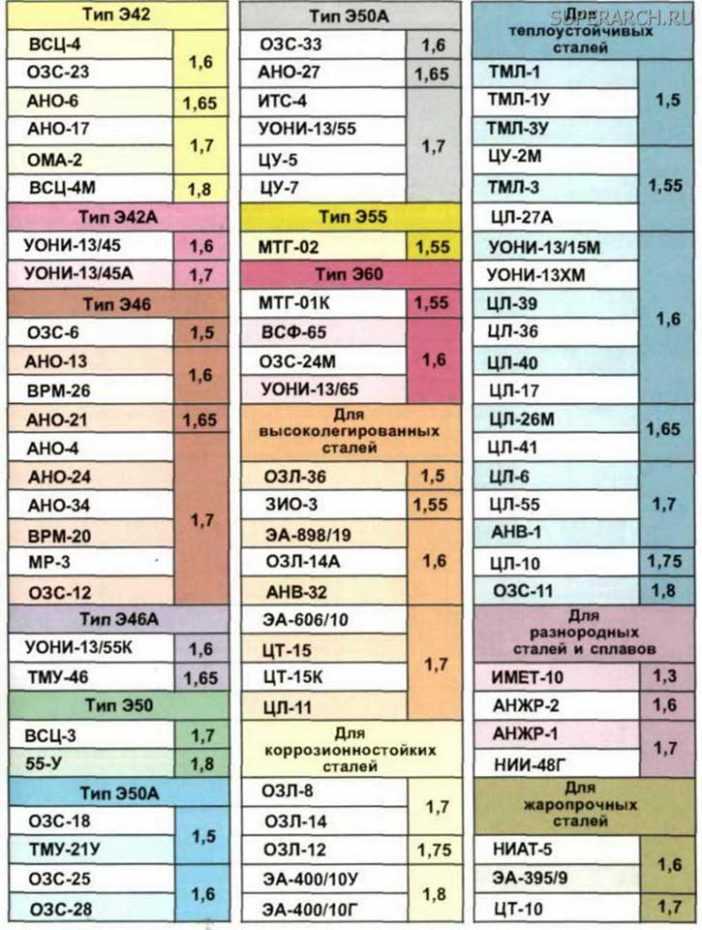 Подзаголовок 3.2 ниже). Определите концентрацию белка, используя любой из стандартных колориметрических методов, таких как анализ Брэдфорда (5) (см. примечание 12).
Подзаголовок 3.2 ниже). Определите концентрацию белка, используя любой из стандартных колориметрических методов, таких как анализ Брэдфорда (5) (см. примечание 12).
 примечание 18). После возобновления дыхания в состоянии IV в течение 1–2 минут (достаточно времени для точного измерения частоты дыхания) можно сделать второе добавление АДФ, что должно привести к такой же частоте дыхания в состоянии III и переходу обратно в состояние IV (пусть работает в течение 1 –2 мин).
примечание 18). После возобновления дыхания в состоянии IV в течение 1–2 минут (достаточно времени для точного измерения частоты дыхания) можно сделать второе добавление АДФ, что должно привести к такой же частоте дыхания в состоянии III и переходу обратно в состояние IV (пусть работает в течение 1 –2 мин).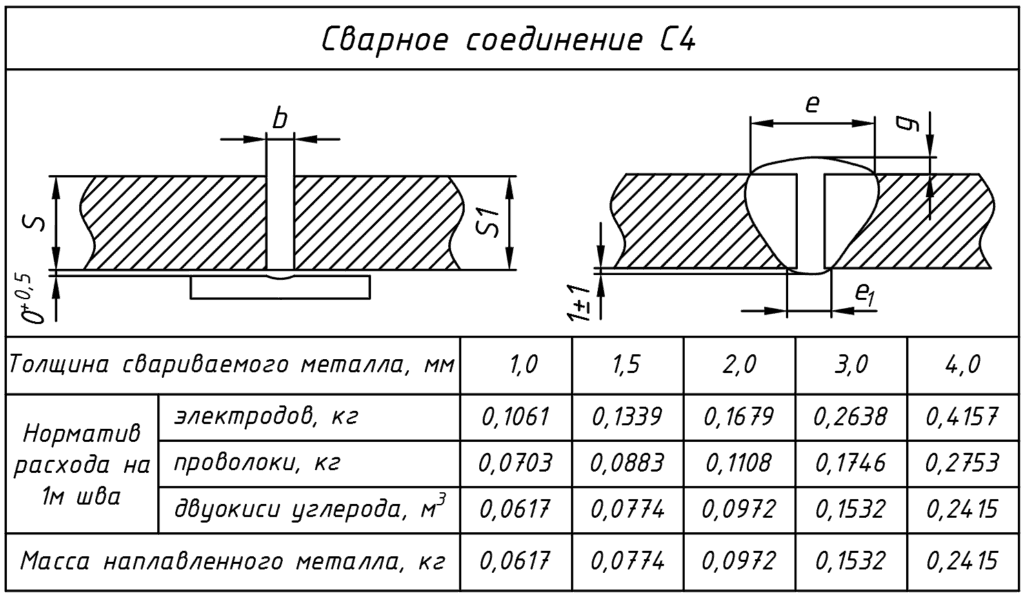 Показан полярографический эксперимент с использованием митохондрий, выделенных из личинок третьего возраста Drosophila melanogaster дикого типа . ( a ) Добавляют глутамат + малат (по 5 мкМ каждого). ( b ) Добавлены митохондрии личинок мух (0,3 мг/мл). ( c ) Добавляют 125 нмоль АДФ. ( d ) Добавляют ДНФ (50 мкМ).
Показан полярографический эксперимент с использованием митохондрий, выделенных из личинок третьего возраста Drosophila melanogaster дикого типа . ( a ) Добавляют глутамат + малат (по 5 мкМ каждого). ( b ) Добавлены митохондрии личинок мух (0,3 мг/мл). ( c ) Добавляют 125 нмоль АДФ. ( d ) Добавляют ДНФ (50 мкМ).