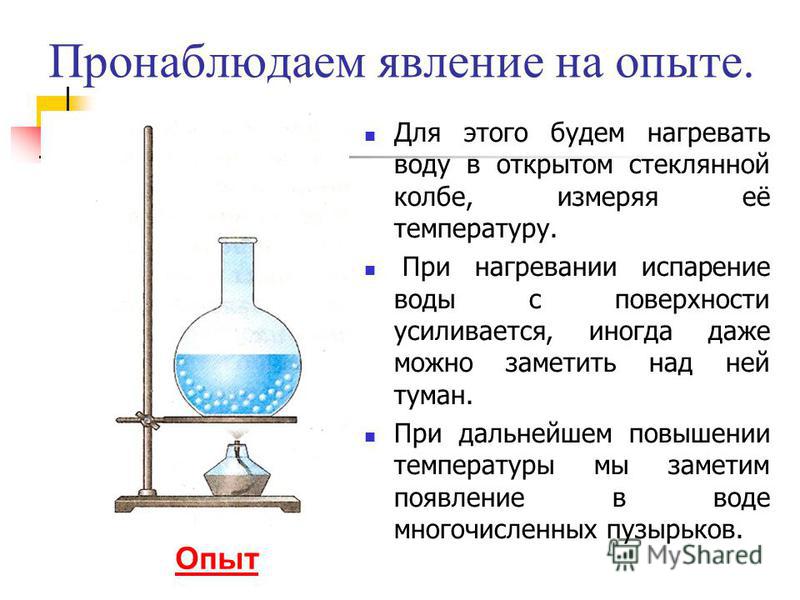
Удельная теплота парообразования
Знаете ли вы, какова температура варящегося супа? 100 ˚С. Ни больше, ни меньше. При той же температуре закипает чайник, и варятся макароны. Что это значит?
Почему при постоянном подогреве кастрюльки или чайника горящим газом температура воды внутри не подымается выше ста градусов? Дело в том, что когда вода достигает температуры в сто градусов, вся поступающая тепловая энергия расходуется на переход воды в газообразное состояние, то есть испарение. До ста градусов испарение происходит в основном с поверхности, а достигнув этой температуры, вода закипает. Кипение – это тоже испарение, но только по всему объему жидкости. Пузырьки с горячим паром образуются внутри воды и, будучи легче воды, эти пузырьки вырываются на поверхность, а пар из них улетучивается в воздух.
До ста градусов температура воды при нагревании растет. После ста градусов при дальнейшем нагревании будет расти температура водяного пара. А вот пока вся вода не выкипит при ста градусах, ее температура не повысится, сколько энергии не прикладывай.
Удельная теплота парообразования воды
Удельная теплота парообразования – это физическая величина, которая показывает количество теплоты, нужное, чтобы превратить жидкость массой 1 кг в пар при температуре кипения. Обозначается удельная теплота парообразования буквой L. А единицей измерения является джоуль на килограмм (1 Дж/кг).
Удельную теплоту парообразования можно найти из формулы:
L=Q/m,
где Q – это количество теплоты,
m – масса тела.
Кстати, формула такая же, как и для расчета удельной теплоты плавления, разница лишь в обозначении. λ и L
Опытным путем найдены значения удельной теплоты парообразования различных веществ и составлены таблицы, откуда можно найти данные для каждого вещества. Так, удельная теплота парообразования воды равна 2,3*106 Дж/кг. Это означает, что на каждый килограмм воды необходимо потратить количество энергии, равное 2,3*106 Дж, чтобы превратить ее в пар. Но при этом вода должна уже обладать температурой кипения. Если вода изначально была более низкой температуры, то необходимо рассчитать еще то количество теплоты, которое потребуется для подогрева воды до ста градусов.
Так, удельная теплота парообразования воды равна 2,3*106 Дж/кг. Это означает, что на каждый килограмм воды необходимо потратить количество энергии, равное 2,3*106 Дж, чтобы превратить ее в пар. Но при этом вода должна уже обладать температурой кипения. Если вода изначально была более низкой температуры, то необходимо рассчитать еще то количество теплоты, которое потребуется для подогрева воды до ста градусов.
В реальных условиях часто требуется определить количество теплоты, необходимое для превращения в пар определенной массы какой-либо жидкости, поэтому чаще приходится иметь дело с формулой вида: Q=Lm, а значения удельной теплоты парообразования для конкретного вещества берут из готовых таблиц.
Нужна помощь в учебе?
Предыдущая тема: Испарение и кипение: как происходит процесс, особенности
Следующая тема:   Двигатель внутреннего сгорания: устройство и принцип работы
Кипение — урок.
 Физика, 8 класс.
Физика, 8 класс.Вы уже изучили такой вид парообразования как испарение.
Рассмотрим второй способ образования пара — кипение.
Кипение — это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности, но и по всему объёму.
Рассмотрим пример — кипение воды.
В воде растворены молекулы воздуха (газов). При нагревании этот растворённый газ выделяется в виде воздушных пузырьков на дне и стенках сосуда.
С повышением температуры жидкости внутри этих пузырьков испаряется вода, они увеличиваются в размерах. Достигнув определённого размера, пузырьки отрываются от поверхности.
Если вода прогрета недостаточно, то пузырьки пара в холодных слоях схлопываются. А если температура достаточная, то они достигают поверхности воздуха или жидкости и лопаются, выпуская пар. В этот момент слышен шум, предшествующий обычно кипению. При определённой температуре вода закипает.
Температуру, при которой жидкость кипит, называют температурой кипения.
Обрати внимание!
Во время кипения температура жидкости не изменяется, так как вся энергия расходуется на парообразование.
Температура кипения жидкости зависит от двух факторов:
- от рода жидкости;
- от внешнего давления.
Для каждого вещества существует своя температура кипения.
| Вещество | Температура кипения (при норм. атм. давлении), °С |
| воздух | \(-193\) |
| кислород | \(-183\) |
| эфир | \(35\) |
| спирт | \(78\) |
| вода | \(100\) |
| ртуть | \(357\) |
| свинец | \(1740\) |
| медь | \(2567\) |
При уменьшении давления воздушным пузырькам легче всплывать, кипение происходит при меньшей температуре. Именно поэтому высоко в горах (на высотах \(6000\) — \(8000\) м) не варят суп или мясо, а пользуются готовыми консервами, т.к. температура кипения воды меньше \(100\)°С.
Именно поэтому высоко в горах (на высотах \(6000\) — \(8000\) м) не варят суп или мясо, а пользуются готовыми консервами, т.к. температура кипения воды меньше \(100\)°С.
Различные жидкости одной и той же массы требуют разное количество теплоты для их обращения в пар при температуре кипения.
Q=L ·m, где
\(Q\) — количество теплоты, необходимое для обращения вещества в пар;
\(m\) — масса вещества;
\(L\) — удельная теплота.
Удельная теплота парообразования (L) — физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.
Источники:
https://im1-tub-by.yandex.net/i?id=7ddeb50fb612a79341d248ab78cf8156-l&n=13
http://gigabaza.ru/doc/30910.html
https://im0-tub-by.yandex.net/i?id=e0e2f9593f70e5cb32baca4384213c3f-l&n=13
http://chajinfo.ru/wp-content/uploads/2016/03/Kipyashhaya-voda.jpg
http://antonganja. ru/wp-content/uploads/2014/05/Shasta-Road.jpg
ru/wp-content/uploads/2014/05/Shasta-Road.jpg
Количество теплоты, необходимое для парообразования и выделяющееся при конденсации
Если, добившись кипения воды в сосуде, выключить под ним нагреватель (см. рис. 82), кипение воды быстро прекратится. Температура воды начнет понижаться, и через некоторое время она станет такой же, как у окружающего воздуха.
Для того чтобы вода не переставала кипеть, ее температура должна поддерживаться неизменной. А для этого вода должна непрерывно получать достаточное количество теплоты. Только в этом случае она будет продолжать кипеть, и это кипение не прекратится до тех пор, пока вся вода не обратится в пар.
Опытами установлено, что для полного обращения в пар 1 кг воды (при температуре кипения) необходимо затратить 2,3 МДж энергии. Для обращения в пар других жидкостей той же массы требуется иное количество теплоты. Например, для спирта оно составляет 0,9 МДж.
Физическая величина, показывающая, какое количество теплоты необходимо для превращения в пар 1 кг жидкости при постоянной температуре, называется удельной теплотой парообразования
.
Удельную теплоту парообразования обозначают буквой r и измеряют в джоулях на килограмм (Дж/кг):
r — удельная теплота парообразования.
Удельную теплоту парообразования некоторых веществ можно найти в таблице 12.
Из этой таблицы, например, видно, что удельная теплота парообразования эфира равна 0,4*106 Дж/кг. Это число показывает, что для превращения в пар 1 кг эфира (при его температуре кипения) необходимо затратить 0,4*106 Дж энергии. Точно такое же (по модулю) количество теплоты будет выделено парами эфира (той же массы и при той же температуре) при их конденсации.
Для превращения в пар 2 кг жидкости требуется в 2 раз большее количество теплоты, для превращения в пар 3 кг жидкости — в 3 раза большее и т. д.
Чтобы найти количество теплоты, необходимое для превращения в пар жидкости произвольной массы т, взятой при температуре кипения, надо удельную теплоту парообразования этой жидкости умножить на ее массу
Q = rm. (42.1)
(42.1)
Количество теплоты, которое выделяет пар массой m, конденсируясь при температуре кипения, определяется той же формулой, но со знаком «минус»:
Q = –rm. (42.2)
1. Почему после выключения нагревателя кипение жидкости прекращается? 2. Что такое удельная теплота парообразования? 3. Удельная теплота парообразования воды равна 2,3 МДж/кг. Что показывает это число? 4. Опишите явления, происходящие в опыте, изображенном на рисунке 84. 5. Какая энергия выделяется при конденсации паров спирта массой 1 кг при температуре 78 °С?
Термодинамика – Физика – Теория, тесты, формулы и задачи
Оглавление:
Основные теоретические сведения
Теплоемкость вещества
К оглавлению…
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. Тогда количество теплоты (энергии) необходимое для изменения температуры некоторого тела массой m можно рассчитать по формуле:
Тогда количество теплоты (энергии) необходимое для изменения температуры некоторого тела массой m можно рассчитать по формуле:
При этом в этой формуле абсолютно не важно в каких единицах подставлена температура, так как нам важно не ее абсолютное значение, а изменение. Единица измерения удельной теплоемкости вещества: Дж/(кг∙К).
- Если t2 > t1, то Q > 0 – тело нагревается (получает тепло).
- Если t2 < t1, то Q < 0 – тело охлаждается (отдает тепло).
Произведение массы тела на удельную теплоемкость вещества, из которого оно изготовлено называется
Если в условии задачи сказано про теплоемкость тела, то количество теплоты, отданное или полученное этим телом, можно рассчитать по формуле:
Итак, запомните:
- Удельная теплоемкость обозначается маленькой буквой с, и является характеристикой вещества.

- (Просто) Теплоемкость обозначается большой буквой С, и является характеристикой данного тела.
Напомним, что количество теплоты Q отданное каким–либо источником (нагревателем) рассчитывается по формуле: Q = Pt, где: P – мощность источника, t – время, в течение которого источник отдавал тепло. При решении задач не путайте время работы источника и температуру.
Фазовые превращения
К оглавлению…
Фазой вещества называется однородная система, например, твердое тело, физические свойства которой во всех точках одинаковые. Между различными фазами вещества при обычных условиях существует четко выраженная граница (поверхность) раздела. При изменении внешних условий (температуры, давления, электрических и магнитных полей) вещество может переходить из одной фазы в другую. Такие процессы называются фазовыми превращениями (переходами).
Процесс фазового перехода из жидкого состояния в газообразное (парообразование) или из твердого в жидкое (плавление) может происходить только при сообщении веществу некоторого количества теплоты. Обратные фазовые переходы (конденсация и кристаллизация, или отвердевание) сопровождаются выделением такого же количества теплоты.
Обратные фазовые переходы (конденсация и кристаллизация, или отвердевание) сопровождаются выделением такого же количества теплоты.
Количество теплоты, поступающее в систему или выделяющееся из нее, изменяет ее внутреннюю энергию. Это означает, что внутренняя энергия пара при 100°С больше, чем жидкости при той же температуре. Указанные фазовые переходы идут при постоянных температурах, которые называются соответственно температурой кипения и температурой плавления. Количество теплоты, необходимое для превращения жидкости в пар или выделяемое паром при конденсации, называется теплотой парообразования:
где: r – удельная теплота парообразования. Единица измерения [r] = 1 Дж/кг. Физический смысл удельной теплоты парообразования: она равна количеству теплоты, необходимому для превращения в пар 1 кг жидкости, находящейся при температуре кипения. Превращение жидкости в пар не требует доведение жидкости до кипения. Вода может превратиться в пар и при комнатной температуре. Такой процесс называется испарением.
Вода может превратиться в пар и при комнатной температуре. Такой процесс называется испарением.
Количество теплоты, необходимое для плавления тела или выделяемое при кристаллизации (отвердевании), называется теплотой плавления:
где: λ – удельная теплота плавления. Единица измерения [λ] = 1 Дж/кг. Физический смысл удельной теплоты плавления: теплота, необходимая для плавления 1 кг вещества, находящегося при температуре плавления. Удельные теплоты парообразования и плавления называются также скрытыми теплотами, поскольку при фазовых переходах температура системы не меняется, несмотря на то, что теплота к ней подводится.
Обратите внимание: что во время фазовых переходов температура системы не изменяется. А также на то, что сами фазовые переходы начинаются только после достижения необходимой температуры.
Наиболее распространенным источником энергии для нужд человека является топливо – вещество, при сгорании которого выделяется некоторое количество теплоты. Количество теплоты, выделяемое при сгорании топлива массой m, называется теплотой сгорания топлива:
Количество теплоты, выделяемое при сгорании топлива массой m, называется теплотой сгорания топлива:
где: q – удельная теплота сгорания (теплотворная способность, калорийность) топлива. Единица измерения [q] = 1 Дж/кг. Физический смысл удельной теплоты сгорания топлива: величина, показывающая, какое количество теплоты выделяется при полном сгорании 1 кг топлива.
Уравнение теплового баланса
К оглавлению…
В соответствии с законом сохранения энергии для замкнутой системы тел, в которой не происходит никаких превращений энергии, кроме теплообмена, количество теплоты, отдаваемое более нагретыми телами, равно количеству теплоты, получаемому более холодными. Теплообмен прекращается в состоянии термодинамического равновесия, т.е. когда температура всех тел системы становится одинаковой. Сформулируем уравнение теплового баланса: в замкнутой системе тел алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующими в теплообмене, равна нулю:
При использовании такой формы записи уравнения теплового баланса, чтобы не сделать ошибку, запомните: когда Вы будете считать теплоту при нагревании или охлаждении тела, нужно из большей температуры вычитать меньшую, чтобы теплота всегда была положительной. Если все теплоты записывать с учетом знака, где «+» соответствует получению энергии телом, а «–» выделению, то уравнение теплового баланса можно записать в виде:
Если все теплоты записывать с учетом знака, где «+» соответствует получению энергии телом, а «–» выделению, то уравнение теплового баланса можно записать в виде:
При использовании такой формы записи, нужно всегда от конечной температуры отнимать начальную. При таком подходе знак их разности сам «покажет» отдаёт тело теплоту или получает.
Запомните, что тело поглощает теплоту если происходит:
- Нагревание,
- Плавление,
- Парообразование.
Тело отдает теплоту если происходит:
- Охлаждение,
- Кристаллизация,
- Конденсация,
- Сгорание топлива.
Именно в этой теме, имеет смысл не решать задачи в общем виде, а сразу подставлять числа.
Взаимные превращения механической и внутренней энергии
При неупругих ударах механическая энергия частично или полностью переходит во внутреннюю энергию тел, то есть тела могут нагреваться и плавится. В общем случае изменение механической энергии равно выделяющемуся количеству теплоты.
В общем случае изменение механической энергии равно выделяющемуся количеству теплоты.
Работа идеального газа
К оглавлению…
Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно–кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярно–кинетические модели для иллюстрации своих выводов.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими (или квазистационарными, еще одно название таких процессов – равновесные).
В изобарном процессе работу идеального газа можно рассчитывать по формулам:
Подчеркнем еще раз: работу газа по расширению можно считать по этим формулам только если давление постоянно. Согласно данной формуле, при расширении газ совершает положительную работу, а при сжатии – отрицательную (т.е. газ сопротивляется сжатию и над ним нужно совершать работу чтобы оно состоялось).
Если давление нельзя считать постоянным, то работу газа находят, как площадь фигуры под графиком в координатах (p, V). Очевидно, что в изохорном процессе работа газа равна нулю.
Ввиду того, что работа газа численно равна площади под графиком, становится понятно, что величина работы зависит от того, какой именно процесс происходил, ведь у каждого процесса свой график, а под ним своя площадь. Таким образом, работа зависит не только и не столько от начального и конечного состояний газа, сколько от процесса, с помощью которого конечное состояние было достигнуто.
Внутренняя энергия
К оглавлению…
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно–кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия одноатомного идеального газа рассчитывается по формулам:
В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия одноатомного идеального газа рассчитывается по формулам:
Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния. Это значит, что изменение внутренней энергии не зависит от того, как система была переведена из одного состояния в другое (а зависит лишь от характеристик первоначального и конечного состояний) и всегда, в любых процессах для одноатомного идеального газа определяется выражением:
Обратите внимание: эта формула верна только для одноатомного газа, зато она применима ко всем процессам (а не только к изобарному, как формула для работы). Как видно из формулы, если температура не изменялась, то внутренняя энергия остаётся постоянной.
Как видно из формулы, если температура не изменялась, то внутренняя энергия остаётся постоянной.
Первый закон термодинамики
К оглавлению…
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, то есть изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Первый закон (начало) термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.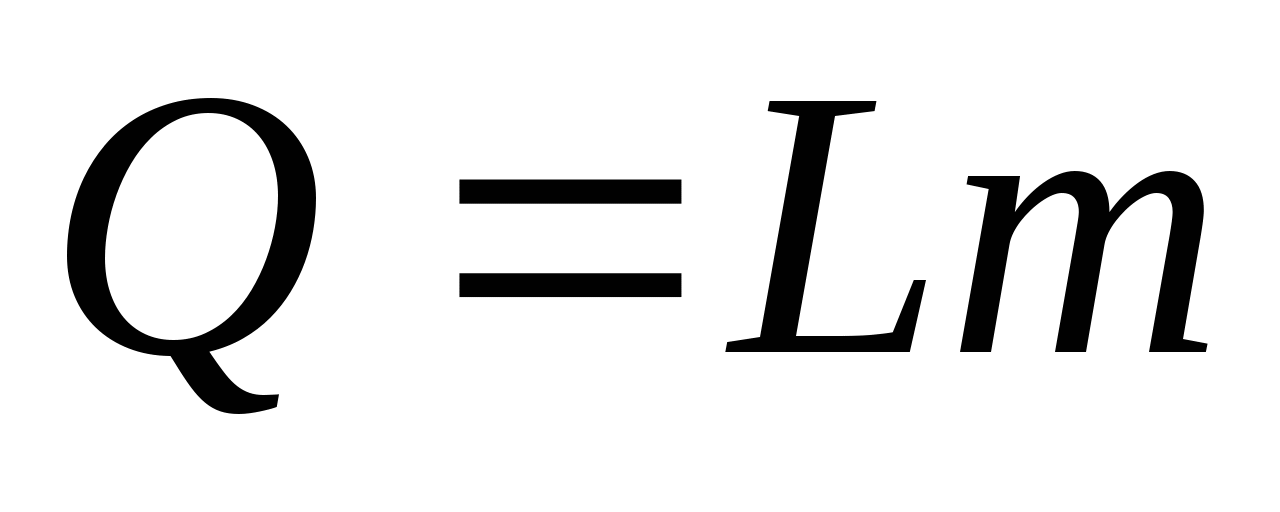 Однако, соотношение, выражающее первый закон термодинамики, чаще записывают в немного другой форме:
Однако, соотношение, выражающее первый закон термодинамики, чаще записывают в немного другой форме:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами (такая формулировка более удобна и понятна, в таком виде совсем очевидно, что это просто закон сохранения энергии).
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких–либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии.
Адиабатным (адиабатическим) называют процесс, в ходе которого система не обменивается теплотой с окружающей средой. При адиабатном процессе Q = 0. Поэтому: ΔU + A = 0, то есть: A = – ΔU. Газ совершает работу за счет уменьшения собственной внутренней энергии.
Первое начало термодинамики и изопроцессы
К оглавлению…
Для различных изопроцессов можно выписать формулы по которым могут быть рассчитаны полученная теплота Q, изменение внутренней энергии ΔU и работа газа A. Изохорный процесс (V = const):
Изобарный процесс (p = const):
Изотермический процесс (T = const):
Адиабатный процесс (Q = 0):
Если в задаче явно не сказано, что газ одноатомный (или не назван один из инертных газов, например, гелий), то применять формулы из этого раздела нельзя.
Циклы. Тепловые машины
К оглавлению. ..
..
Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами.
Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т.д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние.
Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0.
Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0.
КПД тепловой машины может быть рассчитан по формуле:
где: Q1 – количество теплоты полученное рабочим телом за один цикл от нагревателя, Q2 – количество теплоты переданное рабочим телом за один цикл холодильнику. Работа совершенная тепловой машиной за один цикл:
Коэффициент полезного действия указывает, какая часть тепловой энергии, полученной рабочим телом от «горячего» теплового резервуара, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. Коэффициент полезного действия тепловой машины всегда меньше единицы (η < 1).
Наибольший КПД при заданных температурах нагревателя T1 и холодильника T2, достигается если тепловая машина работает по циклу Карно. Цикл Карно состоит из двух изотерм и двух адиабат. КПД цикла Карно равен:
Второе начало (второй закон) термодинамики
К оглавлению…
Первый закон термодинамики не устанавливает направление протекания тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.
При этом сама система и окружающие тела возвращаются к исходному состоянию.
Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из–за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т.д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Английский физик У.Кельвин дал в 1851 году следующую формулировку второго закона: В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Гипотетическую тепловую машину, в которой мог бы происходить такой процесс, называют «вечным двигателем второго рода». Как уже должно было стать понятно, второе начало термодинамики запрещает существование такого двигателя.
Немецкий физик Р.Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой. Следует отметить, что обе формулировки второго закона термодинамики эквивалентны.
Сложные задачи по термодинамике
К оглавлению…
При решении различных нестандартных задач по термодинамике необходимо учитывать следующие замечания:
- Для нахождения работы идеального газа надо построить график процесса в координатах p(V) и найти площадь фигуры под графиком. Если дан график процесса в координатах p(T) или V(T), то его сначала перестраивают в координаты p(V).
 Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V).
Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V). - Для нахождения работы смеси газов используют закон Дальтона.
- При объединении теплоизолированных сосудов не должна изменяться внутренняя энергия всей системы, т.е. на сколько джоулей увеличится внутренняя энергия газа в одном сосуде, на столько уменьшится в другом.
- Вообще говоря, давление и температуру газа можно измерять только в состоянии термодинамического равновесия, когда давление и температура во всех точках сосуда одинаковы. Но бывают ситуации, когда давление одинаково во всех точках, а температура нет. Это может быть следствием разной концентрации молекул в разных частях сосуда (проанализируйте формулу: p = nkT).
- Иногда приходится в задачах по термодинамике использовать знания из механики.
Расчет КПД циклов по графику
К оглавлению. ..
..
Задачи данной темы по праву считаются одними из самых сложных задач в термодинамике. Итак, для решения Вам придется, во-первых, перевести график процесса в p(V) – координаты. Во-вторых, надо рассчитать работу газа за цикл. Полезная работа равна площади фигуры внутри графика циклического процесса в координатах p(V). В-третьих, необходимо разобраться, где газ получает, а где отдает теплоту. Для этого вспомните первое начало термодинамики. Внутренняя энергия идеального газа зависит только от его температуры, а работа – от объема. Поэтому, газ получает теплоту, если:
- Увеличиваются и его температура, и объем;
- Увеличивается объем, а температура постоянна;
- Увеличивается температура, а объем постоянен.
Газ отдает теплоту, если:
- Уменьшаются и его температура, и объем;
- Уменьшается объем, а температура постоянна;
- Уменьшается температура, а объем постоянен.

Если один из параметров увеличивается, а другой уменьшается, для того, чтобы понять, отдает газ теплоту или получает ее, необходимо «в лоб» по первому началу термодинамики рассчитать теплоту и посмотреть на ее знак. Положительная теплота – газ ее получает. Отрицательная – отдает.
Первый тип задач. В p(V) – координатах график цикла представляет собой фигуру с легко вычисляемой площадью, и газ получает теплоту в изохорных и изобарных процессах. Применяйте формулу:
Обратите внимание, что в знаменателе стоит только теплота, полученная газом за один цикл, то есть теплота только в тех процессах, в которых газ получал ее.
Второй тип задач. В p(V) – координатах график цикла представляет собой фигуру с легко вычисляемой площадью, и газ отдает теплоту в изохорных и изобарных процессах. Применяйте формулу:
Обратите внимание, что в знаменателе стоит только теплота, отданная газом за один цикл, то есть теплота только в тех процессах, в которых газ отдавал ее.
Третий тип задач. Газ получает теплоту не в удобных для расчета изохорных или изобарных процессах, в цикле есть изотермы или адиабаты, или вообще «никакие» процессы. Применяйте формулу:
Свойства паров. Влажность
К оглавлению…
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно–кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, то есть к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, т.е. число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, это значит, что скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Насыщенный пар имеет максимальные: давление, концентрацию, плотность при данной температуре. Они зависят только от температуры насыщенного пара, но не от его объема.
Это означает, что если бы мы сосуд закрыли не крышкой, а поршнем, и после того, как пар стал насыщенным, стали бы его сжимать, то давление, плотность и концентрация пара не изменились бы. Если быть более точным, то давление, плотность и концентрация на небольшое время увеличились бы, и пар стал бы перенасыщенным. Но сразу же часть пара превратилась бы в воду, и параметры пара стали бы прежними. Если поднять поршень, то пар перестанет быть насыщенным. Однако за счёт испарения через некоторое время снова станет насыщенным. Здесь следует учесть, что если воды на дне сосуда нет или её немного, то это испарение может оказаться недостаточным, чтобы пар снова стал насыщенным.
Но сразу же часть пара превратилась бы в воду, и параметры пара стали бы прежними. Если поднять поршень, то пар перестанет быть насыщенным. Однако за счёт испарения через некоторое время снова станет насыщенным. Здесь следует учесть, что если воды на дне сосуда нет или её немного, то это испарение может оказаться недостаточным, чтобы пар снова стал насыщенным.
- Фраза: «В закрытом сосуде с водой…» – означает, что над водой насыщенный пар.
- Выпадение росы означает, что пар становится насыщенным.
Абсолютной влажностью ρ называют количество водяного пара, содержащегося в 1 м3 воздуха (т.е. просто плотность водяных паров; из уравнения Клапейрона-Менделеева выражается отношение массы к объему и получается следующая формула):
где: р – парциальное давление водяного пара, М – молярная масса, R – универсальная газовая постоянная, Т – абсолютная температура. Единица измерения абсолютной влажности в СИ [ρ] = 1 кг/м3, хотя обычно используют 1 г/м3.
Относительной влажностью φ называется отношение абсолютной влажности ρ к тому количеству водяного пара ρ0, которое необходимо для насыщения 1 м3 воздуха при данной температуре:
Относительную влажность можно также определить как отношение давления водяного пара р к давлению насыщенного пара р0 при данной температуре:
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (то есть давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100°С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. Важно знать, что температура кипения жидкости зависит от давления. В герметически закрытом сосуде жидкость кипеть не может, т.к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром.
Поверхностное натяжение
К оглавлению…
Молекулы вещества в жидком состоянии расположены почти вплотную друг к другу. В отличие от твердых кристаллических тел, в которых молекулы образуют упорядоченные структуры во всем объеме кристалла и могут совершать тепловые колебания около фиксированных центров, молекулы жидкости обладают большей свободой. Каждая молекула жидкости, также как и в твердом теле, «зажата» со всех сторон соседними молекулами и совершает тепловые колебания около некоторого положения равновесия. Однако, время от времени любая молекула может скачком переместиться в соседнее вакантное место. Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
Вследствие плотной упаковки молекул сжимаемость жидкостей, то есть изменение объема при изменении давления, очень мала; она в десятки и сотни тысяч раз меньше, чем в газах.
Наиболее интересной особенностью жидкостей является наличие свободной поверхности. Жидкость, в отличие от газов, не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела, которая находится в особых условиях по сравнению с остальной массой жидкости. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости (силами, действующими на данную молекулу жидкости со стороны молекул газа (или пара) можно пренебречь). В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил ΔAвнеш, пропорциональную изменению ΔS площади поверхности.
В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил ΔAвнеш, пропорциональную изменению ΔS площади поверхности.
Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия Ep поверхности жидкости пропорциональна ее площади:
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости на единицу при постоянной температуре. В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
Из механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии (любое тело всегда стремится скатиться с горы, а не забраться на нее). Отсюда следует, что свободная поверхность жидкости стремится сократить свою площадь. По этой причине свободная капля жидкости принимает шарообразную форму. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения. Наличие сил поверхностного натяжения делает поверхность жидкости похожей на упругую растянутую пленку. Сила поверхностного натяжения, действующая на участок границы жидкости длиной L вычисляется по формуле:
Таким образом, коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения, действующей на единицу длины линии, ограничивающей поверхность.
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. При этом высота столба жидкости в капилляре:
где: r – радиус капиляра (т.е. тонкой трубки). При полном смачивании θ = 0°, cos θ = 1. В этом случае высота столба жидкости в капилляре станет равной:
При полном несмачивании θ = 180°, cos θ = –1 и, следовательно, h < 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
Парообразование
Пользователи также искали:
испарение это парообразование, которое,
парообразование это процесс перехода вещества из,
парообразование физика формула,
парообразование физика,
парообразование формула,
парообразование и конденсация,
парообразование на графике,
парообразование виды,
Парообразование,
парообразование,
физика,
формула,
парообразование формула,
парообразование виды,
парообразование физика формула,
парообразование на графике,
парообразование и конденсация,
которое,
виды,
процесс,
перехода,
вещества,
графике,
испарение,
конденсация,
парообразование физика,
испарение это парообразование которое,
парообразование это процесс перехода вещества из,
термодинамика. парообразование,
парообразование,
…
Удельное парообразование воды таблица. Скрытая теплота парообразования
Кипение – это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности, но и внутри неё.
Кипение происходит с поглощением теплоты.
Большая часть подводимой теплоты расходуется на разрыв связей между частицами вещества, остальная часть – на работу, совершаемую при расширении пара.
В результате энергия взаимодействия между частицами пара становится больше, чем между частицами жидкости, поэтому внутренняя энергия пара больше, чем внутренняя энергия жидкости при той же температуре.
Количество теплоты, необходимое для перевода жидкости в пар в процессе кипения можно расчитать по формуле:
где m – масса жидкости (кг),
L – удельная теплота парообразования.
Удельная теплота парообразования показывает, какое количество теплоты необходимо, чтобы превратитъ в пар 1 кг данного вещества при температуре кипения. Единица удельной теплоты парообразования в системе СИ:
Единица удельной теплоты парообразования в системе СИ:
[ L ] = 1 Дж/ кг
С ростом давления температура кипения жидкости повышается, а удельная теплота парообразования уменьшается и наоборот.
Во время кипения температура жидкости не меняется.
Температура кипения зависит от давления, оказываемого на жидкость.
Каждое вещество при одном и том же давлении имеет свою температуру кипения.
С увеличением атмосферного давления кипение начинается при более высокой температуре, при уменьшении давления – наоборот..
Так, например, вода кипит при 100 °С лишь при нормальном атмосферном давлении.
ЧТО ЖЕ ПРОИСХОДИТ ВНУТРИ ЖИДКОСТИ ПРИ КИПЕНИИ?
Кипение представляет собой переход жидкости в пар с непрерывным образованием и ростом в жидкости пузырьков пара, внутрь которых происходит испарение жидкости. В начале нагревания вода насыщена воздухом и имеет комнатную температуру. При нагревании воды, растворенный в ней газ выделяется на дне и стенках сосуда, образуя воздушные пузырьки. Они начинают появляться задолго до кипения. В эти пузырьки испаряется вода. Пузырек, наполненный паром, при достаточно высокой температуре начинает раздуваться.
Они начинают появляться задолго до кипения. В эти пузырьки испаряется вода. Пузырек, наполненный паром, при достаточно высокой температуре начинает раздуваться.
Достигнув определенных размеров он отрывается от дна, поднимается к поверхности воды и лопается. При этом пар покидает жидкость. Если вода прогрета недостаточно, то пузырек пара, поднимаясь в холодные слои, схлопывается. Возникающие при этом колебания воды приводят к появлению во всем объеме воды огромного количества мелких пузырьков воздуха: так называемый “белый ключ”.
На воздушный пузырек объемом на дне сосуда действует подъемная сила:
Fпод = Fархимеда – Fтяжести
Пузырек прижат ко дну, поскольку на нижнюю поверхность силы давления не действуют. При нагреве пузырек увеличивается за счет выделения в него газа и отрывается от дна, когда подъемная сила будет немного больше прижимающей. Размер пузырька, способного оторваться от дна, зависит от его формы. Форма пузырьков на дне определяется смачиваемостью дна сосуда.
Неоднородность смачивания и слияние пузырьков на дне приводили к увеличению их размеров. При больших размерах пузырька при подъеме сзади него образуются пустоты, разрывы и завихрения.
Когда пузырек лопается, вся окружающая его жидкость устремляется внутрь, и возникает кольцевая волна. Смыкаясь, она выбрасывает вверх столбик воды.
При схлопывании лопающихся пузырьков в жидкости распространяются ударные волны ультразвуковых частот, сопровождаемые слышимым шумом. Для начальных стадий кипения характерны самые громкие и высокие звуки (на стадии “белого ключа” чайник “поет”).
(источник: virlib.eunnet.net)
ТЕМПЕРАТУРНЫЙ ГРАФИК ИЗМЕНЕНИЯ АГРЕГАТНЫХ СОСТОЯНИЙ ВОДЫ
ЗАГЛЯНИ НА КНИЖНУЮ ПОЛКУ!
ИНТЕРЕСНО
Зачем в крышке чайника делают дырочку?
Для выхода пара. Без дырочки в крышке пар может выплеснуть воду через носик чайника.
___
Продолжительность варки картофеля, начиная с момента кипения, не зависит от мощности нагревателя. Продолжительность определяется временем пребывания продукта при температуре кипения.
Продолжительность определяется временем пребывания продукта при температуре кипения.
Мощность нагревателя не влияет на температуру кипения, а влияет только на скорость испарения воды.
Кипением можнозаставить воду замерзнуть. Для этого надо производить откачку воздуха и водяного пара из сосуда, где находится вода, так, чтобы вода все время кипела.
«Горшки легко закипают через край – к ненастью!»
Падение атмосферного давления, сопровождающее ухудшение погоды, является причиной того, что молоко быстрее «убегает».
___
Очень горячий кипяток можно получить на дне глубоких шахт, где давление воздуха значительно больше, чем на поверхности Земли. Так на глубине 300 м вода закипит при 101 ͦ С. При давлении воздуха в 14 атмосфер вода закипает при 200 ͦ С.
Под колоколом воздушного насоса можно получить «кипяток» при 20 ͦ С.
На Марсе мы пили бы «кипяток» при 45 ͦ С.
Соленая вода кипит при температуре выше 100 ͦ C.
___
В горных районах на значительной высоте при пониженном атмосферном давлении вода кипит при температурах ниже, чем 100 ͦ Цельсия.
Ждать, пока сварится такой обед, приходится дольше.
Польем холодненькой… и закипит!
Обычно вода кипит при 100 градусах Цельсия. Нагреем воду в колбе на горелке до кипения. Погасим горелку. Вода перестает кипеть. Закроем колбу пробкой и начнем осторожно лить на пробку струйкой холодную воду. Каково? Вода опять закипела!
…………………………Под струей холодной воды водичка в колбе, а вместе с ней и водяные пары начинают остывать.
Объем паров уменьшается, и давление над поверхностью воды меняется…
А как ты думаешь, в какую сторону?
… Температура кипения воды при пониженном давлении меньше 100 градусов, и вода в колбе вскипает вновь!
____
При приготовлении пищи давление внутри кастрюли – “скороварки” – около 200 кПа, и суп в такой кастрюле сварится значительно быстрее.
Можно набрать в шприц воду примерно до половины, закрыть той же пробочкой и резко потянуть за поршень. В воде возникнет масса пузырьков, говорящих, что начался процесс кипения воды (и это при комнатной температуре!).
___
При переходе вещества в газообразное состояние его плотность уменьшается примерно в 1000 раз.
___
У первых электрочайников нагреватели находились под донышком. Вода не вступала в контакт с нагревателем и закипала очень долго. В 1923 году Артур Лардж сделал открытие: он поместил нагреватель в особую медную трубку и поместил её внутрь чайника. Вода быстро закипала.
В США разработаны самоохлаждающиеся банки для прохладительных напитков. В банку вмонтирован отсек с легкокипящей жидкостью. Если в жаркий день раздавить капсулу, жидкость начнет бурно кипеть, отнимая тепло у содержимого банки, и за 90 секунд температура напитка понижается на 20–25 градусов Цельсия.
НУ, ПОЧЕМУ ЖЕ?
А как ты думаешь, можно ли сварить яйцо вкрутую, если вода закипает при температуре ниже, чем 100 градусов Цельсия?
____
Будет ли кипеть вода в кастрюле, которая плавает в другой кастрюле с кипящей водой?
Почему?
___
Можно ли заставить кипеть воду, не нагревая ее?
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием . Парообразование может осуществляться в виде двух процессов: и.
Парообразование может осуществляться в виде двух процессов: и.
Кипение
Второй процесс парообразования – кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют . Температуру, при которой жидкость кипит, называют температурой кипения .
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
На рисунке приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АВ), кипения (ВС), нагревания пара (CD), охлаждения пара (DE), конденсации (EF) и последующего охлаждения (FG).
Удельная теплота парообразования
Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельная теплота парообразования (L ) — это величина, равная отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования – [L ] = Дж/кг.
Чтобы рассчитать количество теплоты Q, которое необходимо сообщить веществу массой тп для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования (L ) умножить на массу вещества: Q = Lm.
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.
Удельная теплоемкость
Удельная
теплоемкость – это количество тепла
в Джоулях (Дж), необходимое для повышения
температуры вещества. Удельная
теплоемкость является функцией
температуры. Для газов необходимо
проводить различие между удельной
теплоемкостью при постоянном давлении
и при постоянном объеме.
Удельная
теплоемкость является функцией
температуры. Для газов необходимо
проводить различие между удельной
теплоемкостью при постоянном давлении
и при постоянном объеме.
Удельная теплота плавления
Удельная теплота плавления твердого вещества – это количество тепла в Дж, необходимое для перевода 1 кг вещества из твердого состояния в жидкое при температуре плавления.
Скрытая теплота парообразования
Скрытая
теплота парообразования жидкости –
это количество тепла в Дж, необходимое
для испарения 1 кг жидкости при
температуре кипения. Скрытая теплота
парообразования сильно зависит от
давления. Пример: если к емкости,
содержащей 1 кг воды при 100С
(на уровне моря) подвести тепло, вода
поглотит 1023 кДж скрытого тепла без
какого-либо изменения в показаниях
термометра. Однако, произойдет изменение
агрегатного состояния из жидкости в
пар. Поглощенное водой тепло называется
скрытой теплотой парообразования.
Пар сохранит 1023 кДж, поскольку
эта энергия требовалась для изменения
агрегатного состояния.
Скрытая теплота конденсации
При обратном процессе, когда тепло отводится от 1 кг водяного пара при 100С (на уровне моря), пар выделит 1023 кДж тепла без изменения в показаниях термометра. Однако, произойдет изменение агрегатного состояния из пара в жидкость. Поглощенное водой тепло называется скрытой теплотой конденсации.
Температура и давление
Тепловые измерения
Температура,
или ИНТЕНСИВНОСТЬ тепла, измеряется
термометром. Большинство значений
температуры в данном руководстве
приводятся в градусах Цельсия (С),
однако иногда используются и градусы
Фаренгейта (F).
Значение температуры говорит только
об интенсивности тепла или о ЯВНОМ
ТЕПЛЕ, а не о действительном количестве
тепла. Комфортная температура для
человека находится в пределах от 21 до
27С. В этом диапазоне
температур человек чувствует себя
наиболее комфортно. Когда любая
температура выше или ниже этого
диапазона, человек воспринимает это
как теплое или холодное. В науке
существуют понятие «абсолютный ноль» –
температура, при которой от тела отведено
все тепло. Температура
абсолютного нуля определяется как
–273°C. Любое вещество при температуре
выше абсолютного нуля содержит некоторое
количество тепла. Для понимания
основ кондиционирования воздуха также
необходимо понимать связь между
давлением, температурой и агрегатным
состоянием. Наша планета окружена
воздухом, иначе говоря газом. Давление
в газе передается во всех направлениях
одинаково. Окружающий нас газ состоит
на 21% из кислорода и на 78% из азота.
Остающийся 1% занимают другие редкие
газы. Эта комбинация газов называется
атмосферой. Она простирается на
несколько сотен километров над
земной поверхностью и удерживается
силой гравитации. На уровне моря
атмосферное давление составляет 1,0
бар, а точка кипения воды – 100С.
В любой точке выше уровня моря
атмосферное давление ниже, а также ниже
температура кипения воды. При
понижении давления до 0,38 бар, температура
кипения воды составляет 75С,
а при давлении 0,12 бар – 50С.
В науке
существуют понятие «абсолютный ноль» –
температура, при которой от тела отведено
все тепло. Температура
абсолютного нуля определяется как
–273°C. Любое вещество при температуре
выше абсолютного нуля содержит некоторое
количество тепла. Для понимания
основ кондиционирования воздуха также
необходимо понимать связь между
давлением, температурой и агрегатным
состоянием. Наша планета окружена
воздухом, иначе говоря газом. Давление
в газе передается во всех направлениях
одинаково. Окружающий нас газ состоит
на 21% из кислорода и на 78% из азота.
Остающийся 1% занимают другие редкие
газы. Эта комбинация газов называется
атмосферой. Она простирается на
несколько сотен километров над
земной поверхностью и удерживается
силой гравитации. На уровне моря
атмосферное давление составляет 1,0
бар, а точка кипения воды – 100С.
В любой точке выше уровня моря
атмосферное давление ниже, а также ниже
температура кипения воды. При
понижении давления до 0,38 бар, температура
кипения воды составляет 75С,
а при давлении 0,12 бар – 50С. Если на точку кипения воды влияет
уменьшение давления, логично предположить,
что увеличение давления также на нее
повлияет. Пример – пароварочный
котел!
Если на точку кипения воды влияет
уменьшение давления, логично предположить,
что увеличение давления также на нее
повлияет. Пример – пароварочный
котел!
Дополнительная информация: как перевести градусы Фаренгейта в градусы Цельсия и наоборот: C = 5/9 × (F – 32). F = (9/5 × C)+32. Кельвин = C + 273. Ренкин = F + 460.
Кипение, как мы видели, тоже испарение, только сопровождается оно быстрым образованием и ростом пузырьков пара. Очевидно, что во время кипения необходимо подводить к жидкости определённое количество теплоты. Это количество теплоты идёт на образование пара. Причём различные жидкости одной и той же массы требуют разное количество теплоты для обращения их в пар при температуре кипения.
Опытами было установлено, что для испарения воды массой 1 кг при температуре 100 °С требуется 2,3 10 6 Дж энергии. Для испарения эфира массой 1 кг, взятого при температуре 35 °С, необходимо 0,4 10 6 Дж энергии.
Следовательно, чтобы температура испаряющейся жидкости не изменялась, к жидкости необходимо подводить определённое количество теплоты.
Физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры, называется удельной теплотой парообразования.
Удельную теплоту парообразования обозначают буквой L. Её единица – 1 Дж/кг.
Опытами установлено, что удельная теплота парообразования воды при 100 °С равна 2,3 10 6 Дж/кг. Иными словами, для превращения воды массой 1 кг в пар при температуре 100 °С требуется 2,3 10 6 Дж энергии. Следовательно, при температуре кипения внутренняя энергия вещества в парообразном состоянии больше внутренней энергии такой же массы вещества в жидком состоянии.
Таблица 6.
Удельная теплота парообразования некоторых веществ (при температуре кипения и нормальном атмосферном давлении)
Соприкасаясь с холодным предметом, водяной пар конденсируется (рис. 25). При этом выделяется энергия, поглощённая при образовании пара. Точные опыты показывают, что, конденсируясь, пар отдаёт то количество энергии, которое пошло на его образование.
Рис. 25. Конденсация пара
Следовательно, при превращении 1 кг водяного пара при температуре 100 °С в воду той же температуры выделяется 2,3 10 6 Дж энергии. Как видно из сравнения с другими веществами (табл. 6), эта энергия довольно велика.
Освобождающаяся при конденсации пара энергия может быть использована. На крупных тепловых электростанциях отработавшим в турбинах паром нагревают воду.
Нагретую таким образом воду используют для отопления зданий, в банях, прачечных и для других бытовых нужд.
Чтобы вычислить количество теплоты Q, необходимое для превращения в пар жидкости любой массы, взятой при температуре кипения, нужно удельную теплоту парообразования L умножить на массу m:
Из этой формулы можно определить, что
m = Q / L, L = Q / m
Количество теплоты, которое выделяет пар массой т, конденсируясь при температуре кипения, определяется по той же формуле.
Пример . Какое количество энергии требуется для превращения воды массой 2 кг, взятой при температуре 20 °С, в пар? Запишем условие задачи и решим её.
Вопросы
- На что расходуется энергия, подводимая к жидкости при кипении?
- Что показывает удельная теплота парообразования?
- Как можно показать на опыте, что при конденсации пара выделяется энергия?
- Чему равна энергия, выделяемая водяным паром массой 1 кг при конденсации?
- Где в технике используют энергию, выделяемую при конденсации водяного пара?
Упражнение 16
- Как надо понимать, что удельная теплота парообразования воды равна 2,3 10 6 Дж/кг?
- Как надо понимать, что удельная теплота конденсации аммиака равна 1,4 10 6 Дж/кг?
- У какого из приведённых в таблице 6 веществ при обращении из жидкого состояния в пар внутренняя энергия увеличивается больше? Ответ обоснуйте.
- Какое количество энергии требуется для обращения воды массой 150 г в пар при температуре 100 °С?
- Какое количество энергии нужно затратить, чтобы воду массой 5 кг, взятую при температуре 0 °С, довести до кипения и испарить её?
- Какое количество энергии выделит вода массой 2 кг при охлаждении от 100 до 0 °С? Какое количество энергии выделится, если вместо воды взять столько же пара при 100 °С?
Задание
- По таблице 6 определите, у какого из веществ при обращении из жидкого состояния в пар внутренняя энергия увеличивается сильнее. Ответ обоснуйте.
- Подготовьте доклад на одну из тем (по выбору).
- Как образуется роса, иней, дождь и снег.
- Круговорот воды в природе.
- Литьё металлов.
Влияние давления парообразования – Справочник химика 21
Влияние давления парообразования и давления окружаю- [c.3]ВЛИЯНИЕ ДАВЛЕНИЯ ПАРООБРАЗОВАНИЯ [c.36]
Влияние давления в системе. Во всех случаях увеличение давления сдвигает кривую плотности теплового потока д от перегрева стенкн влево (рис. 7). При очень малых значениях приведенного давления (р,-пузырькового кипения может быть ограничена. Пузырьковое кипение не возникает до тех пор, пока не достигаются относительно большие перегревы стенки, соответствующие умеренным тепловым потокам. В то же время критический тепловой поток снижается с уменьшением давления системы. При некотором очень низком давлении начало парообразования приводит к возникновению кризиса и область пузырькового кипения исчезает (рис. 8). [c.373]
Формула Нернста. Формула Нернста менее точна, чем уравнение Клапейрона, так как в ней не учитывается влияние давления на скрытую теплоту парообразования. Преимуществом формулы Нернста являет ся то, что для вычисления с ее помощью нужно знать только температуру кипеиия жидкости при атмосферном давлении. [c.102]
Влияние давления. Кривые рис. 25 и 26 показывают, что требуемая величина перегрева стенки (Га,—Т ) меньше для более высоких давлений. Это положение можно объяснить с помощью уравнения (5). Данная поверхность имеет определенную кривую распределения размера углублений (рис. 27). Для получения заданного теплового потока д А согласно уравнению (18) требуется, чтобы действовало определенное число центров парообразования п таким образом, величина перегрева должна быть такой, чтобы сделать активными центрами парообразования углубления радиусом г. Если принять величину г постоянной, то с ростом давления правая часть уравнения (5) уменьшается, а следовательно, требуется и меньший перегрев поверхности поэтому кривые, соответствующие большему давлению, на рис. 25 и 26 расположены левее. [c.233]
Влияние давления. С увеличением давления число действующих центров парообразования увеличивается и при кипении в большом объеме а растет. Незначительное количество экспериментов по кипению в пленке не дает возможности получить однозначное выражение для зависимости а от давления, тем более, что влияние давления значительно сложнее, так как с изменением давления насыщения меняются теплофизические свойства жидкостей, влияющие на теплоотдачу. Возрастание а с увеличением давления отмечено при кипении в восходящем потоке [204]. При [c.123]
При этом период собственных колебаний газового пузырька равен величине порядка 10 [85]. Следовательно, видно, что время, в течение которого пузырек пересекает кавитационную зону, больше периода его собственных колебаний как в натуре, так и на моделях. Таким образом, видно, что скорости потока не оказывают заметного влияния на величину критического давления парообразования. [c.213]
При низких давлениях это влияние незначительно, и им обычно пренебрегают. При высоких давлениях влияние давления на теплоту парообразования велико, поэтому необходимо внести соответствующую поправку. С повышением давления теплота парообразования, как и при повышении температуры, уменьшается. Изменение теплоты парообразования углеводородных газов в зависимости от давления показано на рис. 21. [c.83]
А сейчас давайте рассмотрим разрывность кривых объема, связанную с фазовыми изменениями различных видов. Простейшим примером является влияние давления на плавление. Исторически изучение влияния давления на плавление было связано с тем, что ожидаемый эффект должен быть аналогичен влиянию давления на парообразование. В частности, ожидалось, что должны быть некоторые критические явления, такие, что при превышении определенных значений давления и температуры возможен непрерывный переход между жидким и твердым состояниями вещества. Однако вскоре стало ясно, что шкала давлений для подобных явлений должна находиться гораздо выше шкалы критических явлений между жидкостью и газом. Например, если в последнем случае достаточными были давления в несколько сотен кг/слР, то для наблюдения подобных явлений (если они вообще возможны) между жидким и твердым состояниями вещества требуются давления в несколько тысяч кг/слР. При каждом расширении диапазона давления вероятность существования таких критических явлений сильно уменьшается. К настоящему моменту построены кривые плавления в диапазоне до 40 000 кг/сл – некоторые из них показаны на рис. 8. Кривые плавления всех веществ имеют определенные общие качественные черты, поэтому здесь настолько же уместно говорить о кривой плавления, насколько допустимо говорить о кривой парообразования. Однако в других отношениях ситуация с плавлением качественно отличается от ситуации с парообразованием. В частности, все кривые плавления, т.е. кривые зависимости температуры плавления от давления, вогнуты относительно оси давления, и их кривизна уменьшается при увеличении давления. И кривая разности между объемами жидкого и твердого со- [c.138]
Теплота парообразования малоисследованного вещества вычисляется по критерию Кп, а корректирующие члены, определяющие влияние давления реального газа (Дг = = — о и Аз = 5—5о) — по Л 12 И Кхд. [c.88]
Рис 39 Влияние давления на скрытую теплоту парообразования (до 10 атм) [c.119]
Первый закон Вревского гласит при повышении температуры раствора заданного состава его пар обогащается тем компонентом, для которого больше дифференциальная теплота парообразования . Второй закон Вревского определяет влияние изменения температуры и давления на состав систем, имеющих экстремум давления и температуры если давление (температура) системы рас- [c.288]
На величину теплоты плавления и испарения значительное влияние оказывают температура и давление, при которых происходит это превращение. Так как с газами, находящимися в твердом состоянии, практически не приходится иметь дело, рассмотрим влияние указанных факторов на теплоту парообразования, являющегося важной характеристикой, в частности, для жидкого газа. [c.94]
Изложенное выше влияние температуры на теплоту парообразования рассмотрено для случая, когда испарение происходит под внешним давлением, равным давлению насышенного пара кипящей жидкости (упругости насыщенных паров), т. е. для случая двухфазного состояния индивидуального вещества (например, чистого пропана). Однако, когда имеется сложная или даже двухкомпонентная смесь (например, пропана и бутана), вступает в силу закон Дальтона, когда общее давление превышает упругость паров каждого компонента. При этом на теплоту парообразования значительное влияние оказывает второй фактор —давление. [c.96]
Теплота испарения. Также как теплопроводность и теплоемкость, оказывает косвенное влияние на скорость испарения топлив. При значительной теплоте парообразования температура топлива заметно понижается и скорость испарения уменьшается. Теплота испарения зависит от давления и для углеводородов и нефтепродуктов уменьшается с увеличением молекулярной массы и температуры кипения (табл. 11). При прочих равных условиях теплота испарения уменьшается при переходе от непредельных углеводородов и аренов к цикланам и алканам. Повышенная теплота испарения непредельных и аренов объясняется их ассоциацией. Разность [c.36]
Профос [7] также пренебрегает влиянием этой обратной связи. Свои рассуждения он основывает на так называемом виртуальном парообразовании, т. е. имеет в виду количество пара, которое образовалось бы при постоянном давлении. [c.352]
Вопросы влияния молекулярной ассоциации в парах имеют существенное значение не только для вычисления парциальных давлений компонентов и суммарного давления, но и для расчетов энтальпии парообразования мономерных и ассоциированных частиц. Несмотря на значительное количество работ (среди которых можно привести, например, работы [65, 66, 119-121] и др.), затрагивающих в той или иной степени вопросы образования в парах молекулярных ассоциатов, необходимо рассмотреть влияние последних на давление пара и рассчитываемые из него значения энтальпии парообразования, а также на величины ДЯ о, измеряемые калориметрическими методами. [c.87]
Если на участке всасывания лопастного насоса абсолютное давление перекачиваемой жидкости окажется ниже давления насыщенных паров этой жидкости при данной температуре, внутри жидкости начнут образовываться пузырьки пара. При дальнейшем движении жидкости внутри насоса давление ее начинает повышаться и пузырьки подвергаться сжатию. Под влиянием сжатия происходит конденсация пара частицы жидкости, стремясь заполнить освобождающийся объем, с большой скоростью ударяются друг о друга. При этом в жидкости возникают местные ударные давления, достигающие нескольких сотен атмосфер. Явление парообразования с последующим захлопыванием пузырьков -при выносе их в зону повышенного давления носит название кавитации. В лопастном насосе кавитация вызывает шум, сотрясение установки, нагрев жидкости. Частицы жидкости, ударяясь не только одна о другую, но и об элементы насоса, вызывают местные разрушения металла (эрозию), а выделившиеся из жидкости при кавитации газы способствуют коррозии. При интенсивной кавитации насос может быть выведен из строя в течение нескольких часов работы. По этой причине допускать работу насоса при кавитации нельзя. [c.69]
При низких давлениях это влияние незначительно и нм обычно пренебрегают. Влияние высокого давления на теплоту парообразования значительно, поэтому в расчеты необходимо вносить соответствующую поправку. При повыше-НИИ давления, как и повышении температуры, теплота парообразования уменьшается, Зависимость теплоты парообразования углеводородных газов от давления приведена на рис. 2.14, а теплота испарения в зависимости от температуры кипения =— в табл. 2.29. [c.87]
Во втором случае падение давления в основном носит динамический характер и ограничено зоной небольшой части каналов рабочего колеса. Кроме того, при больших скоростях в рабочем колесе время, необходимое для частиц воды, чтобы пересечь зону низкого давления, является более коротким. Поскольку время является существенным фактором при всех термодинамических изменениях, то относительное развитие парообразования и влияние его на характеристику насоса для высоконапорных насосов менее значительны [22]. [c.250]
Зависимость качества пара от солесодержания котловой воды безусловно существует. Кривые уноса солей фиг. 3 и 7 подтверждают это. Сдвигом в области сравнительно быстрого нарастания уноса в сторону повышенных концентраций нри увеличении давления можно частично объяснить ухудшение качества пара, сопровождающее рост солесодержания котловой воды. Условия парообразования также зависят от солесодержания и состава котловой воды. Но эти физико-химические зависимости не так сильны, чтобы ими можно было оперировать при обосновании резких изменений качества пара, приписываемых влиянию солесодержания котловой воды. [c.67]
При низких давлениях это влияние незначительно и им обычно пренебрегают. Влияние высокого давления на теплоту парообразования значительно, поэтому в расчеты необходимо вносить соответствующую поправку. При повышении давления, как и при повышении температуры, теплота парообразования уменьшается. [c.26]
Более чем для 20 жидких веществ исследовано влияние замещения водорода дейтерием на поляризуемость молекул, мольный объем, критическую температуру, сжимаемость, теплоемкость, давление пара и теплоту парообразования, вязкость, растворимость, осмотические коэффициенты [18]. В частности, подробно изучены специфические изотопные эффекты в свойствах, появляющиеся при замещении дейтерием атомов водорода, образующих водородные связи [19]. [c.6]
Доля, приходящаяся на пар, — Я° может быть вычислена по методам, описанным ранее в этой главе. Слагаемое Я —Я пpeд тaвляeт собой просто —ДЯц и может быть получено с помощью корреляций для определения теплоты парообразования, приведенных в гл, 6. Наконец, Я — учитывает влияние давления на энтальпию жидкости. Обычно эта величина мало связана с другими двумя членами правой части уравнения. Для расчета Я — может быть [c.120]
Скорость убывания давления р с расстоянием уменьшается с увеличением начального радиуса Но, а величина положительного давления увеличивается с увеличением Яо и уменьшением р. Н. Е. Кочин сформулировал задачу о распространении сильного взрыва в жидкости. В случае высоковольтного разряда причиной образования волны давления в основном является ускоренное движение стенки газового пузыря, которому сообщается энергия разряда. Если исходить из предположения о несжимаемости воды вблизи пузыря, то давление в воде зависит от квадрата скорости расширения или сжатия пузыря. Большое влияние на протекание процесса оказывают отраженные волны как повышенного, так и пониженного давлений. Если жидкость подвергается продолжительному действию высокого давления, то образование каверн замедляется и кавитация не возникает даже при уменьшении давления ниже давления парообразования. Появляющиеся при кавитации пузырьки бывают двух видов наполненные газом — воздухом и вакуумные или, точнее, наполненные паром. Наполненные газом пузырьки растут до видимых размеров и затем их размеры остаются стабильными, а пузырьки, наполненные паром, взрывоподобно расширяются. Вода при определенных обстоятельствах оказывает сопротивление растяжению, величина которого достигает примерно 42 кГ1см . Используя эти особенности, в последние годы удалось создать насосы с высотой всасывания, превышающей 10 м. [c.162]
В этот момент практически вся теплота передается от стенки путем испарения в движущийся поток пузырей пара, и основными величинами, определяющими интенсивность теплоотдачи, являются средняя толщина б и эффективная теплопроводность Х. эф пленки жидкости, разделяющей греющую стенку и паровую фазу. Далее при переходе пробкового режима в стержневой механизм теплоотдачи сохраняется неизменным. В этих условиях при сравнительно невысоких д для К12, Н22 и аммиака ( число центров парообразования не оказывает воздействия на интенсивность теплообмена, и характер влияния режимных параметров на а изменяется зависимость а от плотности теплового потока значительно ослабевает, а влияние давления кипения сменяется с прямого на обратное. Изменение шеро соватости стенки в данном случае слабо влияет на а . Зону, где действует вышеописанный механизм теплоотдачи, можно назвать зоной конвективного испарения. [c.170]
Влияние пористой среды на давление начала выделения газа тесно связано с изменением углеводородного состава нефти в капиллярных каналах в результате адсорбции некоторых углеводородов на границах раздела и с зависмостью давления парообразования от смачиваемости поверхности поровых каналов пластовыми жидкостями. [c.102]
Прп ннэких давлениях это влияние незначительно, н нм обычно пренебрегают. При высоких давлениях влияние давления на теплоту парообразования велико, поэтому необходимо внести соответствующую поправку. С повышением давления теплота парообразования, как и при повыщении температуры, уменьшается. [c.121]
Полностью развитое кипение с недогревом. При возникновении кипения действует только ограниченное число центров парообразования, так что часть теплоты передается обычным процессом в однофазной жидкости между пузырями. Эта переходная область названа неразвитым кипением. Когда температура поверхтюсти увеличивается, число центров пузырей возрастает, а площадь, через которую теплота передается к однофазной жидкости, уменьшается. Наконец, вся поверхность покрывается пузырями, кипение становится полностью развитым и однофазная компонента теплоотдачи уменьшается до нуля. Скорость и недогрев, имеющие сильное влияние на теплоотдачу в однофазной жидкости, в области полностью развитого кипения оказывают небольшой эффект или вовсе не влияют на температуру поверхности. При кипении с недогревом температура поверхности зависит в основном от тепловой нагрузки п давления жидкости. Влияние условий на поверхности для кипения при вынужденной конвекции должно быть слабее, чем в большом объеме, потому что высокие тепловые нагрузки и перегревы стенки сдвигают диапазон активных центров парообразования в сторону меньших размеров, которые в действительности имеются на большей части поверхностей. Однако прямых экспериментальных данных, подкрепляющих это утверждение, немного. [c.382]
Анализ экспериментальных данных показал, что, так же как и в работах других исследователей, при высоких скоростях парообразование не влияет на интенсивность теплообмена. В этих условиях на выходном участке тру бы давление заметно изменяется и при постоянных да влениях в аппарате и весовой скорости уменьшается ско рость потока. Это оказывает обратное влияние на про цесс теплообмена. Температурный напор резко не изме няется при переходе из области, где влияние пузырько вого кипения подавляется, в область, где оно существует В табл. 1, приводятся данные опытов, в которых влия ние парообразования подавлялось. [c.32]
Отметим здесь, что теплоты испарения индивидуальных жидко стей необходимы для оценки влияния изменения внешних условий (температуры и давления) на фазовые равновесия жидкость — пар, для составления теплового баланса процессов, решения ряда других технологических задач. В теории жидкостей и растворов энтальпии и энтропии парообразования дают информацию об энергетике межмолекулярных взаимодействий и структуре жидкой фазы. Наиболее полные данные о теплотах испарения жидкостей собраны в приложении к монографии [9] и в справоч ных изданиях, например [10]. Большая часть данных получена на основании изучения температурной зависимости давления пара по уравнениям, родственным уравнению (П.4). [c.25]
На величину коэффициента полезного действия оказывают влияние различные факторы. Важнейшим из них является легкость диффузии при парообразовании, с одной стороны, и конденсации — с другой чем меньше, например, пузырьки, на которые разбивается пар, покидая жидкую фазу, тем больше поверхность соприкосновения жидкой и паровой фаз и тем выше коэффициент полезного действия тарелок. Поэтому устройство и размеры колпачков, форма и размеры прорезов в тарелке, глубина погружения колпачков в жидкость (флегму) крайне важны для повышения коэффициента полезного действия тарелки. Большое влияние оказывает также скорость движения паров в колонне, определяемая их плотностью. При атмосферном давлении скорость паров в колонне может доходить до 0,6 — 0,8 м/сек в вакуумных колоннах скорость паров значительно выше (2—3 м/сек) в колоннах, работаюш их под давлением, наоборот, она может снингаться до 0,1—0,3 м/сек. В прорезах колпачков скорость паров в 5—10 раз больше, чем в свободном сечении колонны. Если скорость двин ения паров при данной их плотности становится слишком большой, то вместе с парами может оказаться увлеченной также и жидкость, так что нормальная работа колонны нарушается. [c.385]
Теплота испарения – Химия LibreTexts
Поскольку молекулы жидкости находятся в постоянном движении и обладают широким диапазоном кинетических энергий, в любой момент у какой-то их части достаточно энергии, чтобы покинуть поверхность жидкости и войти в газ. или паровая фаза. Этот процесс, называемый испарением или испарением, создает давление пара над жидкостью. Теплота испарения (также называемая энтальпией испарения) – это теплота, необходимая для того, чтобы вызвать это фазовое изменение.
Рис. \ (\ PageIndex {1} \): Тепло передает энергию системе, чтобы преодолеть межмолекулярные взаимодействия, которые удерживают жидкость вместе для образования пара.Поскольку испарение требует добавления тепла в систему и, следовательно, является эндотермическим процессом, поэтому \ (\ Delta H_ {vap}> 0 \), как определено:
\ [\ Delta H_ {vap} = H_ {пар} – H_ {жидкость} \]
где
- \ (\ Delta H_ {vap} \) – изменение энтальпии парообразования
- \ (H_ {пар} \) – энтальпия газового состояния соединения или элемента
- \ (H_ {жидкость} \) – энтальпия жидкого состояния соединения или элемента
Тепло поглощается, когда жидкость кипит, потому что молекулы, которые удерживаются вместе за счет межмолекулярных взаимодействий притяжения и отталкиваются друг от друга при образовании газа.Такое разделение требует энергии (в виде тепла). В общем, необходимая энергия отличается от жидкости к жидкости в зависимости от величины межмолекулярных сил. Таким образом, можно ожидать, что жидкости с сильными межмолекулярными силами будут иметь более высокие энтальпии испарения. Список энтальпий испарения, приведенный в Таблице T5, подтверждает это.
Пример \ (\ PageIndex {1} \)
Если жидкость использует 50 джоулей тепла для испарения одного моля жидкости, то какова будет энтальпия испарения?
Решение
Теплота процесса равна изменению энтальпии, которое в данном случае включает испарение
\ [q_ {tot} = \ Delta_ {vap} \]
т.
\ [q_ {tot} = 50 \; J = \ Delta_ {vap} \]
Итак, энтальпия испарения одного моля вещества равна 50 Дж.
Кинетическая энергия не меняется
Кинетическая энергия молекул газа и силикида одинакова, поскольку процесс испарения происходит при постоянной температуре. Однако добавленная тепловая энергия используется для разрушения потенциальной энергии межмолекулярных сил в жидкости, чтобы генерировать молекулы в газе, свободные от потенциальной энергии (для идеального газа). Таким образом, пока \ (H_ {пар}> H_ {жидкость} \), кинетические энергии молекул равны.
Энтальпия конденсации
Конденсация противоположна испарению, и поэтому \ (\ Delta H_ {конденсация} \) также противоположна \ (\ Delta H_ {vap} \).Поскольку \ (\ Delta H_ {vap} \) – это эндотермический процесс, при котором тепло теряется в реакции и должно добавляться в систему из окружающей среды, \ (\ Delta H_ {конденсация} \) – экзотермический процесс, где тепло поглощается в результате реакции и должно отводиться из системы в окружающую среду.
\ [\ begin {align} ΔH_ {конденсация} & = H_ {жидкость} – H_ {пар} \\ [4pt] & = -ΔH_ {vap} \ end {align} \]
Поскольку \ (ΔH_ {конденсация} \), также обозначаемая как \ (ΔH_ {cond} \), является экзотермическим процессом, его значение всегда отрицательно.Более того, \ (ΔH_ {cond} \) по величине равен \ (ΔH_ {vap} \), поэтому единственная разница между двумя значениями для одного данного соединения или элемента – это положительный или отрицательный знак.
Пример \ (\ PageIndex {2} \)
Собирали 2,055 литра пара при 100 ° C и хранили в более холодном контейнере. Какое количество тепла участвовало в этой реакции? \ (ΔH_ {vap} \) воды = 44,0 кДж / моль.
Решение
1. Сначала преобразуйте 100 ° C в Кельвин.{-1}) (373,15 \; K)} \\ [4pt] & = 0,0671 \; mol \ end {align *} \]
3. Найти \ (ΔH_ {cond} \)
\ [ΔH_ {cond} = -ΔH_ {vap} \ nonumber \]
т.
\ [ΔH_ {cond} = -44,0 \; кДж / моль \ nonumber \]
4. Используя \ (ΔH_ {cond} \) воды и количество в молях, рассчитайте количество тепла, участвующего в реакции. Чтобы найти кДж, умножьте \ (ΔH_ {cond} \) на количество в молях.
\ [\ begin {align *} (ΔH_ {cond}) (n_ {water}) & = (-44.0 \; кДж / моль) (0,0671 мкм) \\ [4pt] & = -2,95 \; кДж \ end {align *} \]
Определения терминов
Испарение (или Испарение ) переход молекул из жидкого в газообразное состояние; молекулы на поверхности обычно первыми претерпевают фазовый переход.
- Энтальпия : количество тепла, потребляемого или выделяемого в системе при постоянном давлении
- Кинетическая энергия : энергия движущегося объекта, измеряемая в Джоулях
- Эндотермический : когда в систему добавляется тепло из окружающей среды из-за уменьшения тепла в реакции
- Экзотермический : когда тепло из системы выделяется в окружающую среду из-за увеличения тепла в реакции
- Теплота испарения: количество тепла, необходимое для испарения жидкости
- Система и ее окружение : система – это область, в которой происходит реакция, а окружение – это область, которая взаимодействует с системой
- Конденсация : переход молекул из газообразного или парообразного состояния в жидкое
- Функция состояния (или Функция состояния ): любое свойство, такое как температура, давление, энтальпия или масса, которое имеет уникальное значение или номер для определенного состояния системы
Список литературы
- Петруччи, Ральф Х., Уильям С. Харвуд, Ф. Г. Херринг и Джеффри Д. Мадура. Общая химия: принципы и современные приложения. 9 изд. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2007. 474. .
Авторы и авторство
Теплота испарения – определение, уравнение и тест
Теплота испарения Определение
Также известная как энтальпия испарения, теплота испарения (∆H vap ) определяется количеством необходимой энтальпии (тепловой энергии) превращать жидкое вещество в газ или пар.Он измеряется в Джоулях на моль (Дж / моль) или иногда в калориях (C).
Объяснение теплоты испарения
Теплота испарения всегда имеет положительное значение, потому что энтальпия всегда добавляется к системе для испарения жидкости. По мере того, как молекулы получают больше кинетической энергии, они с большей вероятностью отделяются от жидкости и превращаются в газ.
Требуемое увеличение внутренней энергии можно описать как энергию, необходимую для разрыва межмолекулярных взаимодействий в жидкости.Чем слабее связь между атомами, тем меньше энергии требуется для разрыва этих связей.
Количество требуемой энергии зависит от давления, при котором происходит преобразование, и зависит от температуры. Чем горячее уже жидкость, тем меньше энергии требуется. При более высоком давлении требуется больше энергии. Существует критическая температура, при которой исчезает теплота испарения (T r = 1). После этой критической температуры вещество нельзя различить ни как жидкость, ни как пар.Вместо этого он стал известен как сверхкритическая жидкость .
В растворе, содержащем как жидкое, так и газообразное состояние, кинетическая энергия пара выше, чем у жидкости, потому что частицы пара могут течь легче. Повышенное движение частиц газа по сравнению с частицами жидкости создает тепло и давление.
Формула теплоты испарения
Очень простое уравнение для расчета теплоты испарения:
ΔH пар = H пар – H жидкость
Это вычисляет разницу во внутренней энергии паровая фаза по сравнению с жидкой фазой.
Однако это уравнение не принимает во внимание дополнительную энергию, необходимую для того, чтобы частицы газа отталкивались от атмосферного давления, чтобы учесть увеличение объема при кипении жидкости.
Следовательно, более полное уравнение для расчета теплоты испарения выглядит следующим образом:
ΔH vap = ΔU vap + pΔV
Где ΔU vap – разница во внутренней энергии между паровой фазой и паровой фазой. жидкая фаза (ΔU пар = H пар – H жидкость ), а pΔV – работа, совершаемая против давления окружающей среды.
Теплота испарения воды
Вода имеет высокую удельную теплоемкость . Это измерение описывает количество энергии, необходимое для повышения температуры воды на 1 градус Цельсия. Как таковая вода также имеет высокую теплоту испарения. Фактически, для испарения воды требуется более 40 000 Джоулей на моль. Это чрезвычайно важно для жизни на Земле.
Поскольку большая часть Земли состоит из воды, большие изменения количества солнечной энергии, получаемой Землей, компенсируются водой.Вода медленно поглощает тепло и выделяет тепло, когда мало солнца. Это помогает противостоять резким перепадам температуры, которые могут быть разрушительными для жизни. Для сравнения: если бы мир состоял в основном из этанола, температура бы быстро колебалась, потому что этанол имеет гораздо более низкую теплоту испарения и удельную теплоемкость.
Однако такая высокая теплота испарения может не соответствовать задаче регулирования температуры перед лицом действий человека. Изменение климата и, в частности, глобальное потепление сильно нагревают атмосферу. Хотя океан может поглотить большую часть этого тепла, у него есть пределы. Далее, когда океан поглощает тепло, молекулы расширяются. Это расширение приведет к большей части наводнений, которые в настоящее время оцениваются учеными-климатологами.
Различия в теплоте испарения
Основное влияние на теплоту испарения оказывают взаимодействия между молекулами в растворе. В жидкости молекулы движутся мимо друг друга, но постоянно взаимодействуют. Некоторые образуют водородных связей , в то время как другие вещества образуют другие типы мягких связей между молекулами.Эти связи содержат энергию и удерживают жидкость в более низком энергетическом состоянии. Теплота испарения описывает, сколько энергии необходимо для разделения этих связей.
Вода имеет высокую теплоту испарения, потому что водородные связи легко образуются между кислородом одной молекулы и атомами водорода других молекул. Эти связи удерживают молекулы вместе. Чтобы вода испарилась, вы должны повысить температуру, чтобы молекулы двигались быстрее. В определенный момент молекулы начнут отрываться от жидкости и испаряться.
Металлы имеют еще более высокую теплоту испарения. Многие металлы образуют сложные взаимодействия с атомами других металлов. Это удерживает молекулы вместе даже крепче, чем молекулы воды. Таким образом, теплота испарения металлов намного выше, чем у воды.
Тест
ChemTeam: Молярное тепло испарения
ChemTeam: молярная теплота испаренияМолярная теплота испарения
Вернуться к файлу графика времени-температуры
Вернуться в меню термохимии
Вот определение молярной теплоты парообразования:
количество тепла, необходимое для кипения (или конденсации) 1.00 моль вещества при его температуре кипенияОбратите внимание на два важных фактора:
1) Это 1,00 моль вещества
2) нет изменения температуры
Имейте в виду, что это очень конкретное значение. Это всего лишь на один моль кипящего вещества. Молярная теплота испарения является важной частью расчетов энергии, поскольку она показывает, сколько энергии необходимо для кипячения каждого моля имеющегося вещества. (Или, если мы охлаждаем вещество, сколько энергии на моль нужно удалить из вещества при его конденсации.)
Каждое вещество имеет свою молярную теплоту испарения.
Единицами для молярной теплоты испарения являются килоджоули на моль (кДж / моль). Иногда используется единица Дж / г. В этом случае это называется теплотой испарения, при этом термин «молярный» исключен.
Молярная теплота испарения воды составляет 40,7 кДж / моль. Чтобы получить теплоту испарения, просто разделите молярную теплоту на 18,015 г / моль. См. Пример № 3 ниже.
Значения молярной теплоты можно найти в справочниках.
Уравнение молярной теплоты парообразования выглядит следующим образом:
q = (ΔH vap ) (масса / молярная масса)
Значения следующие:
1) q – общее количество вовлеченного тепла
2) ΔH vap – символ молярной теплоты парообразования. Это значение является постоянным для данного вещества.
3) (масса / молярная масса) – деление количества молей вещества.
Пример № 1 49,5 г H 2 O кипятят при температуре кипения 100 ° C.Сколько кДж требуется?
Решение:
подставьте соответствующие значения в уравнение молярной теплопроводности, показанное вышеq = (40,7 кДж / моль) (49,5 г / 18,0 г / моль)
Пример № 2: 80,1 г H 2 O существует в виде газа при 100 ° C. Сколько кДж нужно удалить, чтобы вода превратилась в жидкость при 100 ° C
Решение:
обратите внимание, что вода конденсируется. Значение молярной теплоты испарения используется при фазовом переходе твердое тело-жидкость, НЕЗАВИСИМО от направления (кипение или конденсация).q = (40,7 кДж / моль) (80,1 г / 18,0 г / моль)
Пример № 3: Вычислить теплоту испарения воды в Дж / г
Решение:
разделите молярную теплоту испарения (выраженную в Джоулях) на массу одного моля воды.(40700 Дж / моль) / (18,015 г / моль) = 2259 Дж / г
Вы можете увидеть использованное значение 2257 Дж / г. Это является результатом использования 40,66 кДж / моль, а не 40,7 кДж / моль. Автор часто использует значение, которое он использовал в студенческие годы.Просто имейте в виду, что ни одно из значений не является неправильным, они возникают из-за различного выбора доступных значений.
Пример № 4: Используя теплоту испарения воды в Дж / г, рассчитайте энергию, необходимую для кипячения 50,0 г воды при ее температуре кипения 100 ° C.
Решение:
умножьте теплоту испарения (выраженную в Дж / г) на массу используемой воды.(2259 Дж / г) (50,0 г) = 112950 Дж = 113 кДж
Пример № 5: На какой коэффициент энергия, необходимая для испарения 75 г воды при 100 ° C, больше, чем энергия, необходимая для плавления 75 г льда при 0 ° C?
Решение:
Обратите внимание, насколько одинаковы количества воды.Это сделано намеренно. Важно равенство, а не количество.Измените 75 г на один моль и решите:
40,7 кДж / 6,02 кДж = 6,76Измените количество воды на 1 грамм и решите:
2259,23 Дж / 334,166 Дж = 6,76Если вы настаивали на том, что нужно делать это для 75 г, то у нас это:
(75 г * 2259,23 Дж / г) / (75 г * 334,166 Дж / г) = ???Вы можете видеть, что 75 отменяются, оставляя 6,76 для ответа.
Вернуться к файлу графика времени-температуры
Вернуться в меню термохимии
СКРЫТОЕ ТЕПЛО ИСПАРЕНИЯ
Однокомпонентная система, содержащая две фазы (газ и жидкость) в равновесии, имеет одну степень свободы.Таким образом, он полностью определяется одной независимой переменной, обычно температурой. Остальные переменные состояния равновесия, давление пара p s и молярные объемы двух сосуществующих фаз и вытекают из комбинации критериев термодинамического равновесия и уравнения состояния, примененного к двум сосуществующим плоскостям. Скрытая теплота парообразования ΔH соответствует количеству энергии, которое должно быть подано в систему для преобразования единицы количества вещества из жидкой фазы в паровую в условиях равновесия между двумя фазами.Таким образом, этот переход всегда происходит при постоянной температуре и соответствующем давлении пара p s . Второй закон термодинамики устанавливает соотношение между теплотой парообразования и энтропией парообразования как:
(1)Энтальпия испарения равна теплоте испарения, поскольку давление постоянно вдоль фазового перехода, так что
(2)где индекс s обозначает условия насыщения.
Скрытая теплота парообразования может быть связана с другими термодинамическими величинами [Majer et al. (1989)]; например, уравнение
(3)связывает это с поведением (pT) жидкости. Еще одна взаимосвязь, имеющая некоторое значение, – это уравнение Клапейрона
(4)поскольку интегрирование с ним дает точное соотношение, выражающее зависимость давления пара от температуры. Из этого результата можно вывести приблизительное соотношение, действительное в пределе исчезающего давления пара.
(5)которое известно как уравнение Клаузиуса-Клапейрона и предоставляет средства для оценки скрытой теплоты парообразования на основе данных о давлении пара.
Теплоты испарения жидких смесей гораздо труднее обсуждать просто потому, что в двухфазной многокомпонентной системе количество степеней свободы равно количеству компонентов в системе. Испарение может происходить бесконечным числом способов, характеризуемых количеством испаряемой смеси и изменениями температуры и / или давления. Различные определения подробно обсуждаются Majer et al. (1989)
Методы определения теплоты испарения были критически оценены Majer et al.(1989), которые также обобщили методы оценки количества. Майер и Свобода (1985) дали обширный критический обзор и сбор данных по теплотам испарения органических соединений.
ССЫЛКИ
Майер В., Свобода В. и Пик Дж. (1989) Теплота испарения жидкостей . Эльзевир. Амстердам.
Майер В. и Свобода В. (1985) Энтальпии испарения органических соединений. Критический обзор и сбор данных. Серия химических данных ИЮПАК №32. Блэквелл. Оксфорд.
Список литературы
- Майер В., Свобода В. и Пик Дж. (1989) Теплоты испарения жидкостей . Эльзевир. Амстердам.
- Майер В. и Свобода В. (1985) Энтальпии испарения органических соединений. Критический обзор и сбор данных. Серия химических данных ИЮПАК № 32. Блэквелл. Оксфорд.
Энтальпия испарения – обзор
2.4.2 Экспериментальные методы
Несмотря на большое количество различных методов и процедур, используемых для измерения энтальпий испарения и сублимации [18,61–99], все измерения можно классифицировать как: а) прямые изотермические калориметрические измерения или б) косвенные процедуры.
Среди прямых калориметрических методов есть две основные модификации: адиабатические [65–72] и кондуктивные [73–78] калориметры. Адиабатические калориметры широко используются для определения энтальпий фазовых превращений летучих соединений, тогда как кондуктивные калориметры являются одними из самых точных методов для соединений с низким давлением пара.
Современные адиабатические калориметры используют метод, при котором энтальпия испарения измеряется в условиях, когда измеренное количество электрической энергии подводится к нагревателю, погруженному в образец, для компенсации тепла, поглощаемого веществом во время испарения, и, следовательно, температуры. остается постоянным. Основные различия между адиабатическими калориметрами состоят в том, что пар выходит из калориметра при атмосферном давлении (у Мэтьюза и Феландта [65]) в вакуум [67,69–71], в поток газа [68] или в замкнутая рециркуляционная система с непрерывным потоком жидкости [66].
Наиболее часто используемыми инструментами для измерения проводимости являются калориметры Кальве [73,74], в которых калориметр имеет две ячейки Кнудсена, одну для образца, а другую в качестве эталона. Вся система терморегулируется, и тепловой поток к эталонной ячейке измеряется двумя термобатареями, которые окружают обе ячейки.
Ряд энтальпий сублимации был измерен с помощью капельных калориметров [79]. В таких экспериментах образец и эталонный сосуд опускают в нагретый кондуктометрический микрокалориметр, вакуумируют и измеряют выходную мощность.Этот метод полезен для веществ, которые разлагаются при нагревании при пониженном давлении до образования заметного количества пара, а также при исследовании веществ, доступных в небольших количествах (для этого требуется примерно 10 мг на эксперимент).
Энтальпии сублимации также были измерены с использованием различных модификаций коммерческих дифференциальных сканирующих калориметров (ДСК) и приборов термогравиметрического анализа (ТГА) [80], но точность этих методов ниже, чем у других хорошо зарекомендовавших себя методов.
Энтальпии фазовых превращений низколетучих соединений обычно не определяются напрямую, а выводятся из измеренной зависимости между давлением пара и температурой с помощью уравнения Клаузиуса-Клапейрона (13).
(13) ln (p) = Δsub / vapHoRT + A
, где p – давление пара при температуре T , R газовая постоянная и A постоянная.
Давление пара можно измерить напрямую с помощью дифференциального эбуллиометрического метода [81,82] или путем статических измерений с помощью различных типов манометров [83–85].
Среди наиболее надежных методов измерения давления пара твердых тел в зависимости от температуры – метод потери массы [86] или кручение [87] эффузии Кнудсена. Торсионно-эффузионный метод – это дополнительный метод к эффузии с потерей массы, и оба метода часто измеряются одновременно [88,89]. Эта комбинация обеспечивает дополнительную информацию, полезную при оценке наличия ассоциации в паре, поскольку предоставляется информация о давлении пара, которая зависит (потеря массы) и не зависит (кручение) от молярной массы истекающего пара.
Методы транспирации или газонасыщения широко используются для измерения давления пара [90,91]. Через образец пропускают инертный газ и определяют количество транспортируемого материала в зависимости от температуры. Для количественной оценки перенесенной массы использовались различные аналитические методы. Основными преимуществами этого метода являются доступный широкий диапазон температур и небольшое количество образца (∼30 мг), необходимого для экспериментов.
Анализ свободного пространства над головой также использовался различными исследователями.Пар, находящийся в равновесии с твердым телом, измеряется либо непосредственно абсорбционным методом [92], либо косвенно [93]. Давление пара можно также измерить косвенно, используя кварцевый резонатор, где частота кристалла кварца изменяется в зависимости от толщины материала, нанесенного на его поверхность [94,95].
Простым и часто используемым методом определения энтальпий испарения летучих жидкостей является изотенископический метод [96,97]. Изотенископ был разработан для улавливания небольшого количества жидкости и ее паров в части сосуда, полностью погруженной в термостатируемую ванну, отделенной от измерительного устройства манометром с открытым концом, который также погружен в ванну.Жидкость в этом внутреннем манометре обычно является исследуемой жидкостью. Давление во внешнем пространстве измеряется обычными методами. Когда внутренний манометр показывает, что внешнее давление такое же, как давление внутри (давление пара жидкости при температуре ванны), регистрируется внешнее давление. Этот метод широко применяется для определения давлений паров смесей [98].
Корреляционная газовая хроматография – это косвенный метод определения энтальпий испарения твердых и жидких веществ [99].Непосредственно измеренная величина представляет собой энтальпию перехода из конденсированного состояния в колонне в газовое состояние. Энтальпию испарения получают с помощью уравнения, полученного регрессионным анализом между энтальпиями переноса и литературными данными для эталонных соединений. Основным преимуществом этого метода является то, что чистота образца не влияет на результаты измерений.
Там, где экспериментальных данных мало или полностью отсутствует, было разработано несколько методов для прогнозирования энтальпий фазовых изменений [100–103], основанных в основном на подходе группового вклада.
Калькулятор давления пара | Уравнение Клаузиуса-Клапейрона
Как рассчитать давление пара? – Закон Рауля
Закон Рауля гласит, что:
- Давление пара раствора равно давлению пара чистого растворителя, умноженному на его мольную долю.
Это также выражается следующим уравнением:
P раствор = P растворитель * X растворитель
где:
-
P solution– давление пара раствора -
P растворитель– давление паров растворителя -
X растворитель– мольная доля растворителя – отношение молей растворителя к молям всего раствора
Если в растворе более двух компонентов, необходимо применить закон парциальных давлений Дальтона.Закон Рауля верен только для идеальных решений. Раствор считается идеальным, если взаимодействия между всеми молекулами такие же, как взаимодействия между молекулами одного и того же химического вещества. Смеси разных молекул никогда не бывают идеальными, но мы можем рассматривать их так, как если бы они были предназначены для упрощения наших расчетов.
Давайте воспользуемся этим уравнением давления пара в упражнении:
Каково давление пара у раствора, полученного растворением 100 граммов глюкозы (C 6 H 12 O 6 ) в 500 граммах воды? Давление пара чистой воды 47.1 торр при 37 ° C.
- Рассчитайте мольную долю воды (растворителя).
-
X растворитель = n вода / (n глюкоза + n вода ). - Молярная масса воды 18 г / моль , а для глюкозы 180,2 г / моль .
-
n вода = 500/18 = 27,70 моль. -
n глюкоза = 100 / 180,2 = 0.555 моль. -
X растворитель = 27,70 / (27,70 + 0,555) = 0,98.
- Использование закона Раулта
-
P раствор = 47,1 * 0,98 = 46,16 торр
Теперь вы знаете, как самостоятельно рассчитать давление пара. Оба эти уравнения поначалу могут показаться устрашающими, но, как только вы их поймете, они окажутся очень простыми. Не забудьте проверить другие наши калькуляторы, например, калькулятор осмотического давления.
Юлия Жулавиньска
3.3 Фазовая диаграмма для водяного пара: уравнение Клаузиуса Клапейрона
3.3 Фазовая диаграмма для водяного пара: уравнение Клаузиуса – Клапейрона
Уравнение Клаузиуса – Клапейрона
Мы можем вывести уравнение для e s , используя две концепции, о которых вы, возможно, слышали и узнаете позже: энтропия и свободная энергия Гиббса , которые мы здесь не будем вдаваться. Вместо этого мы процитируем результат, который называется Уравнение Клаузиуса – Клапейрона ,
.1esdesdT = lvRvT2MathType @ СПР @ 5 @ 5 + = faaagCart1ev2aaaKnaaaaWenf2ys9wBH5garuavP1wzZbItLDhis9wBH5garmWu51MyVXgaruWqVvNCPvMCG4uz3bqee0evGueE0jxyaibaieYlf9irVeeu0dXdh9vqqj = hHeeu0xXdbba9frFj0 = OqFfea0dXdd9vqaq = JfrVkFHe9pgea0dXdar = Jb9hs0dXdbPYxe9vr0 = vr0 = vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaqaaqaaaOqaamaalaaabaGaaGymaaqaaiaadwgadaWgaaWcbaGaam4CaaqabaaaaOWaaSaaaeaacaWGKbGaamyzamaaBaaaleaacaWGZbaabeaaaOqaaiaadsgacaWGubaaaiabg2da9maalaaabaGaamiBamaaBaaaleaacaWG2baabeaaaOqaaiaadkfadaWgaaWcbaGaamODaaqabaGccaWGubWaaWbaaSqabeaacaaIYaaaaaaaaaa @ 4182 @
[3.9]
, где l v – энтальпия парообразования (часто называемая скрытой теплотой парообразования, около 2,5 x 10 6 Дж кг –1 ), R v – газовая постоянная для водяного пара (461,5 Дж кг –1 K –1 ), а T – абсолютная температура. Энтальпия испарения (т. Е. Скрытая теплота испарения) – это просто количество энергии, необходимое для испарения определенной массы жидкой воды.
В чем физический смысл? Правая часть [3.9] всегда положительна, что означает, что давление насыщенного пара всегда увеличивается с температурой (т.е. de s / dT > 0). Этот положительный наклон имеет смысл, потому что мы знаем, что с повышением температуры воды испарение происходит быстрее (потому что молекулы воды имеют больше энергии и, следовательно, больше шансов разорвать связи, которые удерживают их с другими молекулами воды в жидкости или во льду). При насыщении конденсация равна испарению, и, поскольку испарение больше, конденсация также должна быть больше.Большая часть более высокой конденсации происходит из-за того, что большее количество молекул водяного пара ударяется о поверхность жидкости, что в соответствии с законом идеального газа означает, что давление водяного пара выше.
Температурная чувствительность e s довольно высока. Подстановка соответствующих значений в правую часть [3.9] дает 0,07 K –1 , что означает, что давление насыщенного пара увеличивается на 7% на каждый 1 K повышения температуры. Эта высокая чувствительность имеет серьезные последствия для погоды и климата.
Разделение переменных ( e s и T ) в [3.9] и интегрирование, предполагая, что l v является константой с температурой (она не совсем постоянная!), Дает:
= ES ESO ехр (lvRvTo) ехр (-lvRvT) MathType @ СПР @ 5 @ 5 + = faaagCart1ev2aaaKnaaaaWenf2ys9wBH5garuavP1wzZbItLDhis9wBH5garmWu51MyVXgaruWqVvNCPvMCG4uz3bqee0evGueE0jxyaibaieYlf9irVeeu0dXdh9vqqj = hHeeu0xXdbba9frFj0 = OqFfea0dXdd9vqaq = JfrVkFHe9pgea0dXdar = Jb9hs0dXdbPYxe9vr0 = vr0 = vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaqaaqaaaOqaaiaadwgadaWgaaWcbaGaam4CaaqabaGccqGH9aqpcaWGLbWaaSbaaSqaaiaadohacaWGVbaabeaakiaaykW7ciGGLbGaaiiEaiaacchadaqadaqaamaalaaabaGaamiBamaaBaaaleaacaWG2baabeaaaOqaaiaadkfadaWgaaWcbaGaamODaaqabaGccaWGubWaaSbaaSqaaiaad + gaaeqaaaaaaOGaayjkaiaawMcaaiGacwgacaGG4bGaaiiCamaabmaabaWaaSaaaeaacqGHsislcaWGSbWaaSbaaSqaaiaadAhaaeqaaaGcbaGaamOuamaaBaaaleaacaWG2baabeaakiaadsfaaaaacaGLOaGaayzkaaaaaa @ 4F84 @
[3.10]
Обычно T o принимается равным 273 K, а e , поэтому составляет 6,11 гПа.
Примечания:
- e s зависит только от T , абсолютной температуры. Это практически не зависит от атмосферного давления или каких-либо других факторов.
- l v не является постоянным с температурой, а вместо этого изменяется незначительно (от 2,501 x 10 6 Дж кг –1 при 0 o C до 2.257 x 10 6 Дж кг –1 при 100 o C).
- Таким образом, наиболее точные формы интегрированного уравнения Клаузиуса – Клапейрона более сложны, но с ними легче работать при использовании компьютера.
Как выглядит график этого уравнения?
Равновесное давление пара над жидкой водной поверхностью, рассчитанное по уравнению Клаузиуса – Клапейрона. *** Неверная метка оси Y; он должен сказать «равновесное давление пара (гПа)».*** Линия для жидкой воды может быть продлена ниже 273 K, точки замерзания, потому что вода может оставаться жидкой при таких низких температурах и превращаться в «переохлажденную» жидкость.
Что происходит между паром и льдом? Могут быть применены те же методы и получены те же основные уравнения, но с другой константой:
ЭРИ = ESO ехр (lsRvTo) ехр (-lsRvT) MathType @ СПР @ 5 @ 5 + = faaagCart1ev2aaaKnaaaaWenf2ys9wBH5garuavP1wzZbItLDhis9wBH5garmWu51MyVXgaruWqVvNCPvMCG4uz3bqee0evGueE0jxyaibaieYlf9irVeeu0dXdh9vqqj = hHeeu0xXdbba9frFj0 = OqFfea0dXdd9vqaq = JfrVkFHe9pgea0dXdar = Jb9hs0dXdbPYxe9vr0 = vr0 = vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaqaaqaaaOqaaiaadwgadaWgaaWcbaGaam4CaiaadMgaaeqaaOGaeyypa0JaamyzamaaBaaaleaacaWGZbGaam4BaaqabaGccaaMc8UaciyzaiaacIhacaGGWbWaaeWaaeaadaWcaaqaaiaadYgadaWgaaWcbaGaam4CaaqabaaakeaacaWGsbWaaSbaaSqaaiaadAhaaeqaaOGaamivamaaBaaaleaacaWGVbaabeaaaaaakiaawIcacaGLPaaaciGGLbGaaiiEaiaacchadaqadaqaamaalaaabaGaeyOeI0IaamiBamaaBaaaleaacaWGZbaabeaaaOqaaiaadkfadaWgaaWcbaGaamODaaqabaGccaWGubaaaaGaayjkaiaawMcaaaaa @ 506c @
[3.11]
, где e si – давление насыщенного пара для равновесия ледяного пара, а l s – энтальпия сублимации (прямой обмен между твердой водой и паром = 2,834 x 10 6 Дж кг –1 ).
Уравнения для e s и e si , которые учитывают изменения с температурой l v и l s , соответственно, можно найти в Bohren and Albrecht (Atmospheric Thermodynamics, Oxford University Press, Нью-Йорк, 1998, ISBN 0-19-509904-4):
es = esoexp [(6808 K) (1To − 1T) −5.09lnTTo] ЭРИ = esoexp [(6293 К) (1Для-1T) -0.555lnTTo], где К = 273 К, = 6,11 ESO hPaMathType @ СПР @ 5 @ 5 + = faaagCart1ev2aaaKnaaaaWenf2ys9wBH5garuavP1wzZbItLDhis9wBH5garmWu51MyVXgaruWqVvNCPvMCaerbdfwBIjxAHbqee0evGueE0jxyaibaieYlf9irVeeu0dXdh9vqqj = hHeeu0xXdbba9frFj0 = OqFfea0dXdd9vqaq = JfrVkFHe9pgea0dXdar = Jb9hs0dXdbPYxe9vr0 = vr0 = vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaauaabaqafeaaaaqaaabbaaaaaaaaIXwyJTgapeGaamyza8aadaWgaaWcbaWdbiaadohaa8aabeaak8qacqGH9aqpcaWGLbWdamaaBaaaleaapeGaam4Caiaad + gaa8aabeaak8qaciGGLbGaaiiEaiaacchadaWadaqaamaabmaabaGaaGOnaiaaiIdacaaIWaGaaGioaiaabccacaqGlbaacaGLOaGaayzkaaWaaeWaa8aabaWdbmaalaaapaqaa8qacaaIXaaapaqaa8qacaWGubWdamaaBaaaleaapeGaam4BaaWdaeqaaaaak8qacqGHsisldaWcaaWdaeaapeGaaGymaaWdaeaapeGaamivaaaaaiaawIcacaGLPaaacqGHsislcaaI1aGaaiOlaiaaicdacaaI5aGaciiBaiaac6gadaWcaaWdaeaapeGaamivaaWdaeaapeGaamiva8aadaWgaaWcbaWdbiaad + gaa8aabeaaaaaak8qacaGLBbGaayzxaaaapaqaaaqaa8qacaWGLbWdamaaBaaaleaapeGaam4CaiaadMgaa8aabeaak8qacqGH9aqpcaWGLbWdamaaBaaaleaapeGaam4Caiaad + gaa8aabeaak8qa ciGGLbGaaiiEaiaacchadaWadaqaamaabmaabaGaaeOnaiaabkdacaqG5aGaae4maiaabccacaqGlbaacaGLOaGaayzkaaWaaeWaa8aabaWdbmaalaaapaqaa8qacaaIXaaapaqaa8qacaWGubWdamaaBaaaleaapeGaam4BaaWdaeqaaaaak8qacqGHsisldaWcaaWdaeaapeGaaGymaaWdaeaapeGaamivaaaaaiaawIcacaGLPaaacqGHsislcaaIWaGaaiOlaiaaiwdacaaI1aGaaGynaiGacYgacaGGUbWaaSaaa8aabaWdbiaadsfaa8aabaWdbiaadsfapaWaaSbaaSqaa8qacaWGVbaapaqabaaaaaGcpeGaay5waiaaw2faaaWdaeaaaeaapeGaae4DaiaabIgacaqGLbGaaeOCaiaabwgacaqGGaGaaGPaVlaadsfapaWaaSbaaSqaa8qacaWGVbaapaqabaGcpeGaeyypa0JaaGOmaiaaiEdacaaIZaGaaeiiaiaabUeacaGGSaGaaGzbVlaadwgapaWaaSbaaSqaa8qacaWGZbGaam4BaaWdaeqaaOWdbiabg2da9iaaiAdacaGGUaGaaGymaiaaigdacaqGGaGaaeiAaiaabcfacaqGHbaaaaaa @ 9770 @
[3.12]
Обратите внимание, что e , поэтому – это давление насыщенного пара при T o и что e , поэтому = 6,11 гПа и T o = 273 K. Обратите внимание, что константы немного отличаются потому что скрытая теплота испарения жидкой воды отличается от скрытой теплоты испарения льда. Обратите внимание, что T в этих уравнениях должно быть в градусах Кельвина.
Температура точки росы как мера водяного пара
Проще говоря, температура точки росы – это температура, при которой водяной пар атмосферы будет насыщен.Она всегда меньше или равна фактической температуре. Математически
ш (Т) = WS (Td) MathType @ СПР @ 5 @ 5 + = faaagCart1ev2aaaKnaaaaWenf2ys9wBH5garuavP1wzZbItLDhis9wBH5garmWu51MyVXgaruWqVvNCPvMCG4uz3bqee0evGueE0jxyaibaieYlf9irVeeu0dXdh9vqqj = hHeeu0xXdbba9frFj0 = OqFfea0dXdd9vqaq = JfrVkFHe9pgea0dXdar = Jb9hs0dXdbPYxe9vr0 = vr0 = vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaqaaqaaaOqaaiaadEhacaGGOaGaamivaiaacMcacqGH9aqpcaWG3bWaaSbaaSqaaiaadohaaeqaaOGaaiikaiaadsfadaWgaaWcbaGaamizaaqabaGccaGGPaaaaa @ 3C79 @
[3.13]
, что означает, что давление водяного пара при некоторой температуре T (не умноженное на T ) равно давлению насыщения водяного пара при температуре точки росы, T d . Итак, мы видим, что, поскольку w s зависит только от T d при данном давлении, T d является хорошим методом для обозначения абсолютного количества водяного пара.
Фазовая диаграмма для воды
Мы можем нарисовать фазовую диаграмму для воды.Есть три линии равновесия, которые пересекаются в тройной точке, где существуют все три фазы ( e s = 6,1 гПа; T = 273,14 K). Вдоль линии для e s пар и жидкость находятся в равновесии, и испарение уравновешивает конденсацию. Вдоль линии для e si пар и лед находятся в равновесии, и сублимация равняется осаждению. Вдоль линии для e sm жидкость и лед находятся в равновесии, а таяние уравновешивает синтез.
Фазовая диаграмма воды для большинства значений давления и температуры воды, относящихся к атмосфере. e s – давление насыщения (т. Е. Равновесное давление) между жидкостью и паром, а e si (*** неправильно обозначено как e i на диаграмме ***) – давление насыщения между паром и лед. Пунктирная линия является продолжением e s в ледяной фазе и представляет собой переохлажденную воду. Все три фазы встречаются в тройной точке.Диаграмма не в масштабе.
Кредит: В. Брун
Можно ли получить воду только в одной фазе? Да!
Самый простой случай – когда вся вода состоит из пара, что происходит, когда давление водяного пара достаточно низкое, а температура (и, следовательно, давление насыщенного пара) достаточно высока, чтобы вся вода в системе испарялась и находилась в паровой фазе.
Давайте подумаем, что нужно, чтобы вся вода была в жидкой фазе. Предположим, у нас есть вертикальный цилиндр, закрытый с одного конца, и герметичный поршень с другого конца.Весь цилиндр погружается в водяную баню с постоянной температурой, так что мы можем поддерживать цилиндр и его содержимое при фиксированной температуре (т. Е. Изотермической). Сначала мы наполняем цилиндр жидкой водой, и наверху находится небольшой объем чистого водяного пара. Если мы установим температуру ванны, скажем, на 280 K и оставим систему на некоторое время, пар станет насыщенным, что находится на линии e s . Для изотермического сжатия, при котором энергия удаляется из системы ванной для поддержания постоянной температуры, нажатие на поршень немного поднимет давление пара выше e s , и будет происходить чистая конденсация до тех пор, пока не установится равновесие. снова получается.Если мы продолжим медленно толкать поршень, в конечном итоге весь объем цилиндра будет заполнен жидкой водой, и в цилиндре будет только одна фаза: жидкость. Если мы продолжим толкать поршень, а температура в ванне будет оставаться постоянной, то давление воды увеличится.
В атмосфере лед или жидкость почти всегда имеют поверхность, которая находится под воздействием атмосферы, и поэтому существует вероятность того, что вода может сублимироваться или испаряться в этом большом объеме. Обратите внимание, что наличие или отсутствие сухого воздуха мало влияет на конденсацию и испарение воды, поэтому важно не присутствие воздуха, а большой объем водяного пара.
В атмосфере могут существовать условия, при которых давление и температура воды находятся в жидкой или иногда твердой части фазовой диаграммы. Но эти условия нестабильны, и конденсация или осаждение будет происходить до тех пор, пока конденсация и испарение или сублимация и осаждение не придут в равновесие, как и в случае с поршнем, описанным выше. Таким образом, больше воды перейдет в жидкую или ледяную фазу, так что давление водяного пара упадет до значения насыщения. Когда давление воды увеличивается при данной температуре, чтобы поместить систему в жидкую область водной фазовой диаграммы, водяной пар считается перенасыщенным.Это состояние не продлится долго, но оно необходимо при формировании облаков, как мы увидим на уроке по физике облаков.
Отметим также, что линия равновесия для льда и пара лежит ниже линии равновесия для переохлажденной жидкости и пара для каждой температуры. Таким образом, e si
Тест 3-2: Влажность и относительная влажность.
- Найдите Практический тест 3-2 в Canvas. Вы можете проходить эту практическую викторину сколько угодно раз. Он не оценивается, но позволяет вам проверить свой уровень подготовки перед тем, как пройти оцениваемый тест.
- Когда почувствуете, что готовы, пройдите Quiz 3-2 .


 Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V).
Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V).