Практическое применение электролиза
Электрохимические процессы широко применяются в различных областяхсовременнойтехникиитехнологии. С использованием электролиза в промышленных масштабах получают хлор и фтор, щелочи, хлораты и перхлораты, химически чистые водород и кислород и т.д.
В цветной металлургии электролиз
используется для получения металлов
из руд. Электролизом расплавленных
сред получают алюминий, магний, титан,
цирконий, уран, бериллий и другие металлы.
Для очистки металлов используютэлектрохимическое рафинирование.Для рафинирования (очистки) металла
электролизом из него отливают пластины
и помещают их в качестве анодов в
электролизер. При пропускании тока
металл, подлежащий очистке, подвергается
анодному растворению, т.е. переходит в
раствор в виде катионов. Затем эти
катионы металла разряжаются на катоде,
благодаря чему образуется осадок чистого
металла. Примеси, находящиеся в аноде,
либо остаются нерастворимыми (выпадают
в виде анодного шлама), либо переходят
в раствор электролита и удаляются.
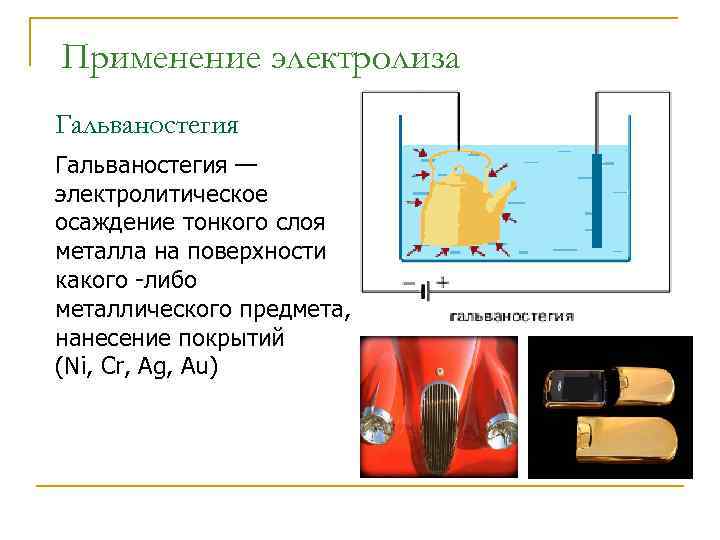
Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Особо необходимо отметить значение гальванических покрытий в высоких технологиях (HiTec) таких, как микроструктурная техника, электроника и другие. Гальванотехника подразделяется на гальваностегию и гальванопластику.
Гальваностегия(от греч. покрывать) – это электроосаждение на поверхность металла другого металла, который прочно связывается с покрываемым металлом (или специально обработанным неметаллическим предметом), служащим катодом электролизера. Покрытие изделий цинком, кадмием, никелем, хромом, золотом и другими металлами придает изделиям не только красивый внешний вид, но и предохраняет металл от коррозионного разрушения.
Гальванопластика – получение
путем электролиза точных, легко отделяемых
металлических копий (матриц) с различных
как неметаллических, так и металлических
рельефных предметов. С помощью
гальванопластики изготовляют бюсты,
статуи и т. д.
С помощью
гальванопластики изготовляют бюсты,
статуи и т. д.
Кроме того, с помощью электролиза:
получают защитные и декоративные оксидные пленки на поверхности металлов (анодирование),
осуществляют электрохимическую размерную обработку металла (электрохимическое фрезерование),
проводят обработку поверхности металлического изделия (электрохимическое полирование),
осуществляют электрохимическое окрашивание металлов, проводят электрохимическую заточку режущих инструментов (например, хирургических ножей, бритв и т. д.),
наносят металлические покрытия на изношенные металлические покрытия для ремонтных целей,
наносят эмалевые покрытия порошково-электростатическим методом.
1. Что такое электролиз?
2. Какие процессы имеют место при электролизе?
3. Как устроен электролизер?
4. Какой заряд имеют при электролизе а) анод, б) катод?
5. К какому электроду движутся при электролизе катионы?
6. Как заряжен электрод, к которому
движутся при электролизе анионы?
Как заряжен электрод, к которому
движутся при электролизе анионы?
7. Какой процесс протекает при электролизе:
а) на аноде, б) на катоде?
8. Какие виды анодов используют при электролизе?
9. Какой процесс протекает при электролизе на растворимом аноде?
10. Из каких материалов изготавливают инертные (нерастворимые) аноды?
11. Какова последовательность разряда ионов при электролизе на аноде?
12. Какова очередность восстановления катионов при электролизе на катоде?
13. На основании какого закона устанавливается зависимость массы вещества, образовавшегося при электролизе, от времени, силы тока и природы электролита?
14. Приведите формулировку I закона Фарадея.
15. Приведите формулировку II закона Фарадея.
16. Какое значение имеет постоянная Фарадея?
17. Что такое электрохимический эквивалент? Какую размерность он имеет?
18. Как рассчитывается электрохимический
эквивалент для металлов?
Как рассчитывается электрохимический
эквивалент для металлов?
19. Как можно рассчитать значение молярной массы эквивалента металла?
20. Что такое выход по току?
21. Назовите области применения электролиза.
Законы электролиза Фарадея • Джеймс Трефил, энциклопедия «Двести законов мироздания»
200 законов мироздания > Химия
При электролизе масса превращенного вещества прямо пропорциональна количеству электричества, прошедшего через электролитическую ячейку.
При прохождении через электролит одного и того же количества электричества масса превращенного вещества зависит от массы и заряда ионов вещества.
Два закона электролиза — это всего лишь небольшая часть вклада Майкла Фарадея в науку. Электролиз — это совокупность процессов, происходящих при пропускании электрического тока через электролит — плавленое ионное вещество (например, плавленая соль) или раствор, в котором присутствуют ионы. Электрический ток проходит через электролит от одного электрода к другому. Положительно заряженные ионы при этом движутся к отрицательному электроду, катоду, а отрицательно заряженные — к положительному электроду, аноду. Химические реакции происходят на электродах. Фарадей провел фундаментальные исследования электролитов и создал законы, в которых говорится, что химические превращения связаны с потоком электронов (то есть электрическим током): чем больше электронов, тем больше химических превращений.
Положительно заряженные ионы при этом движутся к отрицательному электроду, катоду, а отрицательно заряженные — к положительному электроду, аноду. Химические реакции происходят на электродах. Фарадей провел фундаментальные исследования электролитов и создал законы, в которых говорится, что химические превращения связаны с потоком электронов (то есть электрическим током): чем больше электронов, тем больше химических превращений.
Электролиз — это важный промышленный процесс, используемый как при получении определенных металлов, так и при конечной обработке поверхностей методом нанесения гальванического покрытия. Примером электролиза в действии может быть электролитическое рафинирование меди после ее выделения из руды. Выступающие в качестве катода тонкие листы чистой меди опускают в электролит, содержащий раствор сульфата меди и серную кислоту, а слитки неочищенной меди подвешивают в этом же растворе, и они действуют как анод. При пропускании электрического тока анод начинает растворяться, и ионы меди, вместе с некоторым количеством ионов железа и цинка, поступают в электролит. Остальные спутники меди, содержавшиеся в слитках (включая значительное количество серебра, золота и платины), выпадают в осадок и накапливаются на дне электролитической ванны. Ионы меди через электролит направляются к катоду и осаждаются на нем. Цинк и железо остаются в растворе.
Остальные спутники меди, содержавшиеся в слитках (включая значительное количество серебра, золота и платины), выпадают в осадок и накапливаются на дне электролитической ванны. Ионы меди через электролит направляются к катоду и осаждаются на нем. Цинк и железо остаются в растворе.
В промышленных масштабах в подобных ваннах за месяц можно очистить всего несколько тонн меди, но при этом получается продукт 99,96-процентной чистоты. Более того, благодаря извлечению из осадка благородных металлов окупается весь процесс очистки. Кроме меди, электролитическим методом в промышленных масштабах очищаются также магний, натрий и алюминий.
В описанном выше процессе рафинирования меди атом меди переходит в электролит в виде иона, теряя два электрона. Следовательно, на аноде он принимает два электрона, и ион снова превращается в нейтральный атом меди (можно представить себе, что эти два электрона бегут по проводу, как электрический ток). Согласно первому закону Фарадея, для того чтобы очистить в два раза больше меди, необходимо в два раза больше электронов.
2
Показать комментарии (2)
Свернуть комментарии (2)
Ilnar 25.05.2006 23:37 Ответить
Положительно заряженные ионы при этом движутся к отрицательному электроду, аноду, а отрицательно заряженные – к положительному электроду, катоду.
По-моему все наоборот, Катод(-), Анод(+). К катоду движутся катионы, к аноду – анионы.Ответить
a_b 24.12.2009 12:42 Ответить
Следует заметить, что при помощи электролиза магний, натрий и алюминий не очищаются (рафинируются), а извлекаются.
Ответить
Написать комментарий
1834 | Законы электролиза Фарадея |
1831
Законы электромагнитной индукции Фарадея
1687
Законы механики Ньютона
Новостная рассылка
«Элементы» в соцсетях:
Применение электролиза – гальванопокрытие, гальванопластика
Электролиз – это процесс химического разложения, происходящий при пропускании электрического тока через жидкость или раствор, содержащий ионы. В этом процессе мы обычно пропускаем постоянный электрический ток через ионное вещество, которое либо присутствует в расплавленной форме, либо растворено в любом подходящем растворителе, вызывая химические реакции на электродах и вызывая разложение материала. Ключевым процессом электролиза является обмен атомами и ионами из внешней цепи путем удаления или добавления электронов. Часто желаемые продукты электролиза находятся в физическом состоянии, отличном от электролита, и некоторые физические процессы могут их удалить. Основные компоненты, необходимые для электролиза:
В этом процессе мы обычно пропускаем постоянный электрический ток через ионное вещество, которое либо присутствует в расплавленной форме, либо растворено в любом подходящем растворителе, вызывая химические реакции на электродах и вызывая разложение материала. Ключевым процессом электролиза является обмен атомами и ионами из внешней цепи путем удаления или добавления электронов. Часто желаемые продукты электролиза находятся в физическом состоянии, отличном от электролита, и некоторые физические процессы могут их удалить. Основные компоненты, необходимые для электролиза:
Электролит: Вещество, часто полимер с ионной проводимостью, который содержит свободные ионы в электролите, проводящем электрический ток. Если ионы, как в большинстве твердых солей, неподвижны, электролиз будет невозможен.
Электропитание постоянного тока (DC): Обеспечивает необходимую энергию для генерации или разрядки ионов электролита. Электрический ток во внешней цепи переносится электронами.
Два электрода: Это электрические проводники, обеспечивающие физический интерфейс между электролитом и электрической цепью, обеспечивающей энергию.
1. Извлечение металлов (электрометаллургия)
Электрометаллургия – это процесс электролиза для извлечения металла из руды. Электролиты расплавленных электролитов получают такие металлы, как натрий, калий, магний, кальций, алюминий и т. д. Существует два метода извлечения металлов в зависимости от физического состояния руды. В первом способе руда обрабатывается сильной кислотой для получения соли, и такой солевой раствор подвергается электролизу для высвобождения металла. Руда находится в расплавленном состоянии во втором процессе и подвергается электролизу в печи.
(i) Извлечение цинка:
Серная кислота используется для обработки цинковой руды. В ходе процесса электролиза, участвующего в этой реакции, в результате получается раствор сульфата цинка, который также действует как электролит для электролитической реакции. Катоды в баке электролита выполнены из алюминия, а аноды – из свинца. Плотность тока поддерживается на уровне 1000 А/м², а катод осаждается цинком. Потребление энергии составляет от 3000 до 5000 кВтч на тонну.
Катоды в баке электролита выполнены из алюминия, а аноды – из свинца. Плотность тока поддерживается на уровне 1000 А/м², а катод осаждается цинком. Потребление энергии составляет от 3000 до 5000 кВтч на тонну.
(ii) Добыча алюминия:
Бокситы и криолиты представляют собой алюминиевые руды. Их химически обрабатывают и восстанавливают до оксида алюминия, затем растворяют в расплавленном криолите и подвергают электролизу в печи. Отложения алюминия оседают на дне. Температура печи составляет около 1000 °C, чтобы поддерживать электролит в расплавленном состоянии. Для завершения процесса требуется ток около 4000 ампер, а потребляемая энергия составляет от 20 000 до 25 000 кВтч на тонну.
2. Производство неметаллов
Электролиз используется для получения неметаллов, таких как водород, фтор, хлор. Водород получают в присутствии таких электролитов, как H₂SO₄ и KNO₃, путем электролиза воды.
3. Рафинирование металлов
Основные преимущества электролитических процессов извлечения металла заключаются в том, что чистота получаемого продукта составляет от 98 до 99 %. Электролиз используется для дальнейшей очистки. Анод изготовлен из экстрагированного металла. Катод осаждает чистый металл. Электролит изготовлен из раствора металла, такого как медь, медный купорос и никель, хлорид никеля. Энергозатраты электролитического процесса при рафинировании меди составляют от 150 до 300 кВтч/т рафинированной меди. Чистоту меди можно повысить электрорафинированием. В этом случае используется тот же принцип гальваники или электроосаждения. Электролит представляет собой раствор ионов меди, такой как медный купорос. Катод представляет собой полоску чистой меди, а анод — кусок неочищенной меди. На аноде: атомы меди растворяются, образуя ионы меди из нечистой меди. Это приводит к уменьшению размера анода. Примеси собираются в ячейке и опадают с анода. На катоде: ионы Cu2+ мигрируют к катоду, где осаждаются в виде твердой меди на катоде. Катод утолщается (увеличивается в размерах).
Электролиз используется для дальнейшей очистки. Анод изготовлен из экстрагированного металла. Катод осаждает чистый металл. Электролит изготовлен из раствора металла, такого как медь, медный купорос и никель, хлорид никеля. Энергозатраты электролитического процесса при рафинировании меди составляют от 150 до 300 кВтч/т рафинированной меди. Чистоту меди можно повысить электрорафинированием. В этом случае используется тот же принцип гальваники или электроосаждения. Электролит представляет собой раствор ионов меди, такой как медный купорос. Катод представляет собой полоску чистой меди, а анод — кусок неочищенной меди. На аноде: атомы меди растворяются, образуя ионы меди из нечистой меди. Это приводит к уменьшению размера анода. Примеси собираются в ячейке и опадают с анода. На катоде: ионы Cu2+ мигрируют к катоду, где осаждаются в виде твердой меди на катоде. Катод утолщается (увеличивается в размерах).
4. Производство химических веществ
Многие химические вещества, такие как едкий натр (NaOH), газообразный хлор и т. д., производятся в больших масштабах путем электролиза. При крупномасштабном электролизе также получают перманганат калия, водород, кислород и т. д.
д., производятся в больших масштабах путем электролиза. При крупномасштабном электролизе также получают перманганат калия, водород, кислород и т. д.
5. Гальванопокрытие
Гальванопокрытие представляет собой покрытие объекта тонкой металлической пленкой, нанесенной в процессе электролиза раствором электролита. Гальванопокрытие часто используется для таких предметов, как ножи и вилки (серебряная пластина), чтобы получить привлекательную и долговечную отделку. Он также используется для защиты металлов, подверженных коррозии. Например, относительно нереакционноспособный металлический кадмий часто наносят на стальные детали для предотвращения коррозии. Гальваническое покрытие является очень ценным промышленным процессом, но его использование требует дорогостоящей и стабильно эффективной обработки образующихся при этом отходов. Возможно изготовление недорогих посеребренных украшений гальванопокрытием. Золотые кольца, из-за которых пальцы становятся зелеными, на самом деле представляют собой медные кольца с гальваническим покрытием золотом.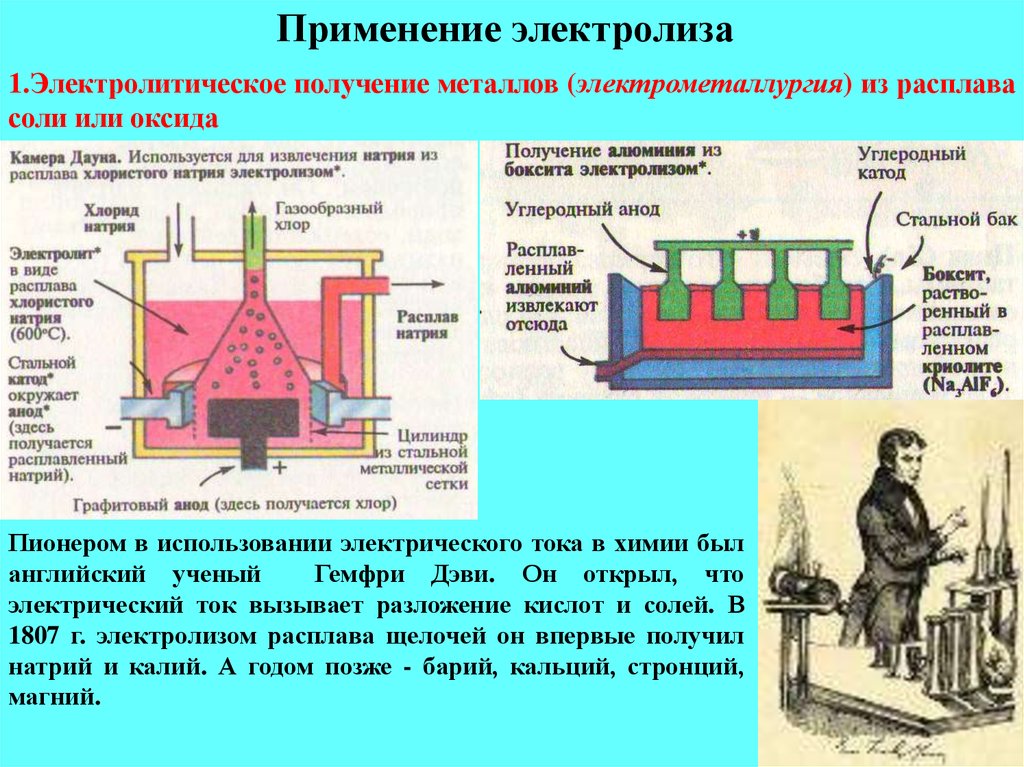
Покрываемое изделие используется в качестве катода в процессе гальванического покрытия, а металл, нанесенный на изделие, используется в качестве анода. Электролитический раствор или «ванна» содержит гальваническую соль металла. Низковольтный электрический ток заставляет ионы металлов из ванны получать электроны от катода и осаждаться на катоде (объекте) в виде металлического покрытия. Это также заставляет атомы металла терять электроны на аноде и переходить в виде ионов в ванну. Анод постепенно исчезает по мере нанесения покрытия и поддерживает концентрацию иона металла в ванне. Многие токсичные растворы используются в гальванических операциях. Предметы, подлежащие покрытию концентрированными кислотными или щелочными растворами, тщательно очищают от жира и грязи. В конце концов, из-за загрязнения чистящие растворы становятся неэффективными и должны быть утилизированы.
На качество металлического покрытия, формируемого гальванопокрытием, влияет ряд факторов:
Концентрация восстанавливаемых катионов тщательно контролируется в гальваническом растворе.
 Необходимо избегать нежелательных побочных реакций.
Необходимо избегать нежелательных побочных реакций.Необходимо тщательно учитывать тип и концентрацию электролита.
Соединения для регулирования кислотности и повышения электропроводности должны быть включены в раствор.
Некоторые составы делают металл более блестящим или гладким.
Анод должен иметь форму катода во многих гальванических ячейках для достижения равномерного металлического покрытия.
6. Электротипирование
Это процесс, при котором гальванопокрытие воспроизводит срезы древесины и т. д. в меди. В этом процессе сначала изготавливается форма из воска, затем она покрывается черным свинцом, чтобы придать ей металлическую поверхность, а затем подвергается процессу электроосаждения. Таким образом, на подготовленной поверхности образуется медная пленка.
Таким образом, на подготовленной поверхности образуется медная пленка.
7. Гальванопластика
Это еще одно применение электроосаждения. Воспроизведение объектов методом электроосаждения на какой-либо форме или форме известно как электроформование. Это еще один полезный пример среди многих приложений электролиза. Сначала мы должны снять оттиск объектов на воске или другом воскоподобном материале. Чтобы сделать его проводящим, поверхность восковой формы, которая несет точный оттиск объекта, покрыта графитовым порошком. Затем форму погружают в качестве катода в раствор электролита. Электролитный металл будет осаждаться на вдавленной графитовой поверхности формы в процессе электролиза. После получения слоя нужной толщины изделие будет удалено, а воск расплавлен для получения воспроизведенного объекта в виде металлической оболочки. Воспроизведение диска с граммофонной пластинкой – популярное использование гальванопластики. Оригинальная запись происходит на пластинке восковой композиции. Эта восковая форма затем покрывается золотым порошком, чтобы сделать ее проводящей. Затем эту форму погружают в качестве катода в электролит на основе медного купороса. Использование медного анода сохраняет раствор насыщенным. На восковой форме в результате гальванопластики меди получается мастер-пластина, используемая для штамповки большого количества дисков из шеллака.
Эта восковая форма затем покрывается золотым порошком, чтобы сделать ее проводящей. Затем эту форму погружают в качестве катода в электролит на основе медного купороса. Использование медного анода сохраняет раствор насыщенным. На восковой форме в результате гальванопластики меди получается мастер-пластина, используемая для штамповки большого количества дисков из шеллака.
8. Электроочистка
Очищаемым от масла и жира элементом является катод, а раствор пропускают через железный бак или чан, заполненный раствором электролита и сильным током. На катоде образуются едкий натр и водород, удаляющие жир с поверхности изделия. Этот процесс известен как катодная очистка и применяется к цинку и алюминию. Изделие изготовлено анодом для анодной очистки.
9. Определение эквивалентных масс элементов
Количества металлов, осажденных на катодах двух ячеек, пропорциональны их эквивалентным массам соответствующих металлов, согласно второму закону электролиза, когда одинаковое количество электронного тока проходит через солевые растворы двух разных ячеек. Если количества металлов, осажденных на катодах, равны WA и WB, то
Если количества металлов, осажденных на катодах, равны WA и WB, то
\[\frac{W_{A}}{W_{B}} = \frac{Equivalent\:Mass\: of\: A} {Эквивалент\: Масса\: of\: B}\]
Зная эквивалентную массу одного металла, можно вычислить эквивалентную массу другого металла из приведенного выше соотношения. Этот метод может также определять эквивалентные массы тех неметаллов, которые выделяются на анодах.
10. Толщина любого слоя покрытия
Метод электролиза также можно использовать для расчета толщины слоя покрытия любого материала. Для этого нам достаточно знать размеры материала с покрытием и мы получим его толщину.
Очистка металла – Грязные металлы можно очистить с помощью электролиза. Нечистый металл сделан из анода. Та же металлическая пластина чисто из катода. Солевой раствор используется в качестве электролита. Когда ток проходит через электролит, анод обычно плавится.
 Чистый металл помещается в катод, а грязь остается.
Чистый металл помещается в катод, а грязь остается.Химическое производство. Едкий натр получают электролизом раствора хлорида натрия.
Анодирование – это процесс покрытия алюминия его оксидом для защиты от коррозии.
Производство O 2 и H 2 – Их получают электролизом кислой воды.
Медицинское применение. Электролиз используется для омоложения полиомиелита; Удаление нежелательных волос на любом участке тела.
Электролитический процесс
В процессе электролиза происходит обмен ионами с атомами за счет добавления или удаления электронов из внешнего круга. В основном при прохождении тока катионы идут к катоду, забирают электроны с катода (учитывая источник-аккумулятор) и отдают их от нейтрального атома. Нейтральный атом, если он твердый, помещается в катод, а если газ, то поднимается на поверхность. Это процесс восстановления, и катион уменьшается на катоде. При этом анионы, в свою очередь, отдают свои электроны аноду и окисляются нейтральными атомами в аноде. Электроны, выпущенные анионами, проходят через электрическую цепь и достигают катода, замыкая цепь. Электролиз сочетает одновременную реакцию окисления на аноде с реакцией восстановления на катоде.
Нейтральный атом, если он твердый, помещается в катод, а если газ, то поднимается на поверхность. Это процесс восстановления, и катион уменьшается на катоде. При этом анионы, в свою очередь, отдают свои электроны аноду и окисляются нейтральными атомами в аноде. Электроны, выпущенные анионами, проходят через электрическую цепь и достигают катода, замыкая цепь. Электролиз сочетает одновременную реакцию окисления на аноде с реакцией восстановления на катоде.
Например, при прохождении электрического тока через расплавленный хлорид натрия ион натрия притягивается к катоду, из которого он эмитирует электрод и становится атомом натрия. Процесс электролиза, хотя и полезен для прямого получения основных форм из компьютеров, также может быть применен косвенно к щелочным и щелочноземельным металлам, очистке металлов, вставке металлов, приготовлению компаундов и т. д.
Электролиз | Определение, использование и факты
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- В этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.

 Необходимо избегать нежелательных побочных реакций.
Необходимо избегать нежелательных побочных реакций. Чистый металл помещается в катод, а грязь остается.
Чистый металл помещается в катод, а грязь остается.
