PhysBook:Электронный учебник физики — PhysBook
Содержание
- 1 Учебники
-
2 Механика
- 2.1 Кинематика
- 2.2 Динамика
- 2.3 Законы сохранения
- 2.4 Статика
- 2.5 Механические колебания и волны
-
3 Термодинамика и МКТ
- 3.1 МКТ
 2 Термодинамика
2 Термодинамика
-
4 Электродинамика
- 4.1 Электростатика
- 4.2 Электрический ток
- 4.3 Магнетизм
- 4.4 Электромагнитные колебания и волны
-
5 Оптика. СТО
- 5.1 Геометрическая оптика
- 5.2 Волновая оптика
-
5.
 3 Фотометрия
3 Фотометрия
- 5.4 Квантовая оптика
- 5.5 Излучение и спектры
- 5.6 СТО
-
6 Атомная и ядерная
- 6.1 Атомная физика. Квантовая теория
- 6.2 Ядерная физика
- 8 Новые страницы
Здесь размещена информация по школьной физике:
- материалы из учебников, лекций, рефератов, журналов;
- разработки уроков, тем;
- flash-анимации, фотографии, рисунки различных физических процессов;
- ссылки на другие сайты
и многое другое.
Каждый зарегистрированный пользователь сайта имеет возможность выкладывать свои материалы (см. справку), обсуждать уже созданные.
Учебники
Формулы по физике – 7 класс – 8 класс – 9 класс – 10 класс – 11 класс –
Механика
Кинематика
Основные понятия кинематики – Прямолинейное движение – Криволинейное движение – Движение в пространстве
Динамика
Законы Ньютона – Силы в механике – Движение под действием нескольких сил
Законы сохранения
Закон сохранения импульса – Закон сохранения энергии
Статика
Статика твердых тел – Динамика твердых тел – Гидростатика – Гидродинамика
Механические колебания и волны
Механические колебания – Механические волны
Термодинамика и МКТ
МКТ
Основы МКТ – Газовые законы – МКТ идеального газа
Термодинамика
Первый закон термодинамики – Второй закон термодинамики – Жидкость-газ – Поверхностное натяжение – Твердые тела – Тепловое расширение
Электродинамика
Электростатика
Электрическое поле и его параметры – Электроемкость
Электрический ток
Постоянный электрический ток – Электрический ток в металлах – Электрический ток в жидкостях – Электрический ток в газах – Электрический ток в вакууме – Электрический ток в полупроводниках
Магнетизм
Магнитное поле – Электромагнитная индукция
Электромагнитные колебания и волны
Электромагнитные колебания – Производство и передача электроэнергии – Электромагнитные волны
Оптика.
 СТО
СТОГеометрическая оптика
Прямолинейное распространение света. Отражение света – Преломление света – Линзы
Волновая оптика
Свет как электромагнитная волна – Интерференция света – Дифракция света
Фотометрия
Фотометрия
Квантовая оптика
Квантовая оптика
Излучение и спектры
Излучение и спектры
СТО
СТО
Атомная и ядерная
Атомная физика. Квантовая теория
Строение атома – Квантовая теория – Излучение атома
Ядерная физика
Атомное ядро – Радиоактивность – Ядерные реакции – Элементарные частицы
Общие темы
Измерения – Методы решения – Развитие науки- Статья- Как писать введение в реферате- Подготовка к ЕГЭ – Репетитор по физике
Новые страницы
Запрос не дал результатов.
Электролиз расплавов и растворов — схема, правила и уравнения
Электролиз расплавов и растворов встречается в заданиях на ЕГЭ, а значит, если вы планируете сдавать экзамен по химии, эту тему нужно знать на отлично.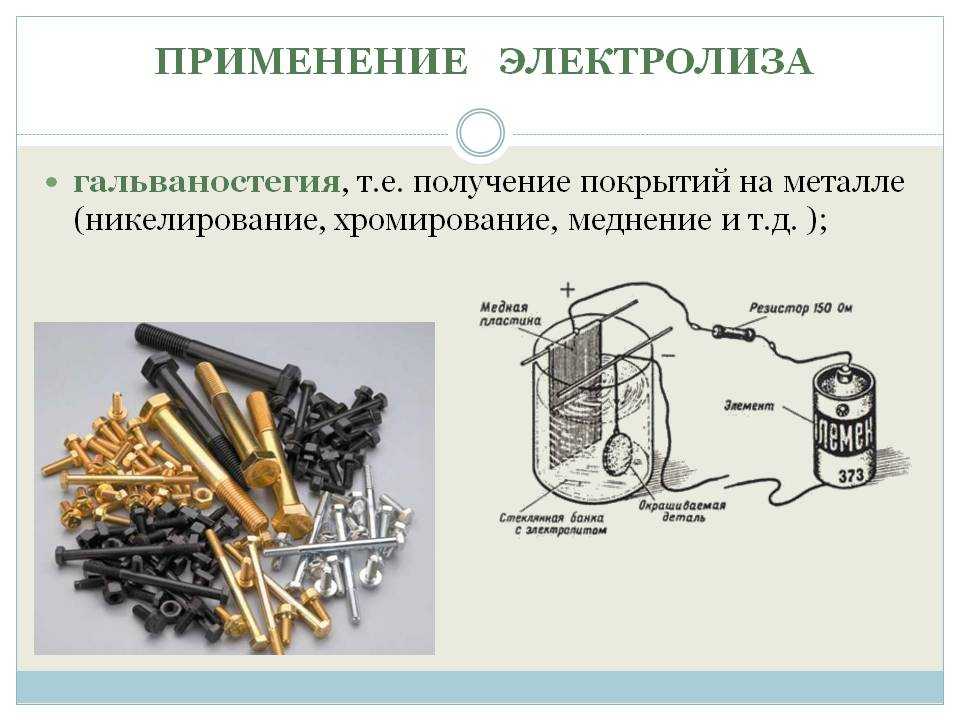 Наша статья поможет узнать или повторить, что такое электролиз, его правила и схема протекания.
Наша статья поможет узнать или повторить, что такое электролиз, его правила и схема протекания.
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз расплава.
- Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−) Катион принимает электроны и восстанавливается: Me+n + ne− → Me0 (восстановление). Процесс на аноде A (+) Анион отдает электроны и окисляется: неMe−n − ne− → неMe0 (окисление). Процессы, протекающие при электролизе в общем случае: К− : Ме+n + ne− → Ме0; Суммарное уравнение электролиза: |
|---|
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К−: 2Na+ + 2e− = 2Na0
А+: 2Cl− − 2e− = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H
К−: 4H2O + 4e− = 2H20 + 4OH−
А+: 2H2O − 4e− = O2 + 4H+
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды.
 Катионы металла не восстанавливаются, остаются в растворе.
Катионы металла не восстанавливаются, остаются в растворе.Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:
Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде.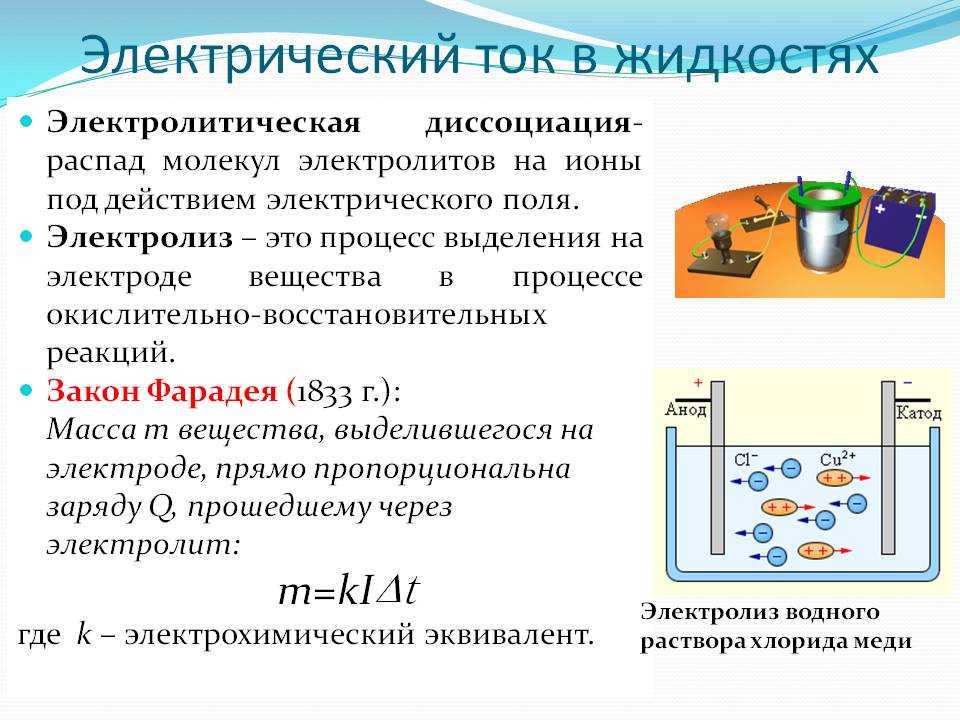
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.
Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.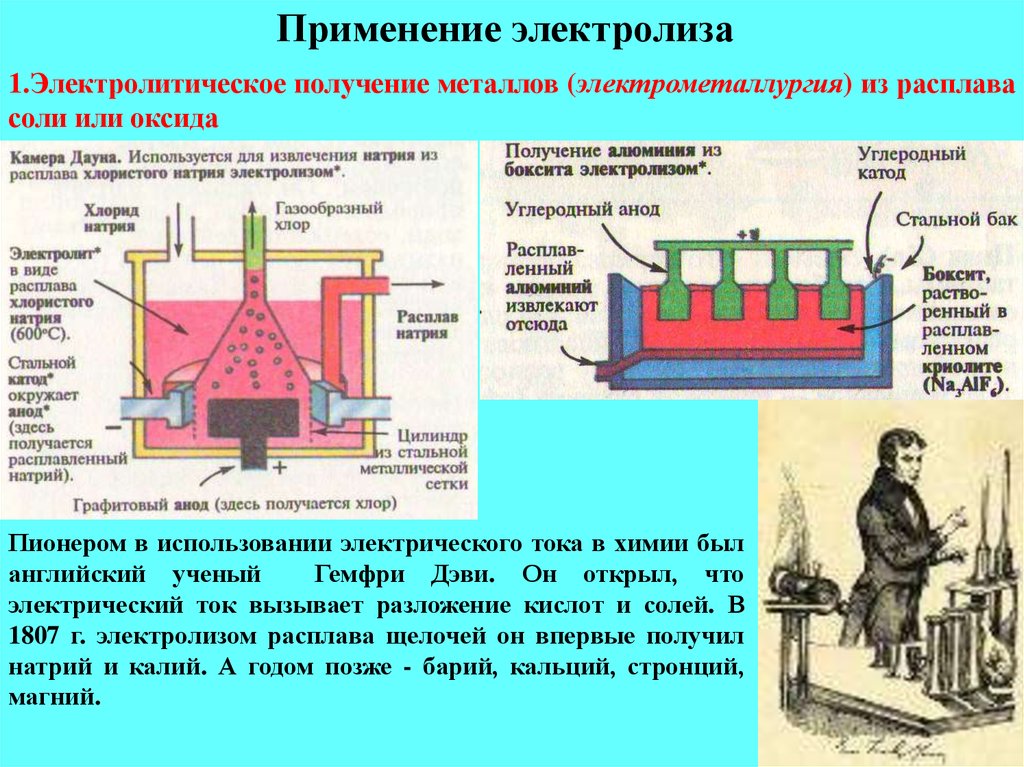
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.

В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
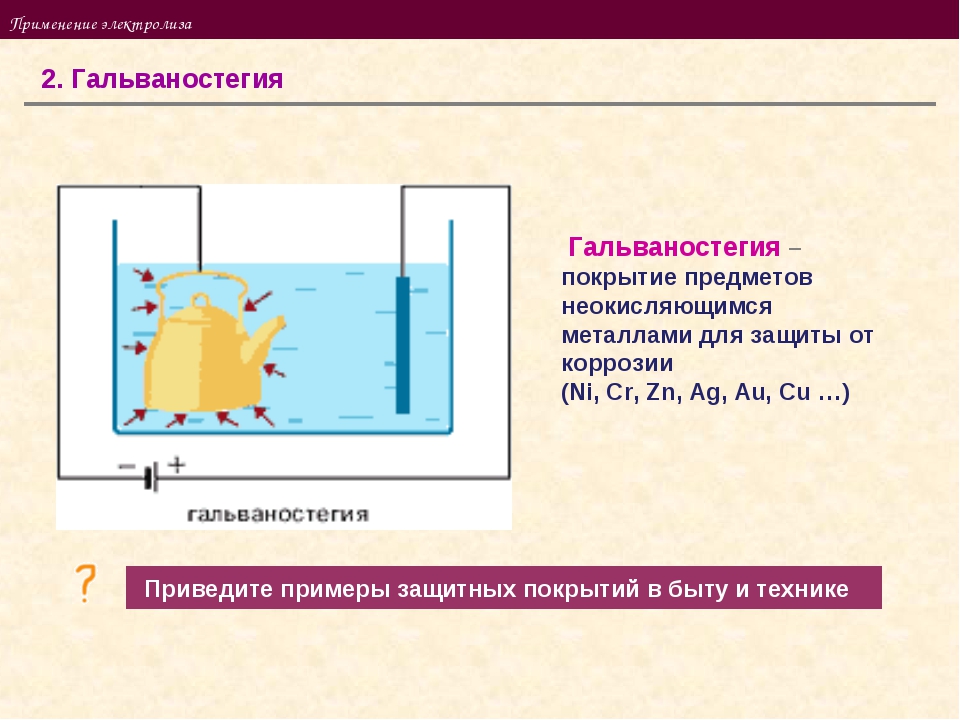
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это…»:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.

2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
Обменная реакция.
3. Как заряжен анион?
Положительно.
Отрицательно.
Нейтрально.
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
Ничем.
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.

5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Этот металл.
Водород.
Металл и водород.
Оксид металла.
При электролиза водного раствора фторида лития что на аноде выделится?
Фтор.
Водород.
Кислород.
Вода.
Ответы
c
a
b
c
c
с
7 лучших применений электролиза | Отрасли
РЕКЛАМА:
Основными практическими применениями электролиза являются: 1. Извлечение металлов 2. Рафинирование металлов 3. Производство химикатов 4. Гальваническое покрытие 5. Электротипирование 6. Электроформование 7. Электроочистка.
Извлечение металлов 2. Рафинирование металлов 3. Производство химикатов 4. Гальваническое покрытие 5. Электротипирование 6. Электроформование 7. Электроочистка.
Существует два метода извлечения металла на основе физического состояния руды. В первом методе руду обрабатывают сильной кислотой для получения соли, а раствор такой соли подвергают электролизу с выделением металла. Во втором процессе руда находится в расплавленном состоянии и подвергается электролизу в печи.
(i) Извлечение цинка:
РЕКЛАМА:
Цинковая руда обрабатывается серной кислотой. Полученный в результате раствор сульфата цинка затем электролитизируется. В электролизере катоды сделаны из алюминия, а аноды из свинца. Плотность тока поддерживается на уровне 1000 А/м 2 и цинк осаждается на катоде. Потребление энергии составляет от 3000 до 5000 кВтч на тонну.
(ii) Добыча алюминия:
Руды алюминия бокситы и криолиты. Их обрабатывают химически и восстанавливают до оксида алюминия, а затем растворяют в расплавленном криолите и подвергают электролизу в печи. Алюминий откладывается на катоде и оседает на дно. Для поддержания электролита в расплавленном состоянии температура печи составляет около 1000°С. Для завершения процесса требуется ток около 4000 ампер, а потребляемая энергия составляет от 20 000 до 25 000 кВтч на тонну.
Их обрабатывают химически и восстанавливают до оксида алюминия, а затем растворяют в расплавленном криолите и подвергают электролизу в печи. Алюминий откладывается на катоде и оседает на дно. Для поддержания электролита в расплавленном состоянии температура печи составляет около 1000°С. Для завершения процесса требуется ток около 4000 ампер, а потребляемая энергия составляет от 20 000 до 25 000 кВтч на тонну.
Основными преимуществами извлечения металла электролитическими процессами являются чистота получаемого продукта от 98 до 99%. Дальнейшая очистка производится электролизом. Анод изготовлен из извлеченного металла. Чистый металл осаждается на катоде. Электролит изготовлен из раствора металла, т.е. для меди это сульфат меди, а для никеля – хлорид никеля. Энергозатраты при рафинировании меди электролитическим способом составляют от 150 до 300 кВтч/т рафинированной меди.
РЕКЛАМА:
В следующей таблице представлена информация по аффинажу металлов:
Заявка № 3. Химическое производство:
Химическое производство: Многие химические вещества, такие как каустическая сода (NaOH), газообразный хлор и т. д., производятся путем электролиза в больших масштабах. Водород и кислород пермаганата калия и т. д. также производятся электролизом в больших масштабах.
Приложение № 4. Гальваника:РЕКЛАМА:
Это процесс покрытия изделий из дешевых металлов тонким покрытием из драгоценных металлов, таких как железо с никелем, хромом, серебром или золотом, с одной или несколькими из следующих целей:
я. Защита металлов от коррозии.
ii. Придание блестящего вида изделиям.
III. Придание отражателям отражающих свойств.
ОБЪЯВЛЕНИЙ:
ив. Замена рабочего материала.
Заявка № 5. Электропечать: Это процесс, при котором срезы дерева и т. д. воспроизводятся в меди путем гальванического покрытия. В этом процессе сначала изготавливается форма из воска, затем она покрывается черным свинцом для придания металлической поверхности, а затем подвергается процессу электроосаждения. Таким образом, на подготовленной поверхности образуется пленка меди.
Таким образом, на подготовленной поверхности образуется пленка меди.
Это еще одно применение электроосаждения. Воспроизведение объектов путем электроосаждения на какую-либо форму или форму известно как гальванопластика.
При воспроизведении монет, молле, гравюр и т. д. форма сначала изготавливается путем оттиска объекта, например, из воска. Поверхность воска, которая имеет точные отпечатки объекта, покрыта порошкообразным графитом, чтобы сделать его проводящим. Затем форму погружают в электроформовочную ячейку в качестве катода. После получения покрытия нужной толщины изделие и восковая сердцевина выплавляются из металлической оболочки.
Заявка № 7. Электроочистка:РЕКЛАМА:
Изделие, подлежащее очистке от масла и жира, представляет собой катод и железный бак или чан, заполненный электролитным раствором электролита, и через раствор пропускают сильный ток. На катоде образуется каустическая сода и водород, который удаляет жир с поверхности изделия. Этот процесс называется катодной очисткой и применим к цинку и алюминию. Для анодной очистки изделие изготавливается анодным.
На катоде образуется каустическая сода и водород, который удаляет жир с поверхности изделия. Этот процесс называется катодной очисткой и применим к цинку и алюминию. Для анодной очистки изделие изготавливается анодным.
Главная ›› Металлургия ›› Промышленность ›› Процессы ›› Электролиз ›› Применение электролиза
Применение электролиза – гальваническое покрытие, гальванопластика
Электролиз – это процесс химического разложения, происходящий при пропускании электрического тока через жидкость или раствор, содержащий ионы. В этом процессе мы обычно пропускаем постоянный электрический ток через ионное вещество, которое либо присутствует в расплавленной форме, либо растворено в любом подходящем растворителе, вызывая химические реакции на электродах и вызывая разложение материала. Ключевым процессом электролиза является обмен атомами и ионами из внешней цепи путем удаления или добавления электронов. Часто желаемые продукты электролиза находятся в физическом состоянии, отличном от электролита, и некоторые физические процессы могут их удалить. Основные компоненты, необходимые для электролиза:
Основные компоненты, необходимые для электролиза:
Электролит: Вещество, часто полимер с ионной проводимостью, который содержит свободные ионы в электролите, проводящем электрический ток. Если ионы, как в большинстве твердых солей, неподвижны, электролиз будет невозможен.
Электропитание постоянного тока (DC): Обеспечивает необходимую энергию для генерации или разрядки ионов электролита. Электрический ток во внешней цепи переносится электронами.
Два электрода: Это электрические проводники, обеспечивающие физический интерфейс между электролитом и электрической цепью, обеспечивающей энергию.
1. Извлечение металлов (электрометаллургия)
Электрометаллургия – это процесс электролиза для извлечения металла из руды. Электролиты расплавленных электролитов получают такие металлы, как натрий, калий, магний, кальций, алюминий и т. д. Существует два метода извлечения металлов в зависимости от физического состояния руды. В первом способе руда обрабатывается сильной кислотой для получения соли, и такой солевой раствор подвергается электролизу для высвобождения металла. Руда находится в расплавленном состоянии во втором процессе и подвергается электролизу в печи.
В первом способе руда обрабатывается сильной кислотой для получения соли, и такой солевой раствор подвергается электролизу для высвобождения металла. Руда находится в расплавленном состоянии во втором процессе и подвергается электролизу в печи.
(i) Извлечение цинка:
Серная кислота используется для обработки цинковой руды. В ходе процесса электролиза, участвующего в этой реакции, в результате получается раствор сульфата цинка, который также действует как электролит для электролитической реакции. Катоды в баке электролита выполнены из алюминия, а аноды – из свинца. Плотность тока поддерживается на уровне 1000 А/м², а катод осаждается цинком. Потребление энергии составляет от 3000 до 5000 кВтч на тонну.
(ii) Добыча алюминия:
Бокситы и криолиты представляют собой алюминиевые руды. Их химически обрабатывают и восстанавливают до оксида алюминия, затем растворяют в расплавленном криолите и подвергают электролизу в печи. Отложения алюминия оседают на дне. Температура печи составляет около 1000 °C, чтобы поддерживать электролит в расплавленном состоянии. Для завершения процесса требуется ток около 4000 ампер, а потребляемая энергия составляет от 20 000 до 25 000 кВтч на тонну.
Отложения алюминия оседают на дне. Температура печи составляет около 1000 °C, чтобы поддерживать электролит в расплавленном состоянии. Для завершения процесса требуется ток около 4000 ампер, а потребляемая энергия составляет от 20 000 до 25 000 кВтч на тонну.
2. Производство неметаллов
Электролиз используется для получения неметаллов, таких как водород, фтор, хлор. Водород получают в присутствии таких электролитов, как H₂SO₄ и KNO₃, путем электролиза воды.
3. Рафинирование металлов
Основные преимущества электролитических процессов извлечения металла заключаются в том, что чистота получаемого продукта составляет от 98 до 99 %. Электролиз используется для дальнейшей очистки. Анод изготовлен из экстрагированного металла. Катод осаждает чистый металл. Электролит изготовлен из раствора металла, такого как медь, медный купорос и никель, хлорид никеля. Энергозатраты электролитического процесса при рафинировании меди составляют от 150 до 300 кВтч/т рафинированной меди. Чистоту меди можно повысить электрорафинированием. В этом случае используется тот же принцип гальваники или электроосаждения. Электролит представляет собой раствор ионов меди, такой как медный купорос. Катод представляет собой полоску чистой меди, а анод — кусок неочищенной меди. На аноде: атомы меди растворяются, образуя ионы меди из нечистой меди. Это приводит к уменьшению размера анода. Примеси собираются в ячейке и опадают с анода. На катоде: ионы Cu2+ мигрируют к катоду, где осаждаются в виде твердой меди на катоде. Катод утолщается (увеличивается в размерах).
Чистоту меди можно повысить электрорафинированием. В этом случае используется тот же принцип гальваники или электроосаждения. Электролит представляет собой раствор ионов меди, такой как медный купорос. Катод представляет собой полоску чистой меди, а анод — кусок неочищенной меди. На аноде: атомы меди растворяются, образуя ионы меди из нечистой меди. Это приводит к уменьшению размера анода. Примеси собираются в ячейке и опадают с анода. На катоде: ионы Cu2+ мигрируют к катоду, где осаждаются в виде твердой меди на катоде. Катод утолщается (увеличивается в размерах).
4. Производство химических веществ
Многие химические вещества, такие как едкий натр (NaOH), газообразный хлор и т. д., производятся в больших масштабах путем электролиза. При крупномасштабном электролизе также получают перманганат калия, водород, кислород и т. д.
5. Гальванопокрытие
Гальванопокрытие представляет собой покрытие объекта тонкой металлической пленкой, нанесенной при электролизе раствором электролита. Гальванопокрытие часто используется для таких предметов, как ножи и вилки (серебряная пластина), чтобы получить привлекательную и долговечную отделку. Он также используется для защиты металлов, подверженных коррозии. Например, относительно нереакционноспособный металлический кадмий часто наносят на стальные детали для предотвращения коррозии. Гальваническое покрытие является очень ценным промышленным процессом, но его использование требует дорогостоящей и стабильно эффективной обработки образующихся при этом отходов. Возможно изготовление недорогих посеребренных украшений гальванопокрытием. Золотые кольца, из-за которых пальцы становятся зелеными, на самом деле представляют собой медные кольца с гальваническим покрытием золотом.
Гальванопокрытие часто используется для таких предметов, как ножи и вилки (серебряная пластина), чтобы получить привлекательную и долговечную отделку. Он также используется для защиты металлов, подверженных коррозии. Например, относительно нереакционноспособный металлический кадмий часто наносят на стальные детали для предотвращения коррозии. Гальваническое покрытие является очень ценным промышленным процессом, но его использование требует дорогостоящей и стабильно эффективной обработки образующихся при этом отходов. Возможно изготовление недорогих посеребренных украшений гальванопокрытием. Золотые кольца, из-за которых пальцы становятся зелеными, на самом деле представляют собой медные кольца с гальваническим покрытием золотом.
Покрываемое изделие используется в качестве катода в процессе гальванического покрытия, а металл, нанесенный на изделие, используется в качестве анода. Электролитический раствор или «ванна» содержит гальваническую соль металла. Низковольтный электрический ток заставляет ионы металлов из ванны получать электроны от катода и осаждаться на катоде (объекте) в виде металлического покрытия.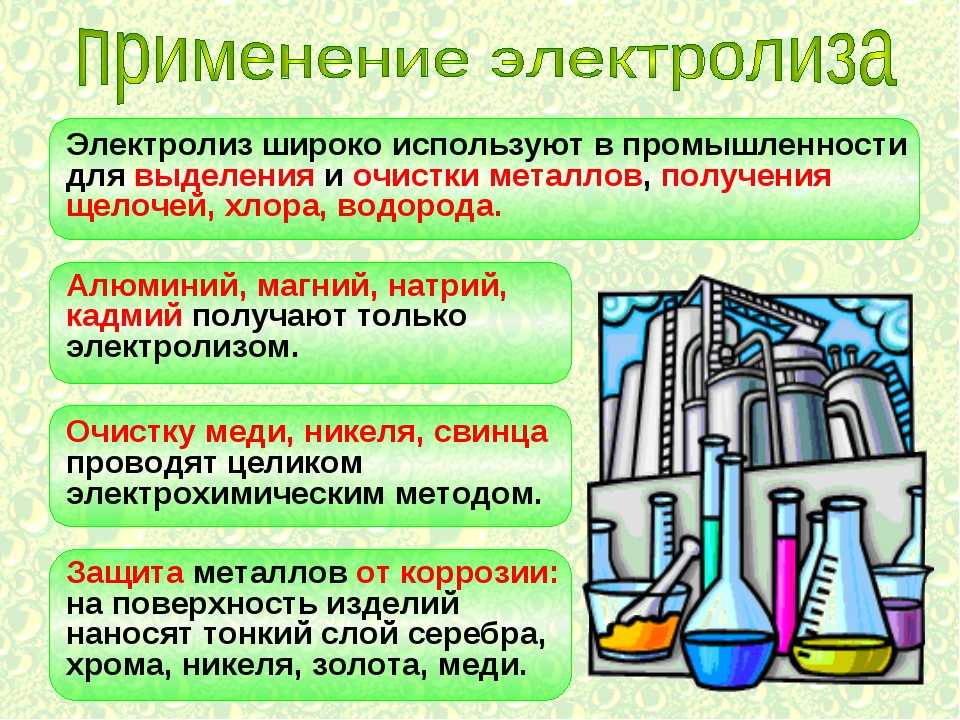 Это также заставляет атомы металла терять электроны на аноде и переходить в виде ионов в ванну. Анод постепенно исчезает по мере нанесения покрытия и поддерживает концентрацию иона металла в ванне. Многие токсичные растворы используются в гальванических операциях. Предметы, подлежащие покрытию концентрированными кислотными или щелочными растворами, тщательно очищают от жира и грязи. В конце концов, из-за загрязнения чистящие растворы становятся неэффективными и должны быть утилизированы.
Это также заставляет атомы металла терять электроны на аноде и переходить в виде ионов в ванну. Анод постепенно исчезает по мере нанесения покрытия и поддерживает концентрацию иона металла в ванне. Многие токсичные растворы используются в гальванических операциях. Предметы, подлежащие покрытию концентрированными кислотными или щелочными растворами, тщательно очищают от жира и грязи. В конце концов, из-за загрязнения чистящие растворы становятся неэффективными и должны быть утилизированы.
На качество металлического покрытия, сформированного гальванопокрытием, влияет ряд факторов:
Концентрация восстанавливаемых катионов тщательно контролируется в гальваническом растворе. Необходимо избегать нежелательных побочных реакций.
Необходимо тщательно учитывать тип и концентрацию электролита.
Соединения для регулирования кислотности и повышения электропроводности должны быть включены в раствор.

Некоторые составы делают металл более блестящим или гладким.
Анод должен иметь форму катода во многих гальванических ячейках для достижения равномерного металлического покрытия.
6. Электротипирование
Это процесс, при котором гальванопокрытие воспроизводит срезы дерева и т. д. в меди. В этом процессе сначала изготавливается форма из воска, затем она покрывается черным свинцом, чтобы придать ей металлическую поверхность, а затем подвергается процессу электроосаждения. Таким образом, на подготовленной поверхности образуется медная пленка.
7. Гальванопластика
Это еще одно применение электроосаждения. Воспроизведение объектов методом электроосаждения на какой-либо форме или форме известно как электроформование. Это еще один полезный пример среди многих приложений электролиза. Сначала мы должны снять оттиск объектов на воске или другом воскоподобном материале. Чтобы сделать его проводящим, поверхность восковой формы, которая несет точный оттиск объекта, покрыта графитовым порошком. Затем форму погружают в качестве катода в раствор электролита. Электролитный металл будет осаждаться на вдавленной графитовой поверхности формы в процессе электролиза. После получения слоя нужной толщины изделие будет удалено, а воск расплавлен для получения воспроизведенного объекта в виде металлической оболочки. Воспроизведение диска с граммофонной пластинкой – популярное использование гальванопластики. Оригинальная запись происходит на пластинке восковой композиции. Эта восковая форма затем покрывается золотым порошком, чтобы сделать ее проводящей. Затем эту форму погружают в качестве катода в электролит на основе медного купороса. Использование медного анода сохраняет раствор насыщенным. На восковой форме в результате гальванопластики меди получается мастер-пластина, используемая для штамповки большого количества дисков из шеллака.
Сначала мы должны снять оттиск объектов на воске или другом воскоподобном материале. Чтобы сделать его проводящим, поверхность восковой формы, которая несет точный оттиск объекта, покрыта графитовым порошком. Затем форму погружают в качестве катода в раствор электролита. Электролитный металл будет осаждаться на вдавленной графитовой поверхности формы в процессе электролиза. После получения слоя нужной толщины изделие будет удалено, а воск расплавлен для получения воспроизведенного объекта в виде металлической оболочки. Воспроизведение диска с граммофонной пластинкой – популярное использование гальванопластики. Оригинальная запись происходит на пластинке восковой композиции. Эта восковая форма затем покрывается золотым порошком, чтобы сделать ее проводящей. Затем эту форму погружают в качестве катода в электролит на основе медного купороса. Использование медного анода сохраняет раствор насыщенным. На восковой форме в результате гальванопластики меди получается мастер-пластина, используемая для штамповки большого количества дисков из шеллака.
8. Электроочистка
Очищаемым от масла и жира элементом является катод, а раствор пропускают через железный бак или чан, заполненный раствором электролита и сильно током. На катоде образуются едкий натр и водород, удаляющие жир с поверхности изделия. Этот процесс известен как катодная очистка и применяется к цинку и алюминию. Изделие изготовлено анодом для анодной очистки.
9. Определение эквивалентных масс элементов
Количества металлов, осажденных на катодах двух ячеек, пропорциональны их эквивалентным массам соответствующих металлов, в соответствии со вторым законом электролиза, когда одинаковое количество электронного тока пропускают через растворы солей двух разных ячеек. Если количества металлов, осажденных на катодах, равны WA и WB, то
\[\frac{W_{A}}{W_{B}} = \frac{Equivalent\:Mass\: of\: A} {Эквивалент\: Масса\: of\: B}\]
Зная эквивалентную массу одного металла, можно вычислить эквивалентную массу другого металла из приведенного выше соотношения.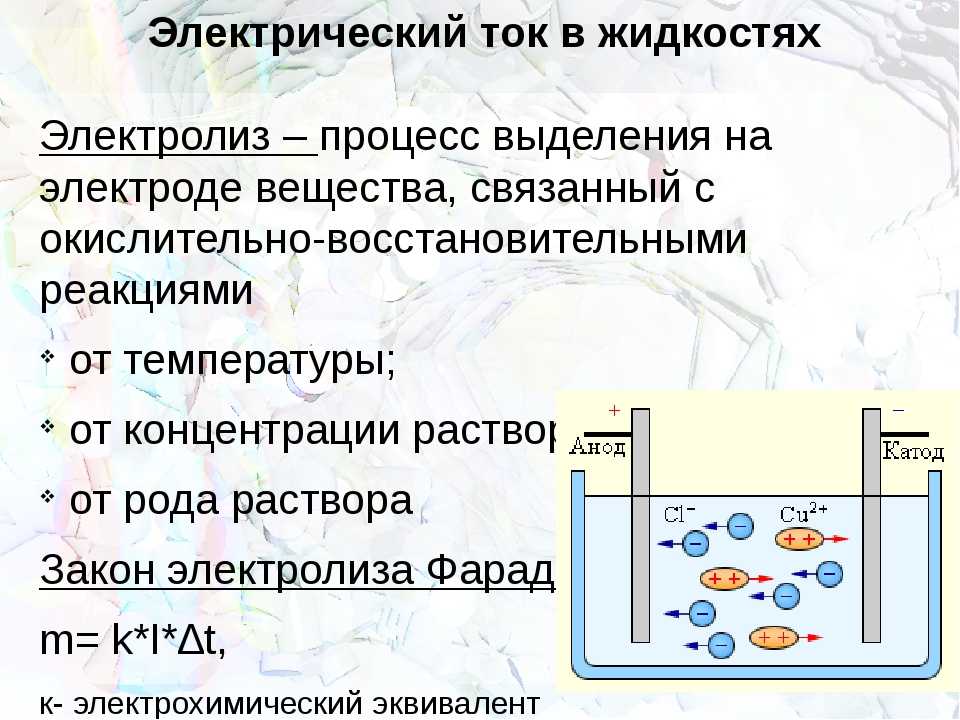 Этот метод может также определять эквивалентные массы тех неметаллов, которые выделяются на анодах.
Этот метод может также определять эквивалентные массы тех неметаллов, которые выделяются на анодах.
10. Толщина любого слоя покрытия
Метод электролиза также можно использовать для расчета толщины слоя покрытия любого материала. Для этого нам достаточно знать размеры материала с покрытием и мы получим его толщину.
Очистка металла. Грязные металлы можно очистить с помощью электролиза. Нечистый металл сделан из анода. Та же металлическая пластина чисто из катода. Солевой раствор используется в качестве электролита. Когда ток проходит через электролит, анод обычно плавится. Чистый металл помещается в катод, а грязь остается.
Химическое производство. Едкий натр получают электролизом раствора хлорида натрия.
Анодирование – это процесс покрытия алюминия его оксидом для защиты от коррозии.

Производство O 2 и H 2 – Их получают электролизом кислой воды.
Медицинские применения. Электролиз используется для омоложения полиомиелита; Удаление нежелательных волос на любом участке тела.
Электролитический процесс
В процессе электролиза происходит обмен ионами с атомами за счет добавления или удаления электронов из внешнего круга. В основном при прохождении тока катионы идут к катоду, забирают электроны с катода (учитывая источник-аккумулятор) и отдают их от нейтрального атома. Нейтральный атом, если он твердый, помещается в катод, а если газ, то поднимается на поверхность. Это процесс восстановления, и катион уменьшается на катоде. При этом анионы, в свою очередь, отдают свои электроны аноду и окисляются нейтральными атомами в аноде. Электроны, выпущенные анионами, проходят через электрическую цепь и достигают катода, замыкая цепь.

 2 Термодинамика
2 Термодинамика
 3 Фотометрия
3 Фотометрия

 Катионы металла не восстанавливаются, остаются в растворе.
Катионы металла не восстанавливаются, остаются в растворе.



