ЖИЗНЬ, МОЛЕКУЛА ВОДЫ И ЗОЛОТАЯ ПРОПОРЦИЯ
Соотношения золотой пропорции исследователи находят в морфологической структуре растений, птиц, животных, человека. Закономерности золотой пропорции обнаруживаются и в организации неживой природы. В данной статье на основании анализа молекулы воды в различных агрегатных состояниях высказана гипотеза, что ее структура в состоянии талой воды практически соответствует треугольнику золотой пропорции.Наука и жизнь // Иллюстрации
Теплоемкость воды достигает минимального значения при температуре около 37<SUP>о</SUP>С.
Наука и жизнь // Иллюстрации
Илл. 1. Плотность воды при понижении температуры сначала возрастает, достигает максимума при 4<SUP>о</SUP>С и начинает уменьшаться.
Наука и жизнь // Иллюстрации
В момент плавления объем свинца мгновенно увеличивается от 1 до 1,003, а объем воды скачком уменьшается от 1,1 до 1,0.
Наука и жизнь // Иллюстрации
Вода имеет аномально высокие температуры кипения и замерзания по сравнению с другими трехатомными соединениями водорода.
Наука и жизнь // Иллюстрации
В жидкой воде молекулы H<SUB>2</SUB>O могут объединяться в сложные образования – кластеры, по структуре напоминающие лед.
Наука и жизнь // Иллюстрации
Схематичное изображение молекулы воды на плоскости.
Деление отрезка в крайнем и среднем отношении, или золотая пропорция. Отрезок разделен на две части так, что CB:AC = AC:AB.
“Золотой треугольник”. Соотношение его сторон OA:AB = OB:AB ≈ 0,618,
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Таблица 1.
Таблица 2.
‹
›
Открыть в полном размере
Воде была дана волшебная власть стать соком жизни на Земле.
Леонардо да Винчи
Вода – одно из самых уникальных и загадочных веществ на Земле. Природа этого вещества до конца еще не понята. Внешне вода кажется достаточно простой, в связи с чем долгое время считалась неделимым элементом. Лишь в 1766 году Г.
Дальнейшие исследования показали, что за незатейливой химической формулой Н2О скрывается вещество, обладающее уникальной структурой и не менее уникальными свойствами. Исследователи, пытавшиеся на протяжении двух с лишним столетий раскрыть секреты воды, часто заходили в тупик. Да и сейчас ученые понимают, что вода остается трудным объектом для исследований, ее свойства до сих пор не всегда до конца прогнозируемы.
Загадочная магия воды. Почему жидкая вода имеет необычные свойства? Традиционный ответ может быть следующим: из-за свойств атомов кислорода и водорода, из-за их структурного расположения в молекуле, из-за определенного поведения электронов в молекуле и т. п.
п.
Так в чем же заключаются загадочные, необычные свойства привычной всем жидкой воды? Прежде всего, в том, что практически все свойства воды аномальны, а многие из них не подчиняются логике тех законов физики, которые управляют другими веществами. Кратко упомянем те из них, которые обуславливают существование жизни на Земле.
Вначале о трех особенностях тепловых свойств воды.
Первая особенность: вода – единственное вещество на Земле (кроме ртути), для которого зависимость удельной теплоемкости от температуры имеет минимум.
Из-за того, что удельная теплоемкость воды имеет минимум около 37 оС, нормальная температура человеческого тела, состоящего на две трети из воды, находится в диапазоне температур 36-38оС (внутренние органы имеют более высокую температуру, чем наружные).
Вторая особенность: теплоемкость воды аномально высока. Чтобы нагреть определенное ее количество на один градус, необходимо затратить больше энергии, чем при нагреве других жидкостей, – по крайней мере вдвое по отношению к простым веществам. Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Таким образом, вода играет главенствующую роль в процессах регулирования теплообмена человека и позволяет ему поддерживать комфортное состояние при минимуме энергетических затрат. При нормальной температуре тела человек находится в наиболее выгодном энергетическом состоянии.
Температура других теплокровных млекопитающих (32-39оС) также хорошо соотносится с температурой минимума удельной теплоемкости воды.
Третья особенность: вода обладает высокой удельной теплотой плавления, то есть воду очень трудно заморозить, а лед – растопить. Благодаря этому климат на Земле в целом достаточно стабилен и мягок.
Все три особенности тепловых свойств воды позволяют человеку оптимальным образом существовать в условиях благоприятной среды.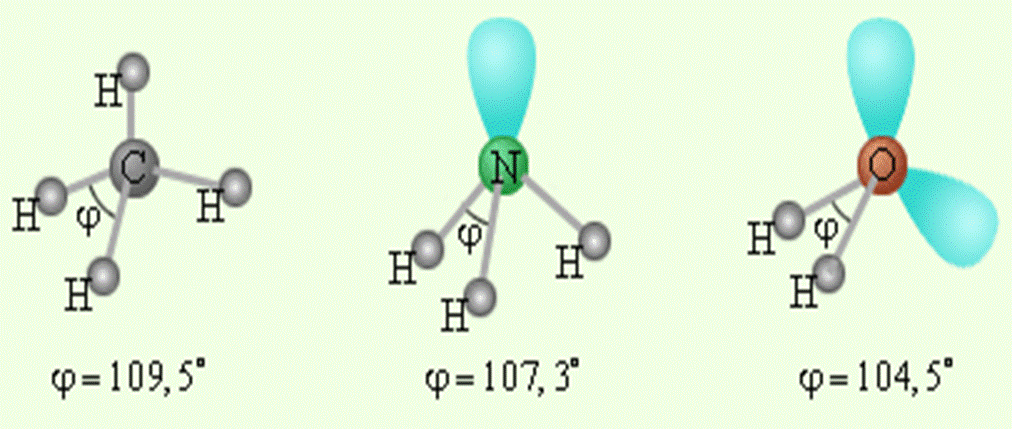
Имеются особенности и в поведении объема воды. Плотность большинства веществ – жидкостей, кристаллов и газов – при нагревании уменьшается и при охлаждении увеличивается, вплоть до процесса кристаллизации или конденсации. Плотность воды при охлаждении от 100 до 4 оС (точнее, до 3,98оС) возрастает, как и у подавляющего большинства жидкостей. Однако, достигнув максимального значения при температуре 4оС, плотность при дальнейшем охлаждении воды начинает уменьшаться. Другими словами, максимальная плотность воды наблюдается при температуре 4оС (одна из уникальных аномалий воды), а не при температуре замерзания 0оС.
Замерзание воды сопровождается скачкообразным(!) уменьшением плотности более чем на 8%, тогда как у большинства других веществ процесс кристаллизации сопровождается увеличением плотности. В связи с этим лед (твердая вода) занимает больший объем, чем жидкая вода, и держится на ее поверхности.
Столь необычное поведение плотности воды крайне важно для поддержания жизни на Земле.
Покрывая воду сверху, лед играет в природе роль своего рода плавучего одеяла, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Отметим еще некоторые особенности воды.
Внешне вода подвижна и податлива, и ее можно заключить в любой сосуд. Однако, проникая в трещины горных пород и расширяясь при замерзании, вода раскалывает скальные породы любой твердости, которые постепенно распадаются на все более мелкие частицы. Так начинается возврат окаменевших пород в жизненный цикл: на полях промерзание поверхностных слоев земли с ее органическими компонентами помогает образованию плодородной почвы.
Процесс включения твердых веществ в большой круговорот живой природы ускоряется чудесным свойством воды их растворять. Вода с растворенными компонентами твердых веществ становится средой питания и поставщиком микроэлементов, необходимых для жизни растений, животных и человека.
Вода с растворенными компонентами твердых веществ становится средой питания и поставщиком микроэлементов, необходимых для жизни растений, животных и человека.Вода сильнее других жидкостей проявляет свойства универсального растворителя. Если ей дать достаточно времени, она может растворить практически любое твердое вещество. Именно из-за уникальной растворяющей способности воды никому до сих пор не удалось получить химически чистую воду – она всегда содержит растворенный материал сосуда. Вода абсолютно необходима для всех ключевых систем жизнеобеспечения человека. Она содержится в человеческой крови (79%) и способствует переносу по кровеносной системе в растворенном состоянии тысяч необходимых для жизни веществ. Вода содержится в лимфе (96%), которая разносит из кишечника питательные вещества по тканям живого организма (см. таблицу 1).
Перечисленные свойства и особая роль воды в обеспечении жизни на Земле не могут оставить равнодушным ни один пытливый ум, даже если он верит в счастливые случайности. “Начало всего есть вода”, – справедливо отмечал Фалес из Милета в VI веке до н.э.
“Начало всего есть вода”, – справедливо отмечал Фалес из Милета в VI веке до н.э.
Жидкое чудо. Прекратим перечисление странных, но жизненно необходимых свойств воды, которых можно набрать еще с десяток, и переключим внимание на секреты необычного строения ее молекулы. Именно анализ строения молекулы воды позволяет понять ее исключительность в живой и неживой природе. Так что дорога к истине проходит через строение одиночной молекулы воды.
Прежде всего отметим, что молекула воды самая маленькая среди подобных трехатомных молекул (по отношению к гомологам, то есть водородным соединениям типа Н 2S, Н2Se, Н2Те, со свойствами которых традиционно сравнивают свойства воды). Такие молекулы при нормальных условиях образуют газы, а молекулы воды – жидкость. Почему?
Хаотичное сообщество газообразных молекул воды при конденсации, то есть при образовании жидкой фазы, формирует жидкое вещество удивительной сложности. В первую очередь это связано с тем, что молекулы воды обладают уникальным свойством объединяться в кластеры (группы) (Н2О)x.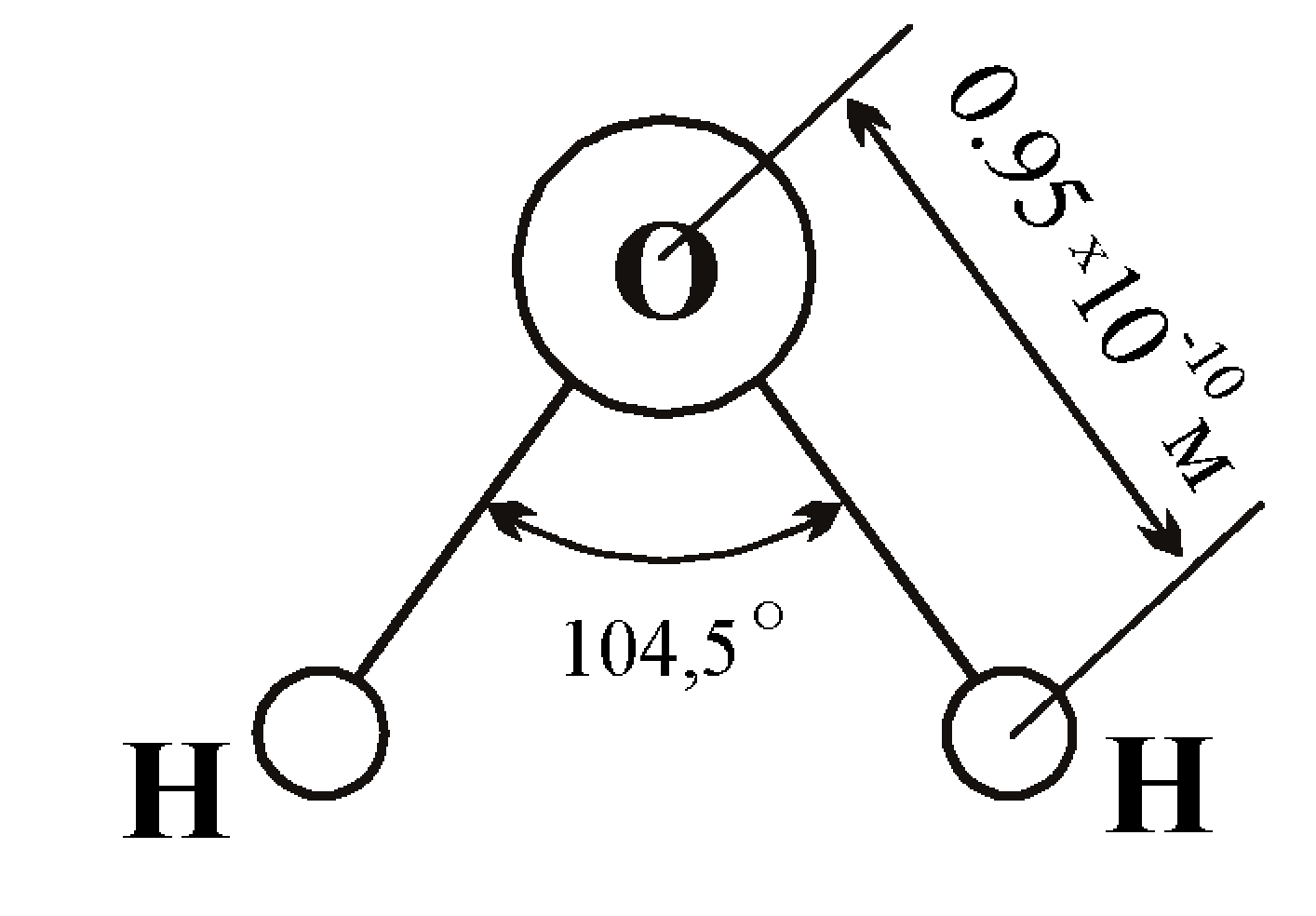 Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
При комнатной температуре степень ассоциации
Если бы вода при испарении оставалась в виде Н6О3, Н8О4 или Н12О6, то водяной пар был бы намного тяжелее воздуха, в котором доминируют молекулы азота и кислорода. В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
Людям крупно повезло: кластеры воды при испарении распадаются, и вода превращается практически в простой газ с химической формулой Н2О (обнаруженное в последнее время в паре незначительное количество димеров Н4О2 погоды не делает). Плотность газообразной воды меньше плотности воздуха, и поэтому вода способна насыщать своими молекулами земную атмосферу, создавая комфортные для человека погодные условия.
На Земле нет других веществ, наделенных способностью быть жидкостью при температурах существования человека и при этом образовывать газ не только легче воздуха, но и способный возвращаться к ее поверхности в виде осадков.
Восхитительная геометрия. Итак, какова же самая маленькая среди трехатомных
молекул? Молекула воды имеет симметричную V-образную форму, так как два небольших
атома водорода располагаются с одной стороны от сравнительно крупного атома
кислорода. Это сильно отличает молекулу воды от линейных молекул, например Н2Ве,
в которой все атомы располагаются цепочкой. Именно такое странное расположение
атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Это сильно отличает молекулу воды от линейных молекул, например Н2Ве,
в которой все атомы располагаются цепочкой. Именно такое странное расположение
атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Если внимательно рассмотреть геометрические параметры молекулы воды, то в ней обнаруживается определенная гармония. Чтобы увидеть ее, построим равнобедренный треугольник Н-О-Н с протонами в основании и кислородом в вершине. Такой треугольник схематично копирует структуру молекулы воды, проекция которой на плоскость условно изображена на рисунке.
Длины сторон этого треугольника и валентный угол между двумя связями О-Н изменяются при изменении агрегатного состояния воды. Приведем эти параметры (см. таблицу 2).
Прокомментируем данные, характеризующие различные состояния воды.
Параметры молекулы воды в парообразном состоянии получены на основе обработки спектров ее поглощения. Результаты неоднократно уточнялись, но по существу правильно оценивают длины связей и валентный угол в молекуле воды в состоянии пара.
Кристаллическая структура льда при нормальном давлении довольно рыхлая с причудливой паутиной связей между молекулами воды. Схематично кристаллическую решетку обычного льда можно построить из атомов кислорода, каждый из которых участвует с соседними атомами в четырех водородных связях, направленных приблизительно к вершинам правильного тетраэдра.
Напомним, что водородной называется связь между атомами в одной молекуле или между соседними молекулами, которая осуществляется через атом водорода. Водородная связь играет чрезвычайно важную роль в структуре не только воды, но и большинства биологических молекул – углеводов, белков, нуклеиновых кислот и т. п.
Если кристаллический лед хорошо упорядочен по кислороду, то этого нельзя сказать про водород: в расположении ионов водорода (протонов) наблюдается сильный беспорядок. Их положение четко не определено, и поэтому лед можно считать разупорядоченным по водороду.
Лед обладает многими удивительными особенностями, из которых отметим две.
Во-первых, он всегда очень чист химически. В структуре льда практически не бывает примесей: при замерзании они вытесняются в жидкость. Именно поэтому снежинки всегда белые, а льдинки на поверхности грязной лужи практически прозрачные. Вообще говоря, любой растущий кристалл стремится создать идеальную кристаллическую решетку и вытесняет посторонние вещества. Но в планетарном масштабе именно замечательный феномен замерзания и таяния воды играет роль гигантского очистительного процесса – вода на Земле постоянно очищает сама себя.
Во-вторых, лед и особенно снег обладают очень высокой отражательной способностью. Благодаря этому солнечное излучение не вызывает заметного нагрева полярных областей, и, как следствие этого, наша планета избавлена от сезонных наводнений и повышений уровня Мирового океана.
Экспериментальное определение параметров одиночной молекулы воды в жидкой фазе до сих пор встречает непреодолимые трудности, поскольку жидкая вода – это смесь структурных элементов, то есть различных кластеров, находящихся в динамическом равновесии между собой. Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: “простая” жидкость Н2О не торопится раскрывать свои внутренние секреты.
Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: “простая” жидкость Н2О не торопится раскрывать свои внутренние секреты.
Вернемся к рисунку, на котором в общих чертах представлена структура молекулы воды. В ней есть симметрия, которая играет основную роль в попытках всестороннего объяснения физического мира, и асимметрия, наделяющая эту молекулу возможностью движения и связью с золотой пропорцией. Поэтому кратко напомним о том, что в математике называют золотой пропорцией.
Золотая пропорция . Это понятие возникает при решении геометрической задачи о нахождении на отрезке АВ такой точки С, чтобы выполнялось соотношение СВ:АС = АС:АВ.
Решение этой задачи приводит к отношению СВ:АС = (-1+√5)/2, которое называют золотой пропорцией, а соответствующее геометрическое деление отрезка АВ точкой С называют золотым сечением. Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966….
Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966….
Время показало, что золотая пропорция воплощает совершенные и гармоничные отношения двух величин. В геометрической интерпретации она приводит к соразмерному и привлекательному соотношению между двумя неравными отрезками.
Исследователи золотой пропорции с античных времен до наших дней всегда восхищались и продолжают восхищаться ее свойствами, которые проявляются в строении различных элементов физического и биологического мира. Золотая пропорция обнаруживается везде, где соблюдены принципы гармонии.
Что же объединяет золотую пропорцию с молекулой воды? Чтобы ответить на этот вопрос, рассмотрим двумерный образ золотой пропорции в виде треугольника.
В золотом треугольнике отношение ОА:АВ = ОВ:АВ приблизительно равно 0,618,
угол α = 108,0о. Для льда отношение длин связей О-Н к Н-Н равно 0,100:0,163
= 0,613 и угол α = 109,5о, для пара – соответственно 0,631 и 104,5о. Не распознать в золотом треугольнике прообраз структуры молекулы воды просто
невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность
подобной интерпретации ее строения.
Не распознать в золотом треугольнике прообраз структуры молекулы воды просто
невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность
подобной интерпретации ее строения.
И действительно, поместив в треугольнике АОВ в точки А и В атомы водорода, а в точку О – атом кислорода, получим в первом приближении молекулу жидкой воды, сконструированную на основе золотой пропорции. Подобная элегантность молекулы очаровывает и восхищает. Так что роль молекулы воды в природе и жизни не может быть правильно оценена без учета красоты ее формы.
Исключительная гармония. Убедимся, что молекула жидкой воды – единственное трехатомное вещество, имеющее соразмерности, свойственные золотой пропорции.
В трехатомных молекулах-гомологах, близких по химическому составу к молекуле воды (Н2S, H2Se и Н2Те), валентный угол приблизительно равен 90о. Например, молекула Н2S имеет следующие геометрические параметры:
длина связи S-Н, нм . …………………… 0,1345
…………………… 0,1345
длина связи Н-Н, нм ……………………… 0,1938
валентный угол Н-S-Н, град ………….. 92,2
Отношение длин связей S-Н к Н-Н равно 0,694, что далеко от золотой пропорции. Квантово-химические расчеты показывают, что если бы вода была подобна родственным ей веществам, то валентный угол у ее молекулы должен был быть приблизительно таким же, как у Н2S, или больше максимум на 5о.
Но вода, как выясняется, не любит подобия, она всегда герой другого романа. Если бы валентный угол у воды был порядка 90-95о, о золотой пропорции пришлось бы забыть и вода оказалась бы в одном содружестве с другими водородными соединениями.
Но вода уникальна, ее молекула обладает практически выверенными эстетическими качествами, и поэтому ее свойства необходимо иногда интерпретировать, выходя за рамки традиционной научной парадигмы. И тогда некоторые загадки воды смогут быть объяснены таким “ненаучным” понятием, как гармония.
На приведенные рассуждения можно возразить: экспериментальные измерения геометрических параметров молекулы воды имеют определенную погрешность, и поэтому соотношение золотой пропорции может строго не выполняться. Но даже если в экспериментальные измерения внести еще большую погрешность, молекула воды все равно останется единственным из трехатомных веществ, имеющим практически “золотые” гармоничные пропорции.
В связи с этим обратим внимание на загадку талой воды, которая, по широко распространенному мнению, обладает отличным от обычной воды физиологическим воздействием.
Удивительная талая вода. Она рождается при таянии льда и сохраняет температуру 0оС, пока весь лед не растает. Специфика межмолекулярных взаимодействий, характерная для структуры льда, сохраняется и в талой воде, так как при плавлении кристалла разрушается только 15% всех водородных связей. Поэтому присущая льду связь каждой молекулы воды с четырьмя соседними (“ближний порядок”) в значительной степени не нарушается, хотя и наблюдается бoльшая размытость кислородной каркасной решетки.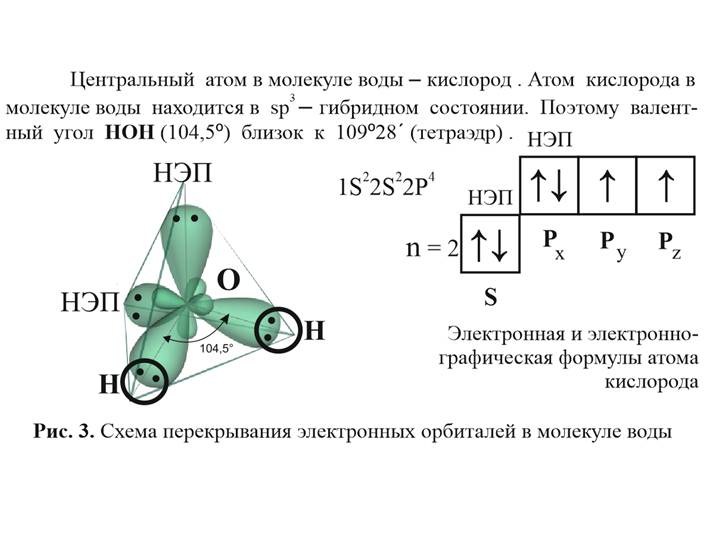
Таким образом, талая вода отличается от обычной изобилием многомолекулярных кластеров, в которых в течение некоторого времени сохраняются рыхлые льдоподобные структуры. После таяния всего льда температура воды повышается и водородные связи внутри кластеров перестают противостоять возрастающим тепловым колебаниям атомов. Размеры кластеров изменяются, и поэтому начинают меняться свойства талой воды: диэлектрическая проницаемость приходит к своему равновесному состоянию через 15-20 минут, вязкость – через 3-6 суток. Биологическая активность талой воды спадает, по одним данным, приблизительно за 12-16 часов, по другим – за сутки.
Итак, физико-химические свойства талой воды самопроизвольно меняются во времени, приближаясь к свойствам обычной воды: она постепенно как бы “забывает” о том, что еще недавно была льдом.
Лед и пар – различные агрегатные состояния воды, и поэтому логично предположить, что в жидкой промежуточной фазе валентный угол отдельной молекулы воды лежит в диапазоне между значениями в твердой фазе и в паре. В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
Значит, для обычной жидкой воды валентный угол вполне может иметь некоторое среднее значение между 109,5и 104,5о, то есть примерно 107,0о. Но так как талая вода по своей внутренней структуре близка ко льду, то и валентный угол ее молекулы должен быть ближе к 109,5о, скорее всего, около 108,0о.
Сказанное выше можно сформулировать в виде гипотезы: в силу того, что талая вода значительно более структурирована, чем обычная вода, ее молекула с большой долей вероятности имеет структуру, максимально приближенную к гармоничному треугольнику золотой пропорции с валентным углом, близким к 108о, и с отношением длин связей примерно 0,618-0,619.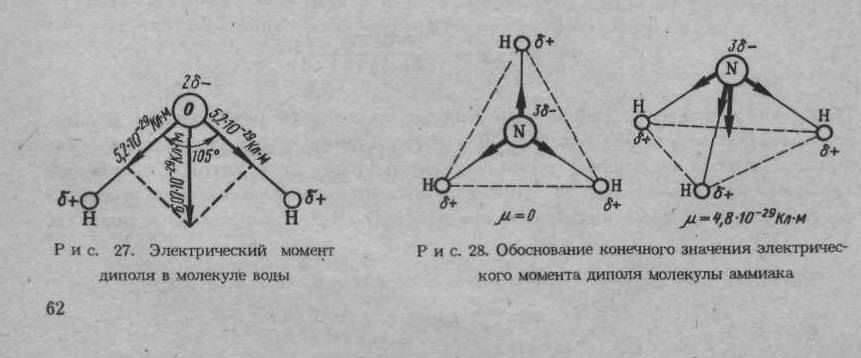
Экспериментального подтверждения этой гипотезы у авторов нет, как нет и какой-либо теории ее обоснования. Есть только догадка, высказанная на этих страницах, которая может, естественно, оспариваться.
Таинственная сила талой воды. Человеку с незапамятных времен известны удивительные свойства талой воды. Давно замечено, что вблизи тающих родников растительность альпийских лугов всегда пышнее, а у кромки тающего льда в арктических морях бурно цветет жизнь. Полив талой водой повышает урожайность сельскохозяйственных культур, ускоряет прорастание семян. При употреблении талой воды устойчиво повышаются привесы в животноводстве, ускоряется развитие цыплят. Известно, с какой жадностью животные пьют весной талую воду, а птицы буквально купаются в первых лужицах подтаявшего снега.
Талая вода, в отличие от обычной, по своей структуре очень похожа на жидкость, содержащуюся в клетках растительных и живых организмов. Именно поэтому для человека более подходит “ледяная” структура талой воды, в которой молекулы объединены в ажурные кластеры. Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты – они доставляют в организм воду, имеющую аналогичную структуру.
Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты – они доставляют в организм воду, имеющую аналогичную структуру.
При питье талой воды происходит подпитка организма самым гармоничным из всех веществ на Земле. Она улучшает обмен веществ и усиливает кровообращение, снижает количество холестерина в крови и успокаивает боли в сердце, повышает адаптационные возможности организма и способствует продлению жизни. Глоток чистейшей талой воды тонизирует лучше пастеризованного сока, в ней есть заряд энергии, бодрости и легкости.
Один из авторов этой работы постоянно пьет талую с плавающими льдинками воду и считает, что именно поэтому за три года ни разу не простудился. Талая вода освежает и молодит кожу, которая перестает нуждаться в кремах и лосьонах.
Теоретическое изучение свойств талой воды находится пока на уровне гипотез. Нет общепринятого мнения о причинах, вызывающих необычные эффекты при ее применении. Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности – все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности – все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Подчеркнем: приведенная гипотеза не претендует на расшифровку загадки талой воды. Она лишь позволяет выйти за рамки традиционного мышления и посмотреть на взаимную любовь жизни и воды с необычной стороны – со стороны гармонии и красоты, со стороны особых свойств талой воды, добавляющих ее изящной молекуле черты, которыми не обладают другие молекулы.
ЛИТЕРАТУРА
Ауэрбах Ф. Семь аномалий воды. – СПб., 1919.
Габуда С. П. Связанная вода. Факты и гипотезы. – Новосибирск: Наука, 1982.
Зацепина Г. Н. Физические свойства и структура воды. – М.: МГУ, 1998.
Синюков В. В. Вода известная и неизвестная. – М.: Знание, 1987.
– М.: Знание, 1987.
Белянин В. С., Романова Е. Золотая пропорция. Новый взгляд // Наука и жизнь, 2003, № 6.
Вода: структура, состояние, сольватизация. Достижения последних лет. – М.: Наука, 2003.
Подписи к иллюстрациям
Илл. 1. Плотность льда почти на 10% меньше, чем у воды, а удельный объем на столько же больше. Поэтому лед плавает, а вода, замерзая в трещинах горных пород, раскалывает их.
Опровергнута самая популярная теория строения воды
Учёные СФУ совместно с коллегами из Королевского института технологий Швеции опровергли самую популярную ныне кластерную теорию строения воды. В ходе работы исследователи предложили новую теорию, согласующуюся с результатами их эксперимента. Работа опубликована в журнале Nature Communications. Исследования поддержаны грантом Российского научного фонда.
Вода — одно из самых распространённых, но в то же время необычных веществ на Земле. Она обладает рядом нетипичных свойств, объясняемых её особой структурой, например, высокой теплоёмкостью и низкой электропроводностью. Общепринято, что вода состоит из молекул Н2О, объединённых в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода. Свободные, не входящие в кластеры (группы молекул, связанных водородными связями) молекулы присутствуют лишь в небольшом количестве. Многие учёные считают, что вода — постоянно изменяющаяся смесь кластеров лёгкого и тяжёлого типов. В первом молекулы связаны друг с другом (как во льду), а во втором связи нарушены, благодаря чему такие системы более плотные. Наличие этих фаз можно обнаружить при помощи резонансного неупругого рассеяния рентгеновских фотонов водой. При этом виден переход, в котором электрон с занятой молекулярной орбитали заполняет дырку, на месте которой был выбитый ранее фотоном электрон. Эксперимент с жидкой водой показывает расщепление резонанса на два пика.
Она обладает рядом нетипичных свойств, объясняемых её особой структурой, например, высокой теплоёмкостью и низкой электропроводностью. Общепринято, что вода состоит из молекул Н2О, объединённых в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода. Свободные, не входящие в кластеры (группы молекул, связанных водородными связями) молекулы присутствуют лишь в небольшом количестве. Многие учёные считают, что вода — постоянно изменяющаяся смесь кластеров лёгкого и тяжёлого типов. В первом молекулы связаны друг с другом (как во льду), а во втором связи нарушены, благодаря чему такие системы более плотные. Наличие этих фаз можно обнаружить при помощи резонансного неупругого рассеяния рентгеновских фотонов водой. При этом виден переход, в котором электрон с занятой молекулярной орбитали заполняет дырку, на месте которой был выбитый ранее фотоном электрон. Эксперимент с жидкой водой показывает расщепление резонанса на два пика. В научной литературе получившийся дублет приписывается кластерам лёгкого и тяжёлого типов.
В научной литературе получившийся дублет приписывается кластерам лёгкого и тяжёлого типов.
Чтобы пролить свет на эту фундаментальную проблему, авторы работы провели эксперимент с парами воды, где нет водородных связей. В ходе исследования они измерили спектр резонансного неупругого рассеяния изолированной молекулы. Эксперименты привели к неожиданному результату и показали, что точно такое же расщепление резонанса на два пика присутствует в рентгеновских спектрах рассеяний молекул воды в газовой фазе. Более того, выполненные теоретические расчёты однозначно объясняют расщепление на спектре сверхбыстрым распадом (диссоциацией) молекулы воды на ионы Н+ и ОН-. Таким образом, исследование свидетельствует о динамической природе расщепления резонанса и опровергает структурный механизм, тем самым демонстрируя, что структура воды однородна.
Второй не менее важный результат этой работы — получение детальной структурной информации о том, как влияют водородные связи на силу OH-связи. Колебательная инфракрасная (ИК) спектроскопия — общепринятый инструмент для исследования водородных связей в жидкостях. Но в них ИК-спектроскопия показывает лишь наиболее интенсивный переход в состояние с минимальной энергией колебаний, которое «слабо чувствует» межмолекулярное взаимодействие. Спектроскопия резонансного неупругого рассеяния воды качественно отличается от ИК-спектроскопии тем, что, получив энергию от рентгеновского фотона, электрон кислорода переходит с самой глубокой орбитали на первую незанятую. В результате молекула воды быстро диссоциирует. В процессе возбуждённый электрон переходит обратно на самый глубокий уровень, испуская рентгеновский фотон. Частота колебаний испущенного фотона отличается от возбуждающего фотона, так как при этом переходе электрон попадает на уровни с большей энергией. Таким образом, в отличие от ИК-спектра, спектр резонансного неупругого рассеяния состоит из протяжённого набора колебательных пиков. Чем выше колебательное состояние, тем дальше атомы водорода удаляются от кислорода в процессе колебаний связи между О и Н и тем сильнее это колебание чувствует взаимодействие с ближайшей молекулой воды, а именно водородную связь.
Но в них ИК-спектроскопия показывает лишь наиболее интенсивный переход в состояние с минимальной энергией колебаний, которое «слабо чувствует» межмолекулярное взаимодействие. Спектроскопия резонансного неупругого рассеяния воды качественно отличается от ИК-спектроскопии тем, что, получив энергию от рентгеновского фотона, электрон кислорода переходит с самой глубокой орбитали на первую незанятую. В результате молекула воды быстро диссоциирует. В процессе возбуждённый электрон переходит обратно на самый глубокий уровень, испуская рентгеновский фотон. Частота колебаний испущенного фотона отличается от возбуждающего фотона, так как при этом переходе электрон попадает на уровни с большей энергией. Таким образом, в отличие от ИК-спектра, спектр резонансного неупругого рассеяния состоит из протяжённого набора колебательных пиков. Чем выше колебательное состояние, тем дальше атомы водорода удаляются от кислорода в процессе колебаний связи между О и Н и тем сильнее это колебание чувствует взаимодействие с ближайшей молекулой воды, а именно водородную связь. Резонансное неупругое рассеяние даёт уникальную возможность исследовать водородные связи, в частности определить на основании спектра, как влияют соседние молекулы через водородную связь на потенциал взаимодействия OH-связи.
Резонансное неупругое рассеяние даёт уникальную возможность исследовать водородные связи, в частности определить на основании спектра, как влияют соседние молекулы через водородную связь на потенциал взаимодействия OH-связи.
«Важно отметить, что, в отличие от изолированной молекулы воды с одной энергией взаимодействия О и Н, в жидкости имеется набор (распределение) таких энергий в силу многообразия ближайшего окружения молекулы воды. Таким образом, второй результат работы — измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с её окружением, а значит, и такие свойства, как скорость звука в воде и её теплоёмкость»,— дополняет Фарис Гельмуханов, доктор физико-математических наук, профессор Королевского технологического института (Стокгольм, Швеция), старший научный сотрудник Сибирского федерального университета.
В работе также приняли участие учёные из Университета Потсдама (Германия), Университета Цюриха (Швейцария) и Университета Турку (Финляндия).
Рисунки
- A) Молекула воды, поглотив фотон, возбуждается из основного состояния (0) в высоковозбуждённое диссоциативное состояние (с), где атом водорода быстро покидает точку равновесия. В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.
- Б) рентгеновский спектр поглощения воды.
- B) Спектры испускания c→f и c→0 вблизи 526 эВ и 535 эВ, соответственно. Эмиссионный спектр c→f вблизи 525 эВ показывает динамическое формирование (в процессе диссоциации) дублета с расщеплением Δ (см. панель A). При возвращении молекулы в основное состояние c→0 в процессе диссоциации заселяются высокие колебательные уровни, что формирует протяжённую колебательную прогрессию в районе 535 эВ.

- Г) В работе решена обратная задача восстановления из колебательной прогрессии распределения OH-потенциалов воды в жидкой фазе.
Молекулярная геометрия воды и валентные углы
Вода является наиболее распространенным ресурсом, поскольку все океаны, моря, реки и водоемы состоят из воды. Когда мы впервые начинаем заниматься, мы узнаем, что химическая формула воды – h3O. Это означает, что в одной молекуле воды два атома водорода и один атом кислорода. Другое название молекулы воды — монооксид дигидрогена (состоящий из двух атомов водорода и одного атома кислорода). Как и все другие химические соединения, вода также имеет связи, и здесь мы обсудим геометрию и углы, которые образует соединение воды.
Структура научно известна как структура Льюиса, а в народе называется электронно-точечной структурой, что означает, что она схематически представляет молекулу воды. Это, в свою очередь, делает известным число валентных электронов или электронов в последней оболочке атома. Количество валентных электронов обеспечивает количество электронов, которые могут свободно создавать связи, а затем соединение. Предсказание геометрической формы молекулы воды сделано на основе теории отталкивания валентно-оболочечных электронных пар (VSEPR).
Количество валентных электронов обеспечивает количество электронов, которые могут свободно создавать связи, а затем соединение. Предсказание геометрической формы молекулы воды сделано на основе теории отталкивания валентно-оболочечных электронных пар (VSEPR).
Характеристики молекулярной геометрии воды:
Две неподеленные пары
Двухэлектронные пары расположены в вершинах молекулы. Эти пары одиноки, так как они не образуют связи с соседними атомами водорода. Неподеленные пары кислорода существуют на валентной оболочке атома кислорода.
V-образная геометрия
Всего в молекуле воды заняты две вершины. Это объясняет, как происходит V-образное образование неподеленных пар электронов. Вот почему молекула не имеет линейной формы.
Угол между 104,5 и 109
С помощью теории VSEPR ученые могут предсказать угол между связями двух атомов водорода. Они могут сказать, что типичная тетраэдрическая молекула имеет угол 1090. Однако в случае молекулы воды угол меньше, чем обычно. В случае молекулы аммония угол еще больше.
Однако в случае молекулы воды угол меньше, чем обычно. В случае молекулы аммония угол еще больше.
Изогнутая геометрическая структура
Изогнутая геометрическая структура одиночной молекулы воды. Чтобы молекула имела изогнутую структуру, в ней должна быть пара неподеленных электронов. Эти неподеленные пары электронов отталкивают водородную связь, делая геометрию всей молекулы изогнутой в форме буквы V.
Геометрическая структура, называемая структурой Льюиса
Структура молекулы воды, называемая структурой Льюиса, определяет, что всего имеется 8 валентных электронов, которые помогают формировать связи в трехатомной молекуле воды. С двумя атомами водорода и одним атомом кислорода.
Тетраэдрический изгиб
Вся молекула является тетраэдрической, так как на самой внешней оболочке молекулы находится 8 электронов. Они образуют две водородные связи, и во внешней оболочке есть две пары неподеленных электронов.
Гибридная молекула h3O
Известно, что сигма-связи в системе связей являются самыми прочными из существующих ковалентных связей. Связи, которые образуются между атомами кислорода и водорода в молекуле воды, имеют сигма-(σ)-связи и не имеют пи(π)-связей. Гибридизация атомов кислорода представляет собой sp3, что означает, что она возможна только при наличии двух неподеленных пар электронов кислорода. Всего имеется четыре орбиты: одна 2s-орбиталь и три 2p-орбитали.
Вывод
Всего существует две связи, которые один атом кислорода образует с атомами водорода. Связи, которые атом кислорода образует с атомами водорода, являются самой прочной связью, называемой сигма-связью. Угол, который образует эта связь, входит в тетраэдрические связи. Угловое расстояние между тетраэдрическими связями составляет 1090, но угловое расстояние между водородными связями составляет 104,50. Связи смещаются вниз из-за пары двух неподеленных электронов, присутствующих в вершинах молекулы, образуя изогнутую геометрическую структуру.
CHEM 245 – Вода
ТЕМЫ БИОХИМИИ
Вода
Вода 101. Дальнейшие последствия использования воды как биологического растворителя.
Вода (H 2 O) — знакомое, но увлекательное вещество. Это дает нам возможность рассмотреть свойства трех фаз материи – газообразная, жидкая и твердая фазы — на знакомом и важном примере. Вода является одновременно кислотой и основанием, и является эффективным катализатором реакций переноса протона. Вода играет центральную роль в жизни и биохимических процессах, происходящих в живых организмах. Поскольку большая часть земной поверхности покрыта водой, ее свойства оказывают огромное влияние. на планетарную среду, позволяющую и поддерживающую развитие биосферы.
Структура молекулы воды
Для начала давайте создадим структуру Льюиса для молекулы воды на основе ее молекулярного
формула, H 2 O. Символы Льюиса для элементов
показаны на панели (а) ниже: кислород имеет шесть валентных электронов, а водород только один.
На панели (b) показано, как соединить три атома вместе, чтобы сформировать полный октет для центрального
атом кислорода. Водород, как элемент с периодом 1, может разместить только два электрона в своей валентности.
оболочки и образует только одну связь. На панели (c) мы применили условное обозначение, согласно которому два общих электрона, образующих химическую связь между атомами, могут быть представлены линией. Имея действительную структуру Льюиса, мы можем сделать вывод о молекулярной геометрии молекулы воды. Октет центрального кислорода можно рассматривать как состоящий из четырех электронных доменов, двух связывающих пар и двух несвязывающих «одиноких пар». Применение теории VSEPR к этой конфигурации приводит к выводу, что эти четыре электронных домена – в первом приближении – расположены вокруг центрального кислорода в виде тетраэдра. Основной вывод, который из этого следует, заключается в том, что расположение атомов в молекуле H-O-H не прямолинейное, а изогнутое, при этом валентный угол должен быть близок к тетраэдрическому значению, 1090,5°. Поскольку неподеленные пары распределяют отрицательный заряд по большему объему, чем связывающие пары, электростатическое отталкивание сближает связующие пары, поэтому фактический угол связи должен быть немного меньше 109,5 °. Как мы покажем ниже, мы также можем использовать структуру Льюиса, чтобы проанализировать, имеет ли молекула воды полярность.
Поскольку неподеленные пары распределяют отрицательный заряд по большему объему, чем связывающие пары, электростатическое отталкивание сближает связующие пары, поэтому фактический угол связи должен быть немного меньше 109,5 °. Как мы покажем ниже, мы также можем использовать структуру Льюиса, чтобы проанализировать, имеет ли молекула воды полярность.
То, что мы называем «формой молекулы», — это то, что мы видим, когда смотрим только на атомы, из которых состоит молекула. Экспериментальные методы, такие как рентгеновская кристаллография, которые могут определить положение атомов в молекулах, позволяют определить форму молекулы воды. На приведенных ниже диаграммах представлена экспериментально определенная молекулярная форма.
В соответствии с нашим анализом с использованием формализма Льюиса, вода имеет угловатую или изогнутую форму с валентным углом HOH, равным 104,5 °. Это согласуется с примерно тетраэдрической ориентацией четырех электронных доменов вокруг центрального кислорода, двух связывающих пар и двух несвязывающих «неподвижных пар».
Длина связи H-O составляет 0,958 Å (1 Å = 10 -10 м). Поскольку кислород значительно более электроотрицательный, чем водород, большая часть отрицательного заряда электронов в связывающей паре сосредоточена вблизи кислорода. Это небольшое разделение зарядов вдоль оси отдельной связи (обозначаемое обозначением δ) создает связь диполь . Диполи связи можно рассматривать как векторов и суммировать, чтобы получить другой вектор, молекулярный дипольный момент .
Выше : два изображения молекулярной формы молекулы воды: шарообразная (вверху) и заполняющая пространство (внизу). Кислород — это центральный атом, показанный красным цветом, а атомы водорода — светло-серым.
Если молекула имеет ненулевой дипольный момент. говорят, что это полярный , либо иметь полярность . Для геометрии молекулы воды компоненты диполя связи, параллельные линии, разделяющей пополам угол связи HO (пунктирная вертикальная линия на рисунке), складываются вместе, а перпендикулярные (горизонтальные) компоненты компенсируются. Это приводит к тому, что чистый дипольный момент выровнен с биссектрисой валентного угла с отрицательным концом, направленным вверх (стрелка на правой панели выше). Таким образом, молекула воды обладает значительным дипольным моментом, который можно смоделировать как вертикально ориентированное частичное разделение зарядов (обозначено на рисунке знаком ξ). Другими словами, молекула воды полярна.
Это приводит к тому, что чистый дипольный момент выровнен с биссектрисой валентного угла с отрицательным концом, направленным вверх (стрелка на правой панели выше). Таким образом, молекула воды обладает значительным дипольным моментом, который можно смоделировать как вертикально ориентированное частичное разделение зарядов (обозначено на рисунке знаком ξ). Другими словами, молекула воды полярна.
Если показать на этих изображениях, неподеленные пары будут выступать вверх от кислорода. вперед из плоскости и назад за плоскость рисунка (см. следующий рисунок ниже).
Свойства воды
Наше рассмотрение свойств воды может служить парадигмой для достижения одной из самых фундаментальных целей изучения химии. То есть ответить на вопрос: как наноразмерные молекулярные свойства воды объясняют свойства, которые мы наблюдаем у вещества в целом, в макроскопическом масштабе? Чтобы ответить на этот вопрос, мы воспользуемся «расширенной» версией структуры Льюиса для молекулы воды, показанной ниже справа.
Учитывая структурную интерпретацию молекулы воды, что межмолекулярных сил могли бы мы предсказать, что они будут играть важную роль в определении его объемные свойства? Диаграмма справа показывает геометрию молекулы воды, полярность ее связей, молекулярный дипольный момент и ориентация неподеленных пар. Вода не только полярная молекула, но и может образовывать межмолекулярные соединения. водородные связи (Н-связи). Относительно сильные межмолекулярные силы, возникающие в результате диполь-дипольных взаимодействий и взаимодействий Н-связей. учитывать такие свойства, как высокая температура кипения для небольшой молекулы, высокая энтальпия парообразования , большая теплоемкость , способность растворять полярные и многие ионные соединения.
Фактически, вода является образцом в мире молекул с водородными связями. Каждая молекула воды имеет две неподеленные пары, которые служат акцепторами водородных связей, а две связи OH обеспечивают пару доноров водородных связей. На рисунке слева изображена одна Н-связь между двумя молекулами воды. Крайняя левая молекула воды является донором водородной связи, а молекула воды справа является акцептором водородной связи.
На рисунке слева изображена одна Н-связь между двумя молекулами воды. Крайняя левая молекула воды является донором водородной связи, а молекула воды справа является акцептором водородной связи.
Структура льда
Структура льда показывает способность молекул воды образовывать межмолекулярные водородные связи или Н-связи (обозначены пунктирными линиями на рисунке справа) в ее максимуме. Каждая молекула воды внутри решетки (то есть не на поверхности) образует водородные связи с четырьмя соседями, принимая двух доноров водородных связей у своего центрального атома кислорода и отдавая две водородные связи через два своих атома водорода. Таким образом, каждая внутренняя вода полностью связана водородными связями, а общая структура образует трехмерную гексагональную решетку молекул воды. Обширные водородные связи придают прочность ледяной решетке, но в то же время дают относительно открытую структуру. Это объясняет тот факт, что при температуре плавления или около нее жидкая вода имеет большую плотность, чем лед. Когда структура льда тает, некоторые водородные связи разрываются, и менее жестко связанные молекулы воды могут приблизиться друг к другу в среднем немного ближе.
Когда структура льда тает, некоторые водородные связи разрываются, и менее жестко связанные молекулы воды могут приблизиться друг к другу в среднем немного ближе.
Вода как растворитель
Способность воды действовать как растворитель связана с полярностью молекулы воды, а также с ее способностью образовывать водородные связи с растворенными веществами. Как мы видели, молекула воды полярна, и ее дипольный момент можно представить в виде вектора, делящего пополам валентный угол H-O-H. Дипольный момент молекулы действует аналогично стержневому магниту в магнитном поле. Отрицательный конец диполя будет иметь тенденцию ориентироваться на положительно заряженные частицы, в то время как наличие отрицательного заряда будет притягивать положительный конец диполя. Таким образом, выравнивание диполя с локальным электрическим полем снижает электростатическую потенциальную энергию, что делает выравнивание предпочтительным.
На рисунке справа показано, как это работает для ионов, образующихся в результате растворения хлорида натрия (NaCl) в воде. При растворении ионы, составляющие соль, диссоциируют от твердой кристаллической решетки. Благоприятные электростатические взаимодействия ионных связей решетки теряются, повышая потенциальную энергию, но диполь-ионные взаимодействия помогают компенсировать это. Молекулы воды вблизи ионов ориентируют свои дипольные моменты в соответствии с зарядами ионов – положительные концы их диполей в сторону хлорид-аниона; отрицательные концы диполя молекулы воды направлены в сторону катионов натрия. Это называется гидратация или вода , а вовлеченные молекулы воды называются водой гидратации (или аквацией).
При растворении ионы, составляющие соль, диссоциируют от твердой кристаллической решетки. Благоприятные электростатические взаимодействия ионных связей решетки теряются, повышая потенциальную энергию, но диполь-ионные взаимодействия помогают компенсировать это. Молекулы воды вблизи ионов ориентируют свои дипольные моменты в соответствии с зарядами ионов – положительные концы их диполей в сторону хлорид-аниона; отрицательные концы диполя молекулы воды направлены в сторону катионов натрия. Это называется гидратация или вода , а вовлеченные молекулы воды называются водой гидратации (или аквацией).
Растворимость данного ионного соединения в воде в значительной степени определяется
энергетический баланс между ионными связями в твердом состоянии
(плюс водородные связи между молекулами воды в жидком состоянии) по сравнению с ионно-дипольными взаимодействиями
между растворенными и растворяющими веществами в растворе.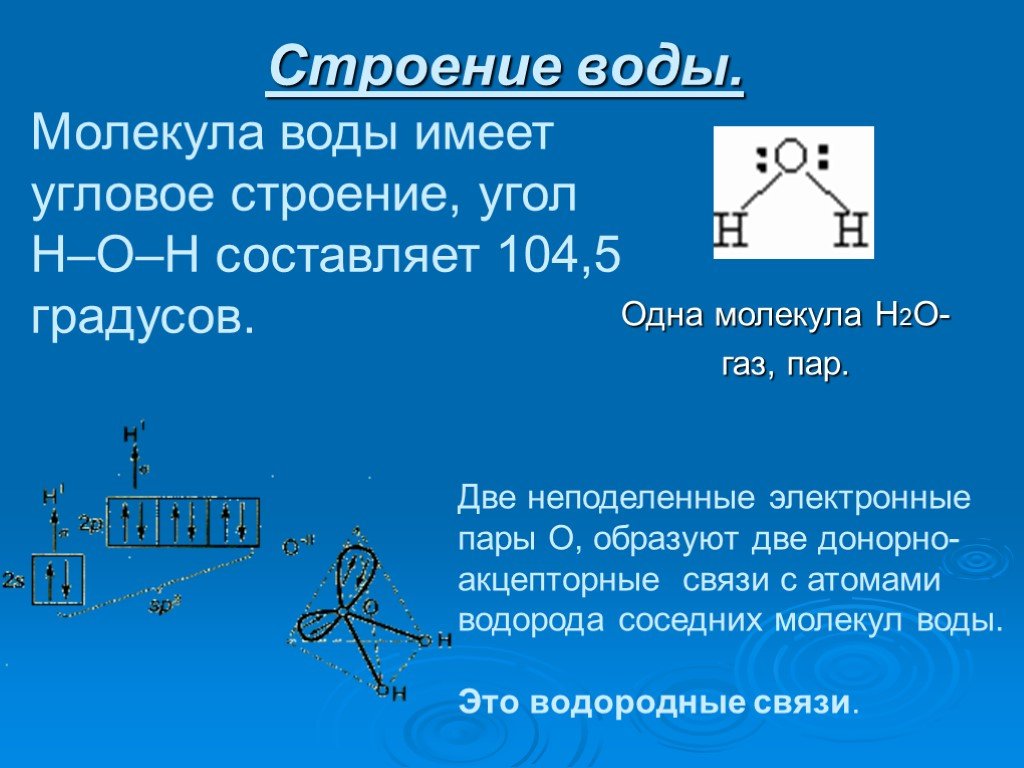 Мы знаем, что не все ионогенные соединения свободно растворимы в воде.
и мы можем полагаться на эмпирические правила разрешимости чтобы помочь нам ответить на вопрос, растворимо ли данное ионное соединение в воде. Но приведенные выше соображения об энергетике ионных связывающих и несвязывающих взаимодействий во многом определяют правила растворимости. Кроме того, по сравнению с менее полярным растворителем (таким как метанол) или растворителем, не обладающим плаарной активностью (таким как гексан или бензол), вода является гораздо более эффективным растворителем для ионных соединений. Неполярные или слабополярные растворители далеко не так эффективны при сольватации диссоциированных ионов, как вода, поэтому нам не нужны правила растворимости ионных соединений в таких растворителях — мы бы однозначно предсказывали, что ионные соединения нерастворимы в неполярных растворителях.
Мы знаем, что не все ионогенные соединения свободно растворимы в воде.
и мы можем полагаться на эмпирические правила разрешимости чтобы помочь нам ответить на вопрос, растворимо ли данное ионное соединение в воде. Но приведенные выше соображения об энергетике ионных связывающих и несвязывающих взаимодействий во многом определяют правила растворимости. Кроме того, по сравнению с менее полярным растворителем (таким как метанол) или растворителем, не обладающим плаарной активностью (таким как гексан или бензол), вода является гораздо более эффективным растворителем для ионных соединений. Неполярные или слабополярные растворители далеко не так эффективны при сольватации диссоциированных ионов, как вода, поэтому нам не нужны правила растворимости ионных соединений в таких растворителях — мы бы однозначно предсказывали, что ионные соединения нерастворимы в неполярных растворителях.
Для молекулярных соединений вода обычно является отличным растворителем для соединений с полярными молекулами. и тем более для полярных молекул, способных образовывать Н-связи с молекулами воды.
и тем более для полярных молекул, способных образовывать Н-связи с молекулами воды.
Вода и жизнь
Хотя они достаточно сложны и неоднородны по строению и составу, живые клетки в значительной степени представляют собой водные системы. Тот факт, что вода в основном является жидкостью в широком диапазоне температур, характерных для земной поверхности, и ее способность растворять самые разнообразные соединения, делает возможным существование таких сложных систем. Воду по праву можно назвать растворителем жизни. Конечно, если мы хотим понять биологическую химию, нам следует тщательно изучить свойства воды.
В связи с этим часто упоминается необычное свойство воды образовывать твердое тело с меньшей плотностью, чем в жидком состоянии. Относительно открытая структура льда максимизирует способность водородных связей составляющих его молекул воды, что делает эту открытую структуру энергетически выгодной. Когда лед тает, часть водородных связей разрывается, что позволяет молекулам воды в среднем приближаться друг к другу немного ближе. Таким образом, жидкая вода, находящаяся в равновесии со льдом при 0°С, более плотна, чем лед, который плавает. Вода имеет максимальную плотность в жидком состоянии при температуре 4°C. Это имеет огромные последствия для биосферы Земли. Озера и океаны замерзали бы снизу вверх, если бы лед был плотнее воды. Это привело бы к тому, что большая часть воды на Земле оказалась бы запертой в виде льда.
Таким образом, жидкая вода, находящаяся в равновесии со льдом при 0°С, более плотна, чем лед, который плавает. Вода имеет максимальную плотность в жидком состоянии при температуре 4°C. Это имеет огромные последствия для биосферы Земли. Озера и океаны замерзали бы снизу вверх, если бы лед был плотнее воды. Это привело бы к тому, что большая часть воды на Земле оказалась бы запертой в виде льда.
Среди химических свойств воды следует особо отметить то, что она является одновременно и очень слабой кислотой, и очень слабым основанием, и между молекулами воды происходят реакции переноса протона
H 2 O( l ) + H 2 O( l ) = H 3 O + ( aq ) + OH − ( aq ) К w = [ H + ][ OH – ] = 1,0 × 10 −14 (при 25°C).
Это так называемое автоионизация реакция происходит только в очень небольшой степени, о чем свидетельствует небольшая величина K w , но это равновесие составляет основу химии
водных смесей кислых и основных растворенных веществ.


