ЖИЗНЬ, МОЛЕКУЛА ВОДЫ И ЗОЛОТАЯ ПРОПОРЦИЯ
Соотношения золотой пропорции исследователи находят в морфологической структуре растений, птиц, животных, человека. Закономерности золотой пропорции обнаруживаются и в организации неживой природы. В данной статье на основании анализа молекулы воды в различных агрегатных состояниях высказана гипотеза, что ее структура в состоянии талой воды практически соответствует треугольнику золотой пропорции.
Наука и жизнь // Иллюстрации
Теплоемкость воды достигает минимального значения при температуре около 37<SUP>о</SUP>С.
Наука и жизнь // Иллюстрации
Илл. 1. Плотность воды при понижении температуры сначала возрастает, достигает максимума при 4<SUP>о</SUP>С и начинает уменьшаться.
Наука и жизнь // Иллюстрации
В момент плавления объем свинца мгновенно увеличивается от 1 до 1,003, а объем воды скачком уменьшается от 1,1 до 1,0.
Наука и жизнь // Иллюстрации
Вода имеет аномально высокие температуры кипения и замерзания по сравнению с другими трехатомными соединениями водорода.
Наука и жизнь // Иллюстрации
В жидкой воде молекулы H<SUB>2</SUB>O могут объединяться в сложные образования – кластеры, по структуре напоминающие лед.
Наука и жизнь // Иллюстрации
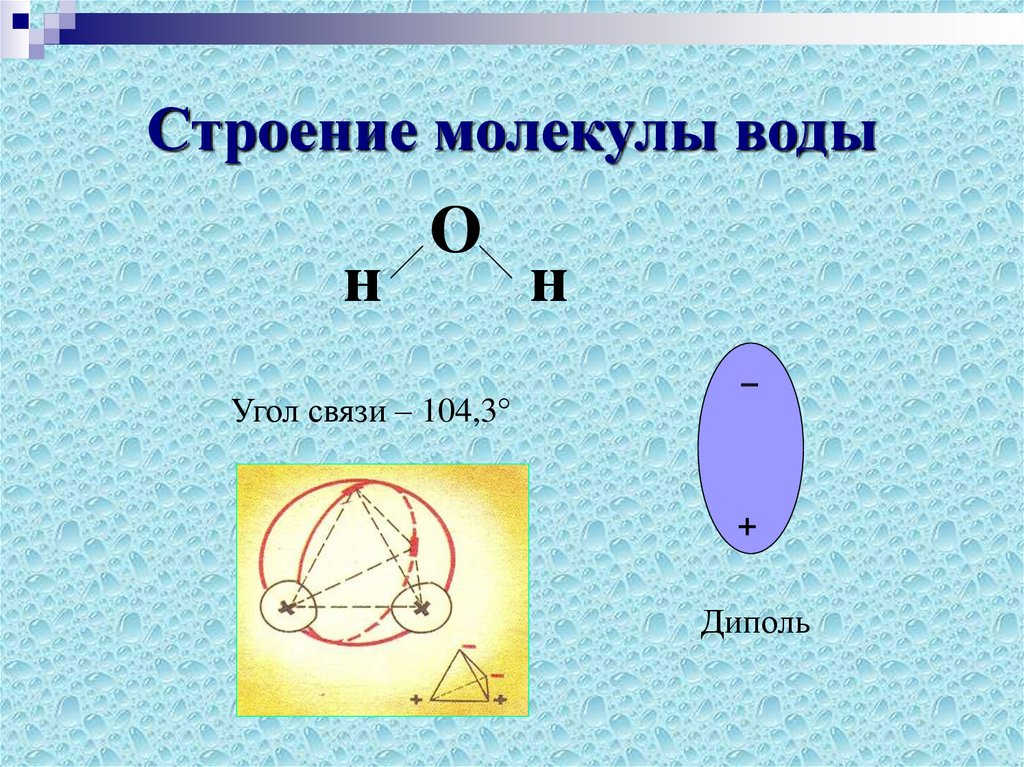
Схематичное изображение молекулы воды на плоскости.
Деление отрезка в крайнем и среднем отношении, или золотая пропорция. Отрезок разделен на две части так, что CB:AC = AC:AB.
“Золотой треугольник”. Соотношение его сторон OA:AB = OB:AB ≈ 0,618,
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Таблица 1.
Таблица 2.
‹
›
Открыть в полном размере
Воде была дана волшебная власть стать соком жизни на Земле.
Леонардо да Винчи
Вода – одно из самых уникальных и загадочных веществ на Земле. Природа этого вещества до конца еще не понята. Внешне вода кажется достаточно простой, в связи с чем долгое время считалась неделимым элементом. Лишь в 1766 году Г.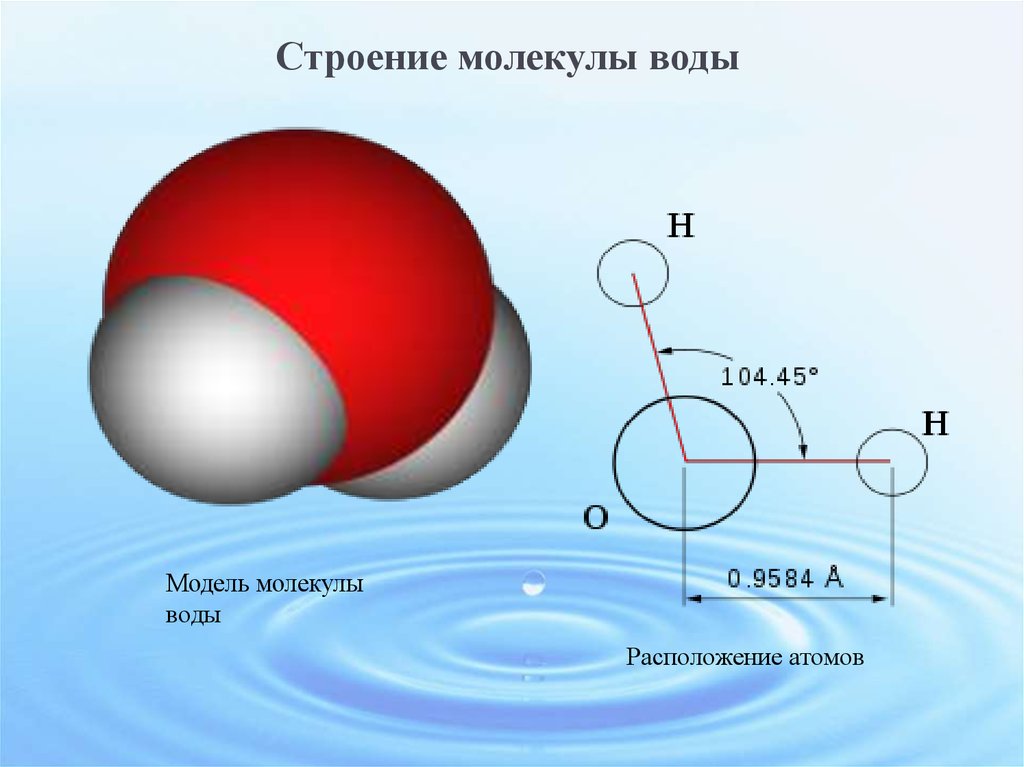
Дальнейшие исследования показали, что за незатейливой химической формулой Н2О скрывается вещество, обладающее уникальной структурой и не менее уникальными свойствами. Исследователи, пытавшиеся на протяжении двух с лишним столетий раскрыть секреты воды, часто заходили в тупик. Да и сейчас ученые понимают, что вода остается трудным объектом для исследований, ее свойства до сих пор не всегда до конца прогнозируемы.
Загадочная магия воды. Почему жидкая вода имеет необычные свойства? Традиционный ответ может быть следующим: из-за свойств атомов кислорода и водорода, из-за их структурного расположения в молекуле, из-за определенного поведения электронов в молекуле и т. п.
п.
Так в чем же заключаются загадочные, необычные свойства привычной всем жидкой воды? Прежде всего, в том, что практически все свойства воды аномальны, а многие из них не подчиняются логике тех законов физики, которые управляют другими веществами. Кратко упомянем те из них, которые обуславливают существование жизни на Земле.
Вначале о трех особенностях тепловых свойств воды.
Первая особенность: вода – единственное вещество на Земле (кроме ртути), для которого зависимость удельной теплоемкости от температуры имеет минимум.
Из-за того, что удельная теплоемкость воды имеет минимум около 37оС, нормальная температура человеческого тела, состоящего на две трети из воды, находится в диапазоне температур 36-38оС (внутренние органы имеют более высокую температуру, чем наружные).
Вторая особенность: теплоемкость воды аномально высока. Чтобы нагреть определенное ее количество на один градус, необходимо затратить больше энергии, чем при нагреве других жидкостей, – по крайней мере вдвое по отношению к простым веществам. Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Таким образом, вода играет главенствующую роль в процессах регулирования теплообмена человека и позволяет ему поддерживать комфортное состояние при минимуме энергетических затрат. При нормальной температуре тела человек находится в наиболее выгодном энергетическом состоянии.
Температура других теплокровных млекопитающих (32-39оС) также хорошо соотносится с температурой минимума удельной теплоемкости воды.
Третья особенность: вода обладает высокой удельной теплотой плавления, то есть воду очень трудно заморозить, а лед – растопить. Благодаря этому климат на Земле в целом достаточно стабилен и мягок.
Все три особенности тепловых свойств воды позволяют человеку оптимальным образом существовать в условиях благоприятной среды.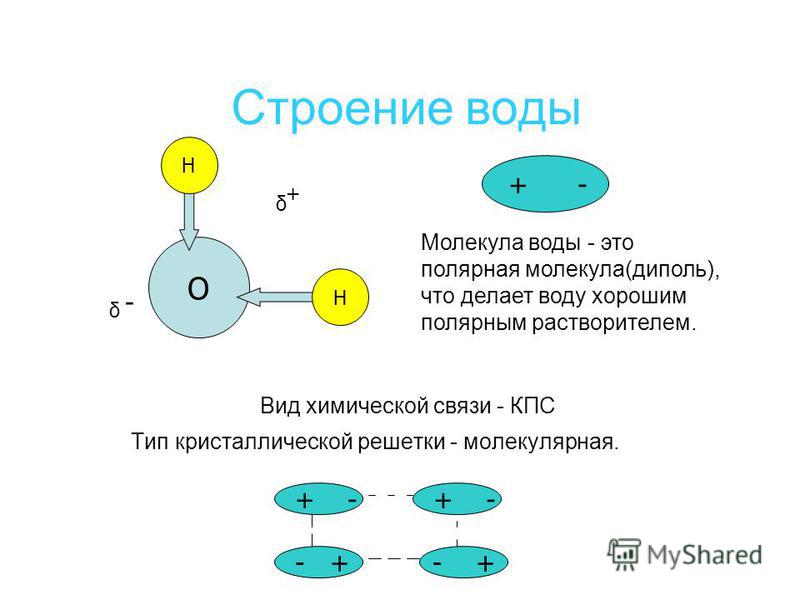
Имеются особенности и в поведении объема воды. Плотность большинства веществ – жидкостей, кристаллов и газов – при нагревании уменьшается и при охлаждении увеличивается, вплоть до процесса кристаллизации или конденсации. Плотность воды при охлаждении от 100 до 4 оС (точнее, до 3,98оС) возрастает, как и у подавляющего большинства жидкостей. Однако, достигнув максимального значения при температуре 4оС, плотность при дальнейшем охлаждении воды начинает уменьшаться. Другими словами, максимальная плотность воды наблюдается при температуре 4оС (одна из уникальных аномалий воды), а не при температуре замерзания 0оС.
Замерзание воды сопровождается скачкообразным(!) уменьшением плотности более чем на 8%, тогда как у большинства других веществ процесс кристаллизации сопровождается увеличением плотности. В связи с этим лед (твердая вода) занимает больший объем, чем жидкая вода, и держится на ее поверхности.
Столь необычное поведение плотности воды крайне важно для поддержания жизни на Земле.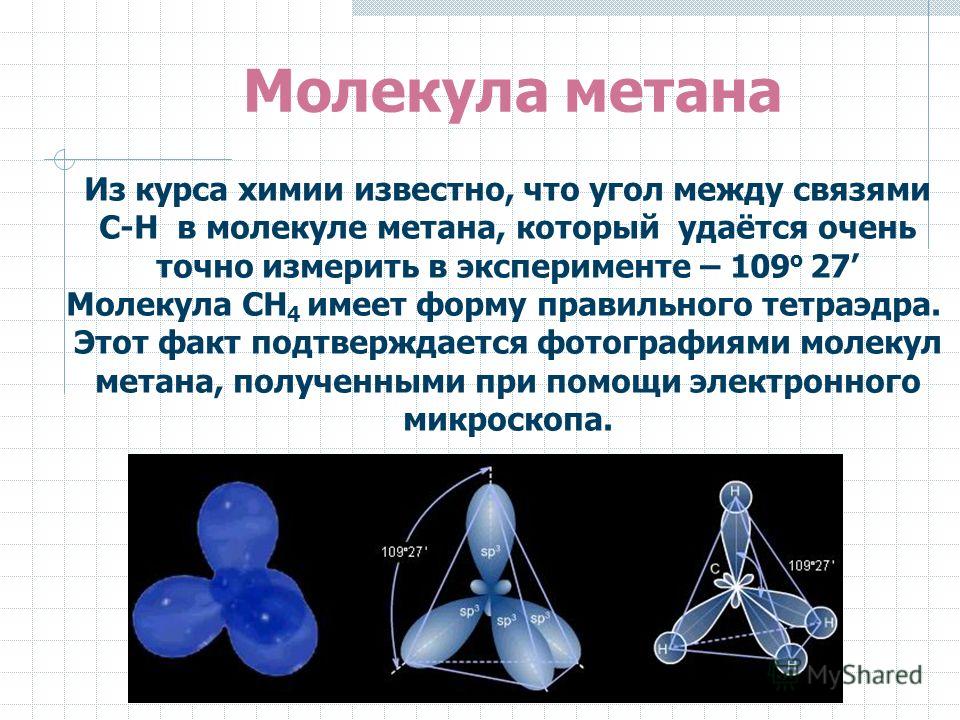
Покрывая воду сверху, лед играет в природе роль своего рода плавучего одеяла, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Отметим еще некоторые особенности воды.
Внешне вода подвижна и податлива, и ее можно заключить в любой сосуд. Однако, проникая в трещины горных пород и расширяясь при замерзании, вода раскалывает скальные породы любой твердости, которые постепенно распадаются на все более мелкие частицы. Так начинается возврат окаменевших пород в жизненный цикл: на полях промерзание поверхностных слоев земли с ее органическими компонентами помогает образованию плодородной почвы.
Процесс включения твердых веществ в большой круговорот живой природы ускоряется чудесным свойством воды их растворять.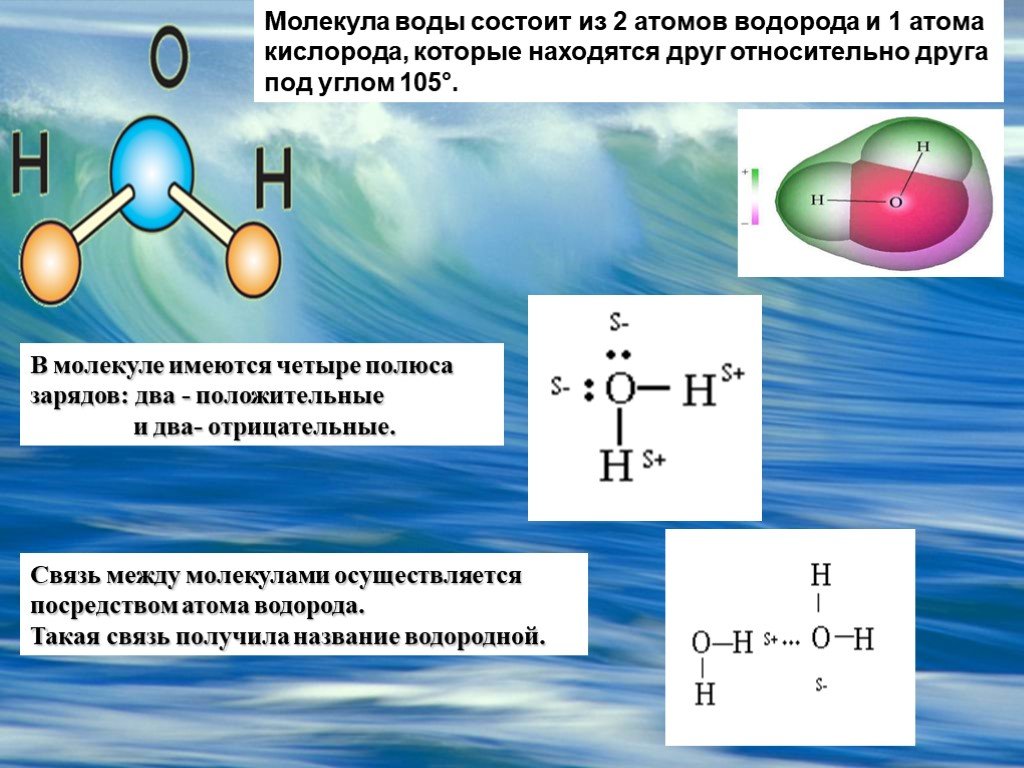
Вода сильнее других жидкостей проявляет свойства универсального растворителя. Если ей дать достаточно времени, она может растворить практически любое твердое вещество. Именно из-за уникальной растворяющей способности воды никому до сих пор не удалось получить химически чистую воду – она всегда содержит растворенный материал сосуда. Вода абсолютно необходима для всех ключевых систем жизнеобеспечения человека. Она содержится в человеческой крови (79%) и способствует переносу по кровеносной системе в растворенном состоянии тысяч необходимых для жизни веществ. Вода содержится в лимфе (96%), которая разносит из кишечника питательные вещества по тканям живого организма (см. таблицу 1).
Перечисленные свойства и особая роль воды в обеспечении жизни на Земле не могут оставить равнодушным ни один пытливый ум, даже если он верит в счастливые случайности.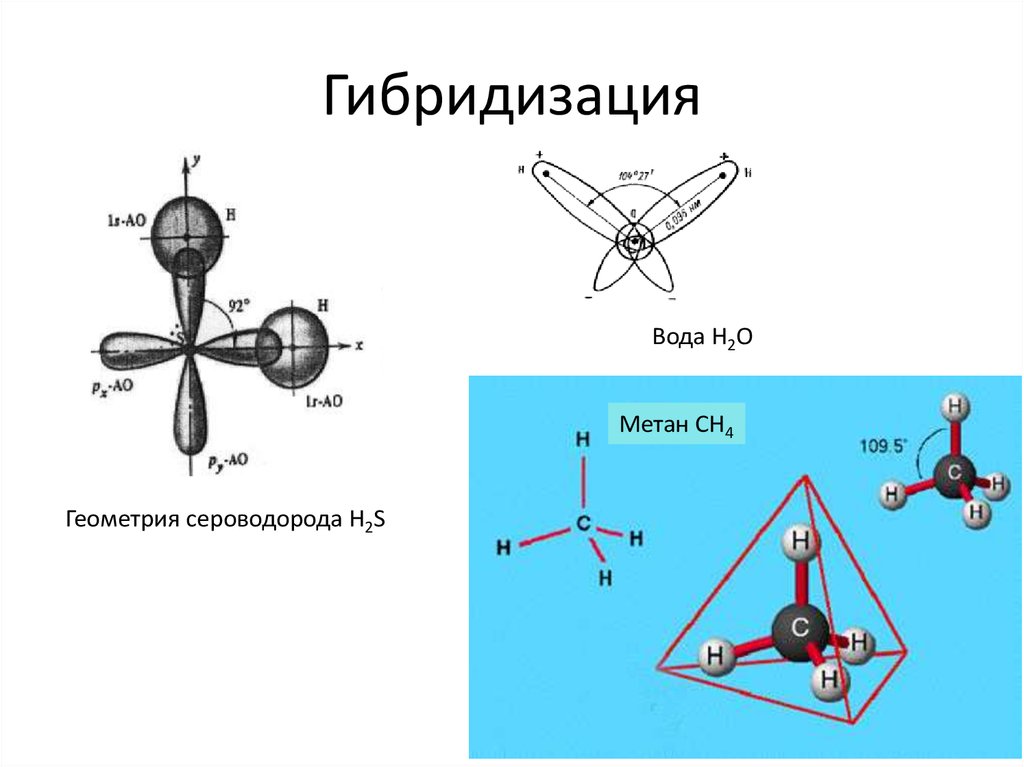 “Начало всего есть вода”, – справедливо отмечал Фалес из Милета в VI веке до н.э.
“Начало всего есть вода”, – справедливо отмечал Фалес из Милета в VI веке до н.э.
Жидкое чудо. Прекратим перечисление странных, но жизненно необходимых свойств воды, которых можно набрать еще с десяток, и переключим внимание на секреты необычного строения ее молекулы. Именно анализ строения молекулы воды позволяет понять ее исключительность в живой и неживой природе. Так что дорога к истине проходит через строение одиночной молекулы воды.
Прежде всего отметим, что молекула воды самая маленькая среди подобных трехатомных молекул (по отношению к гомологам, то есть водородным соединениям типа Н 2S, Н2Se, Н2Те, со свойствами которых традиционно сравнивают свойства воды). Такие молекулы при нормальных условиях образуют газы, а молекулы воды – жидкость. Почему?
Хаотичное сообщество газообразных молекул воды при конденсации, то есть при образовании жидкой фазы, формирует жидкое вещество удивительной сложности. В первую очередь это связано с тем, что молекулы воды обладают уникальным свойством объединяться в кластеры (группы) (Н2О)x.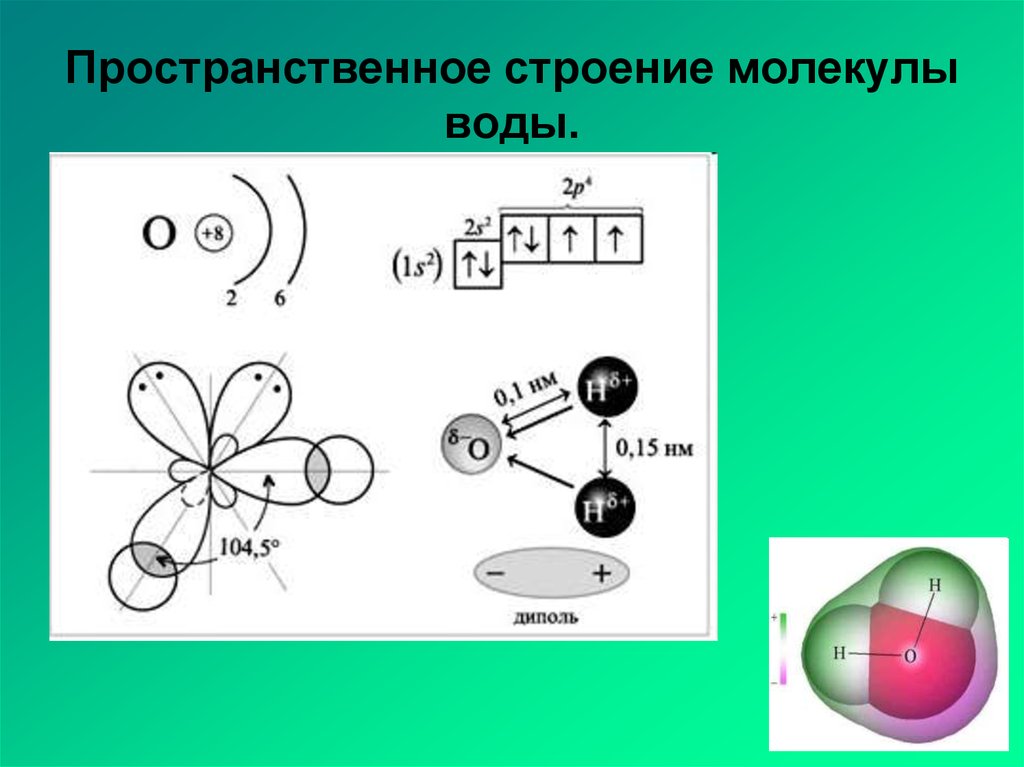 Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
При комнатной температуре степень ассоциации
Если бы вода при испарении оставалась в виде Н6О3, Н8О4 или Н12О6, то водяной пар был бы намного тяжелее воздуха, в котором доминируют молекулы азота и кислорода. В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
Людям крупно повезло: кластеры воды при испарении распадаются, и вода превращается практически в простой газ с химической формулой Н2О (обнаруженное в последнее время в паре незначительное количество димеров Н4О2 погоды не делает). Плотность газообразной воды меньше плотности воздуха, и поэтому вода способна насыщать своими молекулами земную атмосферу, создавая комфортные для человека погодные условия.
На Земле нет других веществ, наделенных способностью быть жидкостью при температурах существования человека и при этом образовывать газ не только легче воздуха, но и способный возвращаться к ее поверхности в виде осадков.
Восхитительная геометрия. Итак, какова же самая маленькая среди трехатомных
молекул? Молекула воды имеет симметричную V-образную форму, так как два небольших
атома водорода располагаются с одной стороны от сравнительно крупного атома
кислорода. Это сильно отличает молекулу воды от линейных молекул, например Н2Ве,
в которой все атомы располагаются цепочкой. Именно такое странное расположение
атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Это сильно отличает молекулу воды от линейных молекул, например Н2Ве,
в которой все атомы располагаются цепочкой. Именно такое странное расположение
атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Если внимательно рассмотреть геометрические параметры молекулы воды, то в ней обнаруживается определенная гармония. Чтобы увидеть ее, построим равнобедренный треугольник Н-О-Н с протонами в основании и кислородом в вершине. Такой треугольник схематично копирует структуру молекулы воды, проекция которой на плоскость условно изображена на рисунке.
Длины сторон этого треугольника и валентный угол между двумя связями О-Н изменяются при изменении агрегатного состояния воды. Приведем эти параметры (см. таблицу 2).
Прокомментируем данные, характеризующие различные состояния воды.
Параметры молекулы воды в парообразном состоянии получены на основе обработки спектров ее поглощения. Результаты неоднократно уточнялись, но по существу правильно оценивают длины связей и валентный угол в молекуле воды в состоянии пара.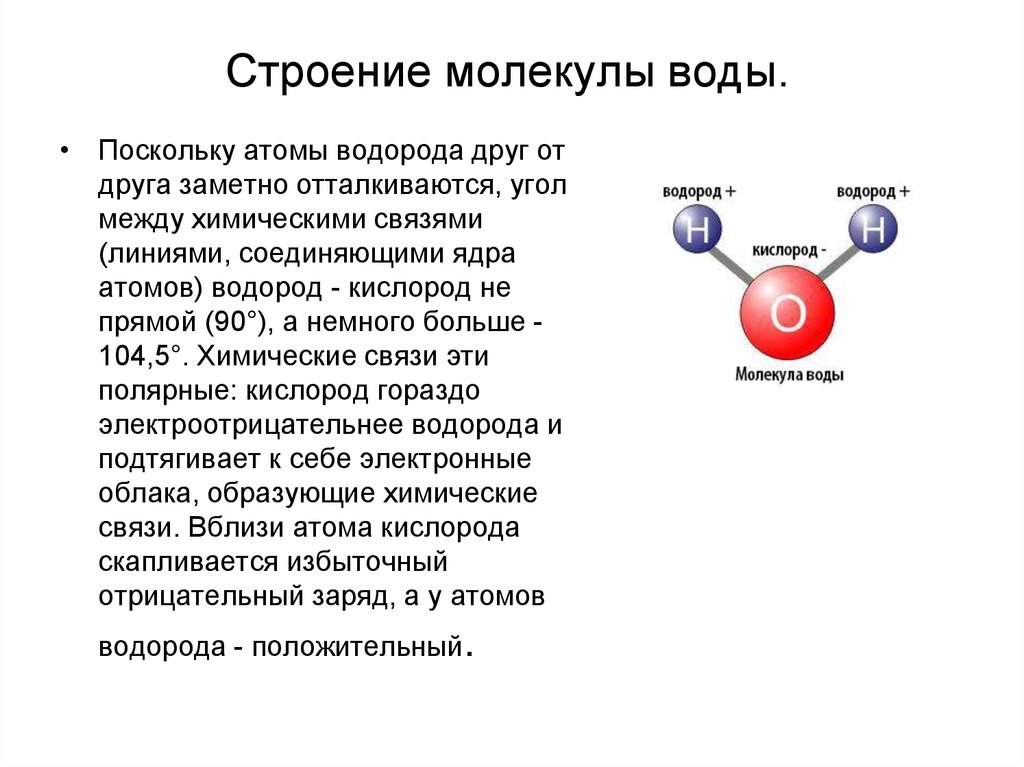
Кристаллическая структура льда при нормальном давлении довольно рыхлая с причудливой паутиной связей между молекулами воды. Схематично кристаллическую решетку обычного льда можно построить из атомов кислорода, каждый из которых участвует с соседними атомами в четырех водородных связях, направленных приблизительно к вершинам правильного тетраэдра.
Напомним, что водородной называется связь между атомами в одной молекуле или между соседними молекулами, которая осуществляется через атом водорода. Водородная связь играет чрезвычайно важную роль в структуре не только воды, но и большинства биологических молекул – углеводов, белков, нуклеиновых кислот и т. п.
Если кристаллический лед хорошо упорядочен по кислороду, то этого нельзя сказать про водород: в расположении ионов водорода (протонов) наблюдается сильный беспорядок. Их положение четко не определено, и поэтому лед можно считать разупорядоченным по водороду.
Лед обладает многими удивительными особенностями, из которых отметим две.
Во-первых, он всегда очень чист химически. В структуре льда практически не бывает примесей: при замерзании они вытесняются в жидкость. Именно поэтому снежинки всегда белые, а льдинки на поверхности грязной лужи практически прозрачные. Вообще говоря, любой растущий кристалл стремится создать идеальную кристаллическую решетку и вытесняет посторонние вещества. Но в планетарном масштабе именно замечательный феномен замерзания и таяния воды играет роль гигантского очистительного процесса – вода на Земле постоянно очищает сама себя.
Во-вторых, лед и особенно снег обладают очень высокой отражательной способностью. Благодаря этому солнечное излучение не вызывает заметного нагрева полярных областей, и, как следствие этого, наша планета избавлена от сезонных наводнений и повышений уровня Мирового океана.
Экспериментальное определение параметров одиночной молекулы воды в жидкой фазе до сих пор встречает непреодолимые трудности, поскольку жидкая вода – это смесь структурных элементов, то есть различных кластеров, находящихся в динамическом равновесии между собой.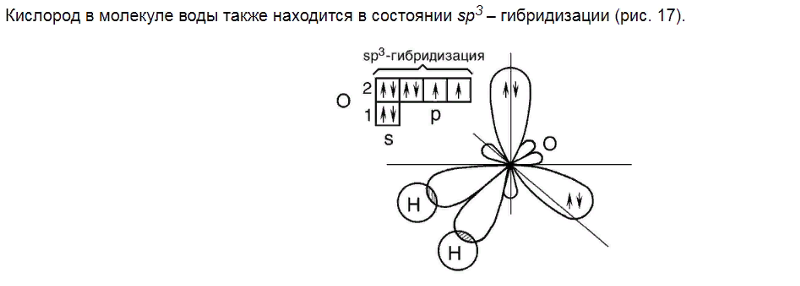 Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: “простая” жидкость Н2О не торопится раскрывать свои внутренние секреты.
Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: “простая” жидкость Н2О не торопится раскрывать свои внутренние секреты.
Вернемся к рисунку, на котором в общих чертах представлена структура молекулы воды. В ней есть симметрия, которая играет основную роль в попытках всестороннего объяснения физического мира, и асимметрия, наделяющая эту молекулу возможностью движения и связью с золотой пропорцией. Поэтому кратко напомним о том, что в математике называют золотой пропорцией.
Золотая пропорция . Это понятие возникает при решении геометрической задачи о нахождении на отрезке АВ такой точки С, чтобы выполнялось соотношение СВ:АС = АС:АВ.
Решение этой задачи приводит к отношению СВ:АС = (-1+√5)/2, которое называют золотой пропорцией, а соответствующее геометрическое деление отрезка АВ точкой С называют золотым сечением.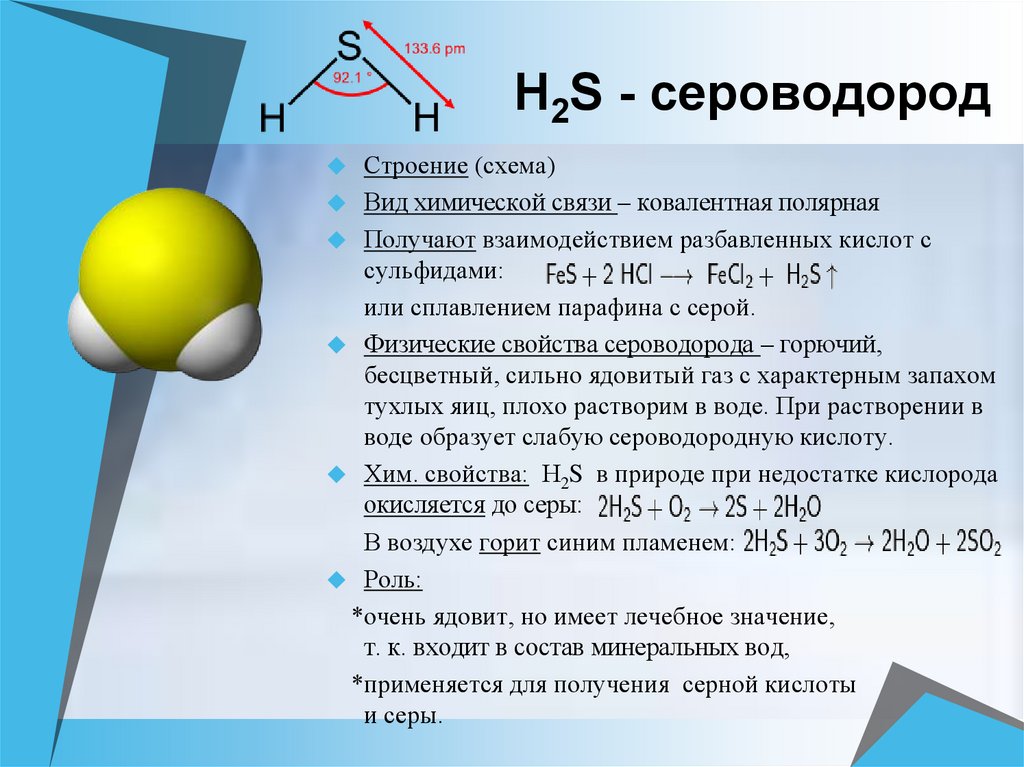 Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966….
Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966….
Время показало, что золотая пропорция воплощает совершенные и гармоничные отношения двух величин. В геометрической интерпретации она приводит к соразмерному и привлекательному соотношению между двумя неравными отрезками.
Исследователи золотой пропорции с античных времен до наших дней всегда восхищались и продолжают восхищаться ее свойствами, которые проявляются в строении различных элементов физического и биологического мира. Золотая пропорция обнаруживается везде, где соблюдены принципы гармонии.
Что же объединяет золотую пропорцию с молекулой воды? Чтобы ответить на этот вопрос, рассмотрим двумерный образ золотой пропорции в виде треугольника.
В золотом треугольнике отношение ОА:АВ = ОВ:АВ приблизительно равно 0,618,
угол α = 108,0о. Для льда отношение длин связей О-Н к Н-Н равно 0,100:0,163
= 0,613 и угол α = 109,5о, для пара – соответственно 0,631 и 104,5о. Не распознать в золотом треугольнике прообраз структуры молекулы воды просто
невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность
подобной интерпретации ее строения.
Не распознать в золотом треугольнике прообраз структуры молекулы воды просто
невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность
подобной интерпретации ее строения.
И действительно, поместив в треугольнике АОВ в точки А и В атомы водорода, а в точку О – атом кислорода, получим в первом приближении молекулу жидкой воды, сконструированную на основе золотой пропорции. Подобная элегантность молекулы очаровывает и восхищает. Так что роль молекулы воды в природе и жизни не может быть правильно оценена без учета красоты ее формы.
Исключительная гармония. Убедимся, что молекула жидкой воды – единственное трехатомное вещество, имеющее соразмерности, свойственные золотой пропорции.
В трехатомных молекулах-гомологах, близких по химическому составу к молекуле воды (Н2S, H2Se и Н2Те), валентный угол приблизительно равен 90о. Например, молекула Н2S имеет следующие геометрические параметры:
длина связи S-Н, нм . …………………… 0,1345
…………………… 0,1345
длина связи Н-Н, нм ……………………… 0,1938
валентный угол Н-S-Н, град ………….. 92,2
Отношение длин связей S-Н к Н-Н равно 0,694, что далеко от золотой пропорции. Квантово-химические расчеты показывают, что если бы вода была подобна родственным ей веществам, то валентный угол у ее молекулы должен был быть приблизительно таким же, как у Н2S, или больше максимум на 5о.
Но вода, как выясняется, не любит подобия, она всегда герой другого романа. Если бы валентный угол у воды был порядка 90-95о, о золотой пропорции пришлось бы забыть и вода оказалась бы в одном содружестве с другими водородными соединениями.
Но вода уникальна, ее молекула обладает практически выверенными эстетическими качествами, и поэтому ее свойства необходимо иногда интерпретировать, выходя за рамки традиционной научной парадигмы. И тогда некоторые загадки воды смогут быть объяснены таким “ненаучным” понятием, как гармония.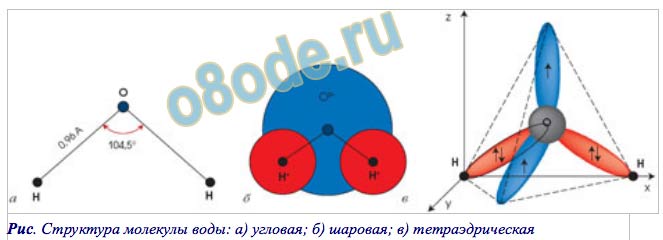
На приведенные рассуждения можно возразить: экспериментальные измерения геометрических параметров молекулы воды имеют определенную погрешность, и поэтому соотношение золотой пропорции может строго не выполняться. Но даже если в экспериментальные измерения внести еще большую погрешность, молекула воды все равно останется единственным из трехатомных веществ, имеющим практически “золотые” гармоничные пропорции.
В связи с этим обратим внимание на загадку талой воды, которая, по широко распространенному мнению, обладает отличным от обычной воды физиологическим воздействием.
Удивительная талая вода. Она рождается при таянии льда и сохраняет температуру 0оС, пока весь лед не растает. Специфика межмолекулярных взаимодействий, характерная для структуры льда, сохраняется и в талой воде, так как при плавлении кристалла разрушается только 15% всех водородных связей. Поэтому присущая льду связь каждой молекулы воды с четырьмя соседними (“ближний порядок”) в значительной степени не нарушается, хотя и наблюдается бoльшая размытость кислородной каркасной решетки.
Таким образом, талая вода отличается от обычной изобилием многомолекулярных кластеров, в которых в течение некоторого времени сохраняются рыхлые льдоподобные структуры. После таяния всего льда температура воды повышается и водородные связи внутри кластеров перестают противостоять возрастающим тепловым колебаниям атомов. Размеры кластеров изменяются, и поэтому начинают меняться свойства талой воды: диэлектрическая проницаемость приходит к своему равновесному состоянию через 15-20 минут, вязкость – через 3-6 суток. Биологическая активность талой воды спадает, по одним данным, приблизительно за 12-16 часов, по другим – за сутки.
Итак, физико-химические свойства талой воды самопроизвольно меняются во времени, приближаясь к свойствам обычной воды: она постепенно как бы “забывает” о том, что еще недавно была льдом.
Лед и пар – различные агрегатные состояния воды, и поэтому логично предположить, что в жидкой промежуточной фазе валентный угол отдельной молекулы воды лежит в диапазоне между значениями в твердой фазе и в паре. В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
Значит, для обычной жидкой воды валентный угол вполне может иметь некоторое среднее значение между 109,5и 104,5о, то есть примерно 107,0о. Но так как талая вода по своей внутренней структуре близка ко льду, то и валентный угол ее молекулы должен быть ближе к 109,5о, скорее всего, около 108,0о.
Сказанное выше можно сформулировать в виде гипотезы: в силу того, что талая вода значительно более структурирована, чем обычная вода, ее молекула с большой долей вероятности имеет структуру, максимально приближенную к гармоничному треугольнику золотой пропорции с валентным углом, близким к 108о, и с отношением длин связей примерно 0,618-0,619.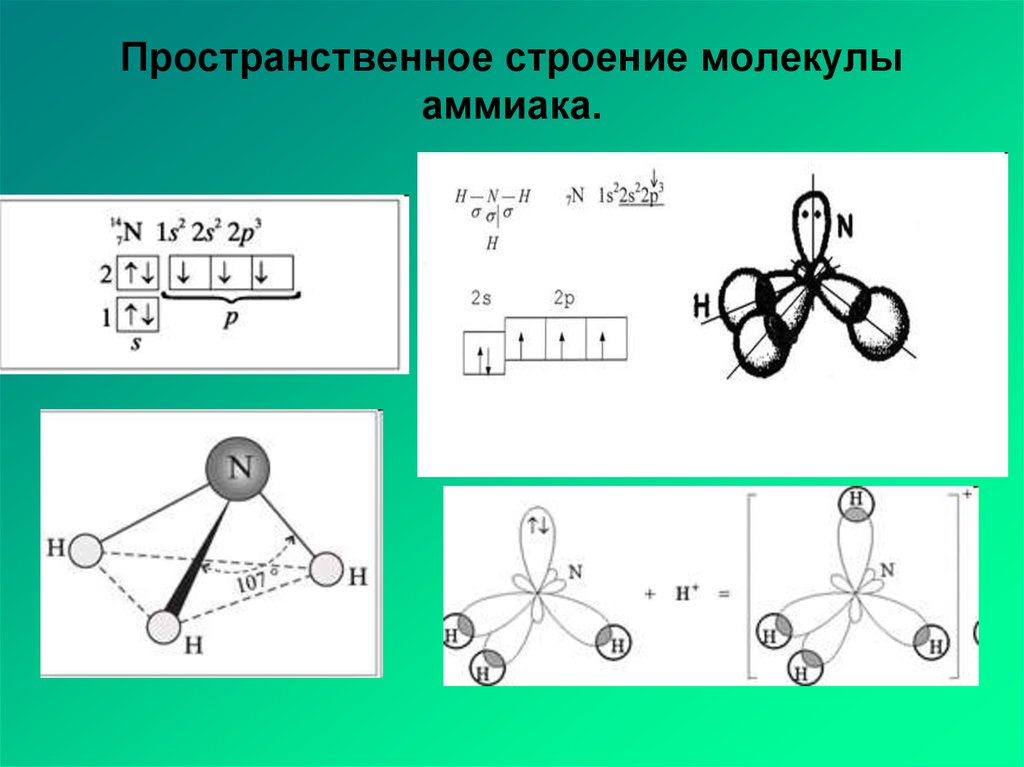
Экспериментального подтверждения этой гипотезы у авторов нет, как нет и какой-либо теории ее обоснования. Есть только догадка, высказанная на этих страницах, которая может, естественно, оспариваться.
Таинственная сила талой воды. Человеку с незапамятных времен известны удивительные свойства талой воды. Давно замечено, что вблизи тающих родников растительность альпийских лугов всегда пышнее, а у кромки тающего льда в арктических морях бурно цветет жизнь. Полив талой водой повышает урожайность сельскохозяйственных культур, ускоряет прорастание семян. При употреблении талой воды устойчиво повышаются привесы в животноводстве, ускоряется развитие цыплят. Известно, с какой жадностью животные пьют весной талую воду, а птицы буквально купаются в первых лужицах подтаявшего снега.
Талая вода, в отличие от обычной, по своей структуре очень похожа на жидкость, содержащуюся в клетках растительных и живых организмов. Именно поэтому для человека более подходит “ледяная” структура талой воды, в которой молекулы объединены в ажурные кластеры. Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты – они доставляют в организм воду, имеющую аналогичную структуру.
Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты – они доставляют в организм воду, имеющую аналогичную структуру.
При питье талой воды происходит подпитка организма самым гармоничным из всех веществ на Земле. Она улучшает обмен веществ и усиливает кровообращение, снижает количество холестерина в крови и успокаивает боли в сердце, повышает адаптационные возможности организма и способствует продлению жизни. Глоток чистейшей талой воды тонизирует лучше пастеризованного сока, в ней есть заряд энергии, бодрости и легкости.
Один из авторов этой работы постоянно пьет талую с плавающими льдинками воду и считает, что именно поэтому за три года ни разу не простудился. Талая вода освежает и молодит кожу, которая перестает нуждаться в кремах и лосьонах.
Теоретическое изучение свойств талой воды находится пока на уровне гипотез. Нет общепринятого мнения о причинах, вызывающих необычные эффекты при ее применении. Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности – все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности – все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Подчеркнем: приведенная гипотеза не претендует на расшифровку загадки талой воды. Она лишь позволяет выйти за рамки традиционного мышления и посмотреть на взаимную любовь жизни и воды с необычной стороны – со стороны гармонии и красоты, со стороны особых свойств талой воды, добавляющих ее изящной молекуле черты, которыми не обладают другие молекулы.
ЛИТЕРАТУРА
Ауэрбах Ф. Семь аномалий воды. – СПб., 1919.
Габуда С. П. Связанная вода. Факты и гипотезы. – Новосибирск: Наука, 1982.
Зацепина Г. Н. Физические свойства и структура воды. – М.: МГУ, 1998.
Синюков В. В. Вода известная и неизвестная.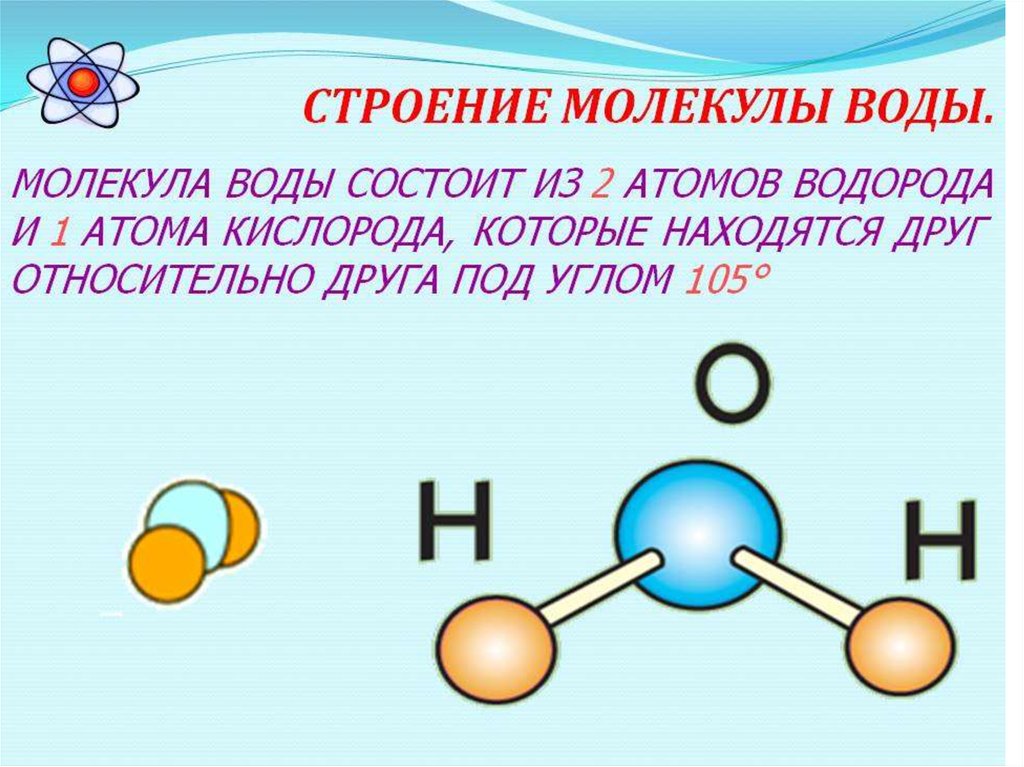 – М.: Знание, 1987.
– М.: Знание, 1987.
Белянин В. С., Романова Е. Золотая пропорция. Новый взгляд // Наука и жизнь, 2003, № 6.
Вода: структура, состояние, сольватизация. Достижения последних лет. – М.: Наука, 2003.
Подписи к иллюстрациям
Илл. 1. Плотность льда почти на 10% меньше, чем у воды, а удельный объем на столько же больше. Поэтому лед плавает, а вода, замерзая в трещинах горных пород, раскалывает их.
Глава 4.2. Структура воды | BookOnLime
Молекула воды, построенная из двух атомов водорода и одного атома кислорода, как установлено исследованиями оптических спектров воды в гипотетическом состоянии полного отсутствия движения имеет структуру равнобедренного треугольника, вершину треугольника занимает кислород, а два атома водорода лежат в основании треугольника (рис. 30 а).
а) | б) |
Рис.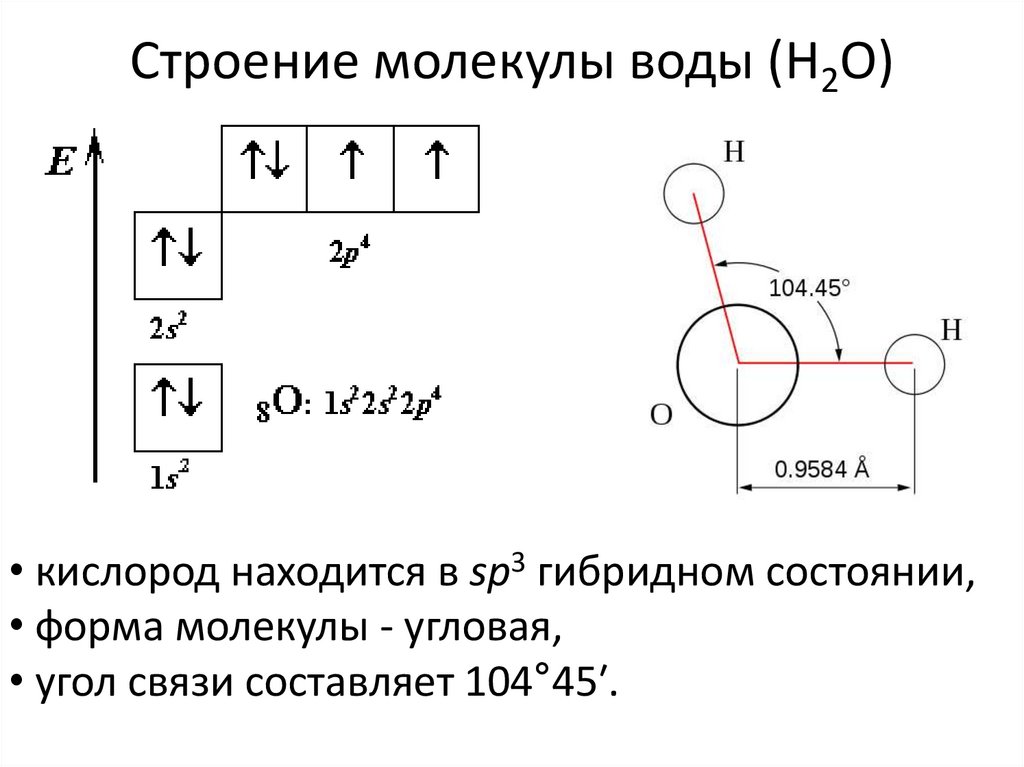 30. Геометрическая схема (а) и пространственная электронная структура (б) мономера Н2О
30. Геометрическая схема (а) и пространственная электронная структура (б) мономера Н2О
Угол треугольника равен 104,5°, расстояние между кислородом и водородом 0,96 Å. Для ближайшего гомолога воды Н2S угол составляет около 92° (табл. 4.2.1).
Таблица 4.2.1. Длины связей (Н-Э) и углы гомологов воды
Наименование параметра | Н–Э | |||
Молекула | Н2О | Н2S | Н2Se | Н2Те |
Длина связи, 10–8 см | 0,957 | 1,334 | 1,460 | 1,653 |
Угол молекулы, град | 104,52 | 92,16 | 90,53 | 90,25 |
В образовании каждой ковалентной связи О-Н участвуют по одному электрону от атомов кислорода и водорода. У кислорода остается одна неподеленная пара электронов, которая в изолированной молекуле воды остается свободной, но при сближении с другими молекулами воды играет важную роль в образовании молекулярной структуры воды, а именно в способности к образованию водородных связей. Водородные связи между молекулами воды возникают в результате специфического распределения в них электронной плотности.
У кислорода остается одна неподеленная пара электронов, которая в изолированной молекуле воды остается свободной, но при сближении с другими молекулами воды играет важную роль в образовании молекулярной структуры воды, а именно в способности к образованию водородных связей. Водородные связи между молекулами воды возникают в результате специфического распределения в них электронной плотности.
Неподеленные электроны отталкиваются от связей О-Н, поэтому их орбиты сильно вытянуты в сторону, противоположную атомам водорода. Таким образом, в трехмерном пространстве молекулу воды можно изобразить в виде тетраэдра, в центре которого находится атом кислорода, а в двух вершинах – по атому водорода (рис. 29 б). Каждый из протонов может образовывать связь с неподеленным электроном другой молекулы. Первая молекула при этом выступает в качестве акцептора, а вторая донора, образуя водородную связь. Таким образом, молекула воды представляет собой двойной симметричный донор и акцептор, что позволяет ей образовывать водородные связи с соседними молекулами воды с точным балансом числа донорных и акцепторных связей. Электронная структура молекул воды определяет условия их объединения в сложную трехмерную сеть водородных связей, как в воде, так и во льду. Пока молекула воды свободна, электроны, которые не участвуют в образовании связи, располагаются ближе к ядру кислорода, чем связывающие и сильно отталкивают связывающие электроны, при этом угол НОН свободной молекулы около 1040, а при образовании водородных связей угол возрастает до 1090. Водородная связь имеет электростатическую природу. У гомологов воды атомы практически нейтральны, поэтому водородные связи между их молекулами не образуются. Только в системе молекул воды водородные связи полностью определяют геометрию кристаллов и свойства жидкой воды.
Электронная структура молекул воды определяет условия их объединения в сложную трехмерную сеть водородных связей, как в воде, так и во льду. Пока молекула воды свободна, электроны, которые не участвуют в образовании связи, располагаются ближе к ядру кислорода, чем связывающие и сильно отталкивают связывающие электроны, при этом угол НОН свободной молекулы около 1040, а при образовании водородных связей угол возрастает до 1090. Водородная связь имеет электростатическую природу. У гомологов воды атомы практически нейтральны, поэтому водородные связи между их молекулами не образуются. Только в системе молекул воды водородные связи полностью определяют геометрию кристаллов и свойства жидкой воды.
Водородные связи вокруг каждой молекулы воды реализуются в кристаллах льда. Схематически структура льда представлена на рис. 31.
Рис. 31. Гексагональная структура льда Ih
Это так называемый гексагональный лед, который образуется при давлении 1 атм. Получается сетка водородных связей, в узлах сетки находятся молекулы воды, в каждом ее узле сходится четыре связи. Все углы между связями в сетке равны тетраэдрическому углу 1090. Сетка состоит из изогнутых шестичленных колец, поэтому сетка называется гексагональной и вся структура льда обозначается как гексагональный лед (лед Ih). Характерной особенностью структуры льда является рыхлая упаковка в ней молекул. Если бы молекулы воды во льду были плотно упакованы, то его плотность составляла бы 2,0 г/см3, на самом деле она равна 0,92 г/см3. Но рыхлость упаковки не ведет к неустойчивости структуры. При сжатии льда сетка водородных связей не разрушается, а перестраивается, сохраняя свою четверную конфигурацию. Более выгодным оказывается не разорвать некоторые водородные связи, а сохранить их, лишь деформируя сетку, несколько изменяя углы между связями. При повышении давления гексагональный лед Ih меняет свою структуру. При деформации гексагональной сетки плотность увеличивается, а углы между соседними связями отличаются от тетраэдрических. Гексагональный лед обладает минимальной плотностью и наибольшей рыхлостью.
Все углы между связями в сетке равны тетраэдрическому углу 1090. Сетка состоит из изогнутых шестичленных колец, поэтому сетка называется гексагональной и вся структура льда обозначается как гексагональный лед (лед Ih). Характерной особенностью структуры льда является рыхлая упаковка в ней молекул. Если бы молекулы воды во льду были плотно упакованы, то его плотность составляла бы 2,0 г/см3, на самом деле она равна 0,92 г/см3. Но рыхлость упаковки не ведет к неустойчивости структуры. При сжатии льда сетка водородных связей не разрушается, а перестраивается, сохраняя свою четверную конфигурацию. Более выгодным оказывается не разорвать некоторые водородные связи, а сохранить их, лишь деформируя сетку, несколько изменяя углы между связями. При повышении давления гексагональный лед Ih меняет свою структуру. При деформации гексагональной сетки плотность увеличивается, а углы между соседними связями отличаются от тетраэдрических. Гексагональный лед обладает минимальной плотностью и наибольшей рыхлостью.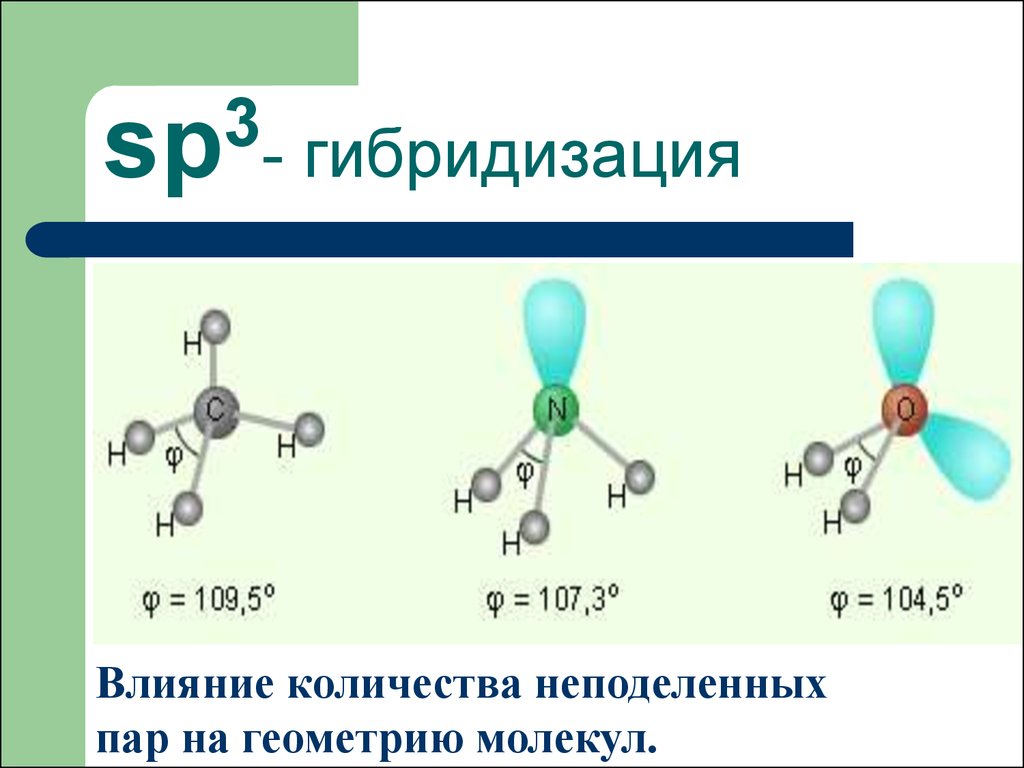 По своим электрическим свойствам лед относят к протонным полупроводникам, так как носителями заряда во льду являются неупорядоченные протоны. В кристаллической решетке льда упорядочено расположение атомов кислорода, а по протонам – это неупорядоченная среда.
По своим электрическим свойствам лед относят к протонным полупроводникам, так как носителями заряда во льду являются неупорядоченные протоны. В кристаллической решетке льда упорядочено расположение атомов кислорода, а по протонам – это неупорядоченная среда.
Гексагональная форма льда является не единственной. Полиморфных форм льда, образуемых при различных давлениях и температурах, насчитывают от 12 до 14. При плавлении льда тетраэдрическая сетка водородных связей не должна разрушаться, но кристаллический порядок нарушается.
Поскольку вода является сложной ассоциированной жидкостью с динамическим характером связей, то описание ее свойств на молекулярном уровне возможно лишь с помощью квантово-механических моделей различной сложности и строгости. Таких моделей достаточно много. В последние годы все больше появляется данных о существовании сетки водородных связей в воде в виде разнообразных структур кластерного типа. Под кластерами понимают кристаллоподобные структуры, которые могут содержать полости. Водные кластеры структурно могут быть подобны кластерам углерода и кремния (фуллерены, алмаз, графит, силикаты). Такое подобие определяется способностью атомов углерода и кремния образовывать по четыре ковалентные связи, а у атома кислорода воды также четыре связи (две ковалентные и 2 водородные). Следует заметить, что углерод – основа всего живого, кремний – основа неживой материи и вода, объединяющая эти два мира, способна образовывать связи тетраэдрической конфигурации.
Водные кластеры структурно могут быть подобны кластерам углерода и кремния (фуллерены, алмаз, графит, силикаты). Такое подобие определяется способностью атомов углерода и кремния образовывать по четыре ковалентные связи, а у атома кислорода воды также четыре связи (две ковалентные и 2 водородные). Следует заметить, что углерод – основа всего живого, кремний – основа неживой материи и вода, объединяющая эти два мира, способна образовывать связи тетраэдрической конфигурации.
Имеются квантово-химические расчеты, подтверждающие возможность существования устойчивых водных кластеров, которые, блокируясь друг с другом, могут достичь громадных размеров, включающих в себя 280 и более молекул воды, фактически это полимерные молекулы, построенные из тетраэдрической сетки.
В водных кластерах, как показали квантомеханические расчеты, может происходить миграция протонов по эстафетному механизму, приводящая к делокализации протонов в пределах кластера. Наличие делокализации протонов в пределах кластера способствует стабилизации последнего.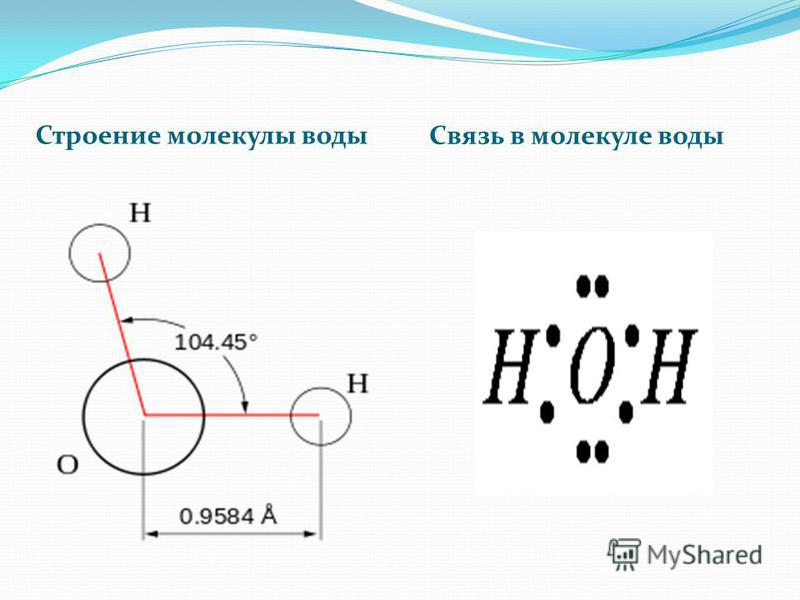
Свойство тетраэдрических сеток водородных связей воды образовывать различные структурные конфигурации проявляется в существовании соединений включения (клатратные гидраты). Это система «гость – хозяин». Простейшая модель – додекаэдр, образованный молекулами воды («хозяин»), в полость которого помещаются небольшие молекулы, например, метан («гость»).
Структура воды позволяет объяснить многочисленные аномальные свойства воды. Резкое увеличение плотности при плавлении льда связано с тем, что сетка водородных связей льда сильно искажается после плавления, углы между связями отклоняются от оптимальных, тетраэдрических, в результате чего уменьшается объем пустого пространства между молекулами воды. Уменьшение плотности при понижении температуры ниже 4 0С определяется перестройкой структуры водной сетки – чем ниже температура, тем ажурнее становится сетка, больше объем пустого пространства. При высоких температурах перестройка структуры сетки мало влияет на плотность, поскольку сетка в этом случае сильно отличается от ажурной, тетраэдрической. Тогда преобладает общее для всех веществ свойство – увеличение расстояния между частицами при нагревании. Аналогично объясняются и другие аномалии воды при низких температурах. Общая причина аномального поведения воды при низких температурах заключается в том, что при этом сетка водородных связей воды не очень искажена по сравнению тетраэдрической конфигурацией и при изменении температуры первостепенное значение имеет перестройка структуры этой сетки, которая и определяет аномальный вклад в поведение наблюдаемого свойства воды. При высоких температурах, когда водная сетка сильно деформирована, ее перестройка оказывает меньшее влияние и вода ведет себя, как все обычные жидкости.
Тогда преобладает общее для всех веществ свойство – увеличение расстояния между частицами при нагревании. Аналогично объясняются и другие аномалии воды при низких температурах. Общая причина аномального поведения воды при низких температурах заключается в том, что при этом сетка водородных связей воды не очень искажена по сравнению тетраэдрической конфигурацией и при изменении температуры первостепенное значение имеет перестройка структуры этой сетки, которая и определяет аномальный вклад в поведение наблюдаемого свойства воды. При высоких температурах, когда водная сетка сильно деформирована, ее перестройка оказывает меньшее влияние и вода ведет себя, как все обычные жидкости.
Деформация сетки при изменении температуры требует затрат энергии, что и объясняет аномальный вклад в теплоемкость. Особые свойства сетки водородных связей определяют аномальное поведение не только чистой воды, но и многих ее растворов.
CHEM 245 – Вода
ТЕМЫ БИОХИМИИ
Вода
Вода 101.Дальнейшие последствия использования воды как биологического растворителя.
Вода (H 2 O) — знакомое, но увлекательное вещество. Это дает нам возможность рассмотреть свойства трех фаз материи – газообразная, жидкая и твердая фазы — на знакомом и важном примере. Вода является одновременно кислотой и основанием, и является эффективным катализатором реакций переноса протона. Вода играет центральную роль в жизни и биохимических процессах, происходящих в живых организмах. Поскольку большая часть земной поверхности покрыта водой, ее свойства оказывают огромное влияние. на планетарную среду, позволяющую и поддерживающую развитие биосферы.
Структура молекулы воды
Для начала давайте создадим структуру Льюиса для молекулы воды на основе ее молекулярного
формула, H 2 O. Символы Льюиса для элементов
показаны на панели (а) ниже: кислород имеет шесть валентных электронов, а водород только один.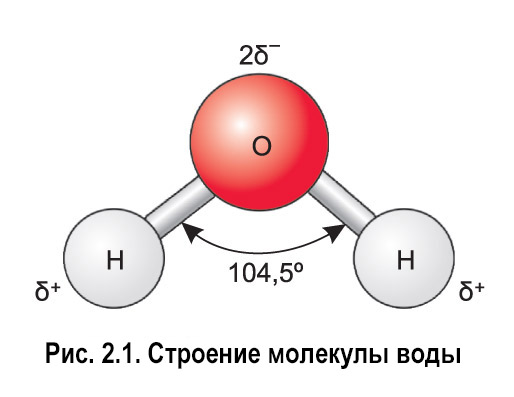
На панели (b) показано, как соединить три атома вместе, чтобы сформировать полный октет для центрального
атом кислорода. Водород, как элемент с периодом 1, может разместить только два электрона в своей валентности.
оболочки и образует только одну связь. На панели (c) мы применили условное обозначение, согласно которому два общих электрона, образующих химическую связь между атомами, могут быть представлены линией. Имея действительную структуру Льюиса, мы можем сделать вывод о молекулярной геометрии молекулы воды. Октет центрального кислорода можно рассматривать как состоящий из четырех электронных доменов, двух связывающих пар и двух несвязывающих «одиноких пар». Применение теории VSEPR к этой конфигурации приводит к выводу, что эти четыре электронных домена – в первом приближении – расположены вокруг центрального кислорода в виде тетраэдра. Основной вывод, который из этого следует, заключается в том, что расположение атомов в молекуле H-O-H не прямолинейное, а изогнутое, при этом валентный угол должен быть близок к тетраэдрическому значению, 1090,5°. Поскольку неподеленные пары распределяют отрицательный заряд по большему объему, чем связывающие пары, электростатическое отталкивание сближает связующие пары, поэтому фактический угол связи должен быть немного меньше 109,5 °. Как мы покажем ниже, мы также можем использовать структуру Льюиса, чтобы проанализировать, имеет ли молекула воды полярность.
Поскольку неподеленные пары распределяют отрицательный заряд по большему объему, чем связывающие пары, электростатическое отталкивание сближает связующие пары, поэтому фактический угол связи должен быть немного меньше 109,5 °. Как мы покажем ниже, мы также можем использовать структуру Льюиса, чтобы проанализировать, имеет ли молекула воды полярность.
То, что мы называем «формой молекулы», — это то, что мы видим, когда смотрим только на атомы, составляющие молекулу. Экспериментальные методы, такие как рентгеновская кристаллография, которые могут определить положение атомов в молекулах, позволяют определить форму молекулы воды. На приведенных ниже диаграммах представлена экспериментально определенная молекулярная форма.
В соответствии с нашим анализом с использованием формализма Льюиса, вода имеет угловатую или изогнутую форму с валентным углом HOH, равным 104,5 °. Это согласуется с примерно тетраэдрической ориентацией четырех электронных доменов вокруг центрального кислорода, двух связывающих пар и двух несвязывающих «неподвижных пар».
Длина связи Н-О составляет 0,958 Å (1 Å = 10 -10 м). Поскольку кислород значительно более электроотрицательный, чем водород, большая часть отрицательного заряда электронов в связывающей паре сосредоточена вблизи кислорода. Это небольшое разделение зарядов вдоль оси отдельной связи (обозначаемое обозначением δ) создает связь диполь . Диполи связи можно рассматривать как векторов и суммировать, чтобы получить другой вектор, молекулярный дипольный момент .
Выше : два изображения молекулярной формы молекулы воды: шарообразная (вверху) и заполняющая пространство (внизу). Кислород — это центральный атом, показанный красным цветом, а атомы водорода — светло-серым.
Если молекула имеет ненулевой дипольный момент. говорят, что это полярный или иметь полярность . Для геометрии молекулы воды компоненты диполя связи, параллельные линии, разделяющей пополам угол связи HO (пунктирная вертикальная линия на рисунке), складываются вместе, а перпендикулярные (горизонтальные) компоненты компенсируются. Это приводит к тому, что чистый дипольный момент выровнен с биссектрисой валентного угла с отрицательным концом, направленным вверх (стрелка на правой панели выше). Таким образом, молекула воды обладает значительным дипольным моментом, который можно смоделировать как вертикально ориентированное частичное разделение зарядов (обозначено на рисунке знаком ξ). Другими словами, молекула воды полярна.
Это приводит к тому, что чистый дипольный момент выровнен с биссектрисой валентного угла с отрицательным концом, направленным вверх (стрелка на правой панели выше). Таким образом, молекула воды обладает значительным дипольным моментом, который можно смоделировать как вертикально ориентированное частичное разделение зарядов (обозначено на рисунке знаком ξ). Другими словами, молекула воды полярна.
Если показать на этом изображении, неподеленные пары будут выступать вверх от кислорода. вперед из плоскости и назад за плоскость рисунка (см. следующий рисунок ниже).
Свойства воды
Наше рассмотрение свойств воды может служить парадигмой для достижения одной из самых фундаментальных целей изучения химии. То есть ответить на вопрос: как наноразмерные молекулярные свойства воды объясняют свойства, которые мы наблюдаем у вещества в целом, в макроскопическом масштабе? Чтобы ответить на этот вопрос, мы воспользуемся «расширенной» версией структуры Льюиса для молекулы воды, показанной ниже справа.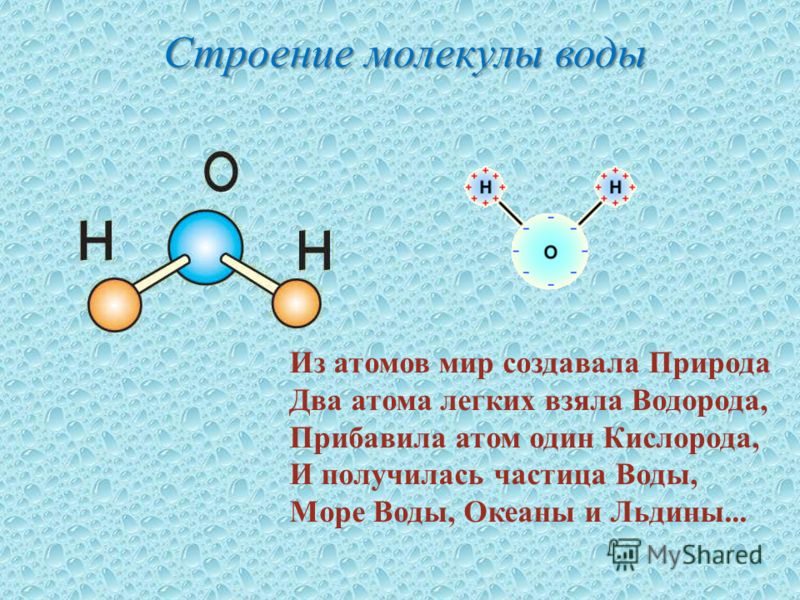
Учитывая структурную интерпретацию молекулы воды, что межмолекулярных сил могли бы мы предсказать, что они будут играть важную роль в определении его объемные свойства? Диаграмма справа показывает геометрию молекулы воды, полярность ее связей, молекулярный дипольный момент и ориентация неподеленных пар. Вода не только полярная молекула, но и может образовывать межмолекулярные соединения. водородные связи (Н-связи). Относительно сильные межмолекулярные силы, возникающие в результате диполь-дипольных взаимодействий и взаимодействий Н-связей. учитывать такие свойства, как высокая температура кипения для небольшой молекулы, высокая энтальпия парообразования , большая теплоемкость , способность растворять полярные и многие ионные соединения.
Фактически, вода является образцом в мире молекул с водородными связями. Каждая молекула воды имеет две неподеленные пары, которые служат акцепторами водородных связей, а две связи OH обеспечивают пару доноров водородных связей. На рисунке слева изображена одна Н-связь между двумя молекулами воды. Крайняя левая молекула воды является донором водородной связи, а молекула воды справа является акцептором водородной связи.
На рисунке слева изображена одна Н-связь между двумя молекулами воды. Крайняя левая молекула воды является донором водородной связи, а молекула воды справа является акцептором водородной связи.
Структура льда
Структура льда показывает способность молекул воды образовывать межмолекулярные водородные связи или Н-связи (обозначены пунктирными линиями на рисунке справа) в ее максимуме. Каждая молекула воды внутри решетки (то есть не на поверхности) образует водородные связи с четырьмя соседями, принимая двух доноров водородных связей у своего центрального атома кислорода и отдавая две водородные связи через два своих атома водорода. Таким образом, каждая внутренняя вода полностью связана водородными связями, а общая структура образует трехмерную гексагональную решетку молекул воды. Обширные водородные связи придают прочность ледяной решетке, но в то же время дают относительно открытую структуру. Это объясняет тот факт, что при температуре плавления или около нее жидкая вода имеет большую плотность, чем лед. Когда структура льда тает, некоторые водородные связи разрываются, и менее жестко связанные молекулы воды могут приблизиться друг к другу в среднем немного ближе.
Когда структура льда тает, некоторые водородные связи разрываются, и менее жестко связанные молекулы воды могут приблизиться друг к другу в среднем немного ближе.
Вода как растворитель
Способность воды действовать как растворитель связана с полярностью молекулы воды, а также с ее способностью образовывать водородные связи с растворенными веществами. Как мы видели, молекула воды полярна, и ее дипольный момент можно представить в виде вектора, делящего пополам валентный угол H-O-H. Дипольный момент молекулы действует аналогично стержневому магниту в магнитном поле. Отрицательный конец диполя будет иметь тенденцию ориентироваться на положительно заряженные частицы, в то время как наличие отрицательного заряда будет притягивать положительный конец диполя. Таким образом, выравнивание диполя с локальным электрическим полем снижает электростатическую потенциальную энергию, что делает выравнивание предпочтительным.
На рисунке справа показано, как это работает для ионов, образующихся в результате растворения хлорида натрия (NaCl) в воде.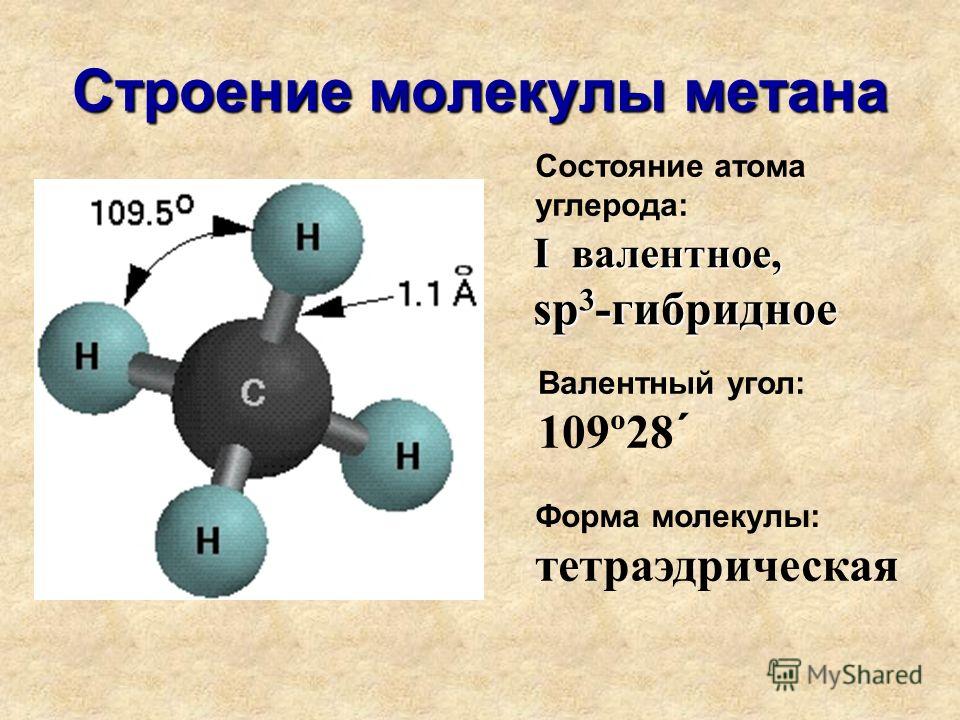 При растворении ионы, составляющие соль, диссоциируют от твердой кристаллической решетки. Благоприятные электростатические взаимодействия ионных связей решетки теряются, повышая потенциальную энергию, но диполь-ионные взаимодействия помогают компенсировать это. Молекулы воды вблизи ионов ориентируют свои дипольные моменты в соответствии с зарядами ионов – положительные концы их диполей в сторону хлорид-аниона; отрицательные концы диполя молекулы воды направлены в сторону катионов натрия. Это называется гидратация или вода , а вовлеченные молекулы воды называются водой гидратации (или аквацией).
При растворении ионы, составляющие соль, диссоциируют от твердой кристаллической решетки. Благоприятные электростатические взаимодействия ионных связей решетки теряются, повышая потенциальную энергию, но диполь-ионные взаимодействия помогают компенсировать это. Молекулы воды вблизи ионов ориентируют свои дипольные моменты в соответствии с зарядами ионов – положительные концы их диполей в сторону хлорид-аниона; отрицательные концы диполя молекулы воды направлены в сторону катионов натрия. Это называется гидратация или вода , а вовлеченные молекулы воды называются водой гидратации (или аквацией).
Растворимость данного ионного соединения в воде в значительной степени определяется
энергетический баланс между ионными связями в твердом состоянии
(плюс водородные связи между молекулами воды в жидком состоянии) по сравнению с ионно-дипольными взаимодействиями
между растворенными и растворяющими веществами в растворе.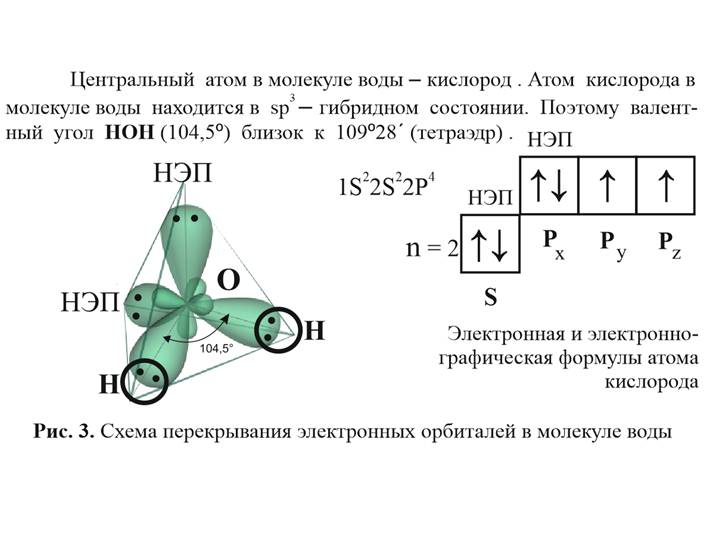 Мы знаем, что не все ионогенные соединения свободно растворимы в воде.
и мы можем полагаться на эмпирические правила разрешимости чтобы помочь нам ответить на вопрос, растворимо ли данное ионное соединение в воде. Но приведенные выше соображения об энергетике ионных связывающих и несвязывающих взаимодействий во многом определяют правила растворимости. Кроме того, по сравнению с менее полярным растворителем (таким как метанол) или растворителем, не обладающим плаарной активностью (таким как гексан или бензол), вода является гораздо более эффективным растворителем для ионных соединений. Неполярные или слабополярные растворители далеко не так эффективны при сольватации диссоциированных ионов, как вода, поэтому нам не нужны правила растворимости ионных соединений в таких растворителях — мы бы однозначно предсказывали, что ионные соединения нерастворимы в неполярных растворителях.
Мы знаем, что не все ионогенные соединения свободно растворимы в воде.
и мы можем полагаться на эмпирические правила разрешимости чтобы помочь нам ответить на вопрос, растворимо ли данное ионное соединение в воде. Но приведенные выше соображения об энергетике ионных связывающих и несвязывающих взаимодействий во многом определяют правила растворимости. Кроме того, по сравнению с менее полярным растворителем (таким как метанол) или растворителем, не обладающим плаарной активностью (таким как гексан или бензол), вода является гораздо более эффективным растворителем для ионных соединений. Неполярные или слабополярные растворители далеко не так эффективны при сольватации диссоциированных ионов, как вода, поэтому нам не нужны правила растворимости ионных соединений в таких растворителях — мы бы однозначно предсказывали, что ионные соединения нерастворимы в неполярных растворителях.
Для молекулярных соединений вода обычно является отличным растворителем для соединений с полярными молекулами.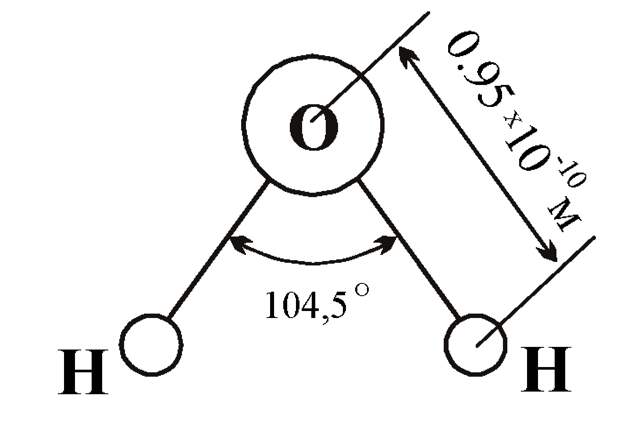 и тем более для полярных молекул, способных образовывать Н-связи с молекулами воды.
и тем более для полярных молекул, способных образовывать Н-связи с молекулами воды.
Вода и жизнь
Хотя они достаточно сложны и неоднородны по строению и составу, живые клетки в значительной степени представляют собой водные системы. Тот факт, что вода в основном является жидкостью в широком диапазоне температур, характерных для земной поверхности, и ее способность растворять самые разнообразные соединения, делает возможным существование таких сложных систем. Воду по праву можно назвать растворителем жизни. Конечно, если мы хотим понять биологическую химию, нам следует тщательно изучить свойства воды.
В связи с этим часто упоминается необычное свойство воды образовывать твердое тело с меньшей плотностью, чем в жидком состоянии. Относительно открытая структура льда максимизирует способность водородных связей составляющих его молекул воды, что делает эту открытую структуру энергетически выгодной. Когда лед тает, часть водородных связей разрывается, что позволяет молекулам воды в среднем приближаться друг к другу немного ближе.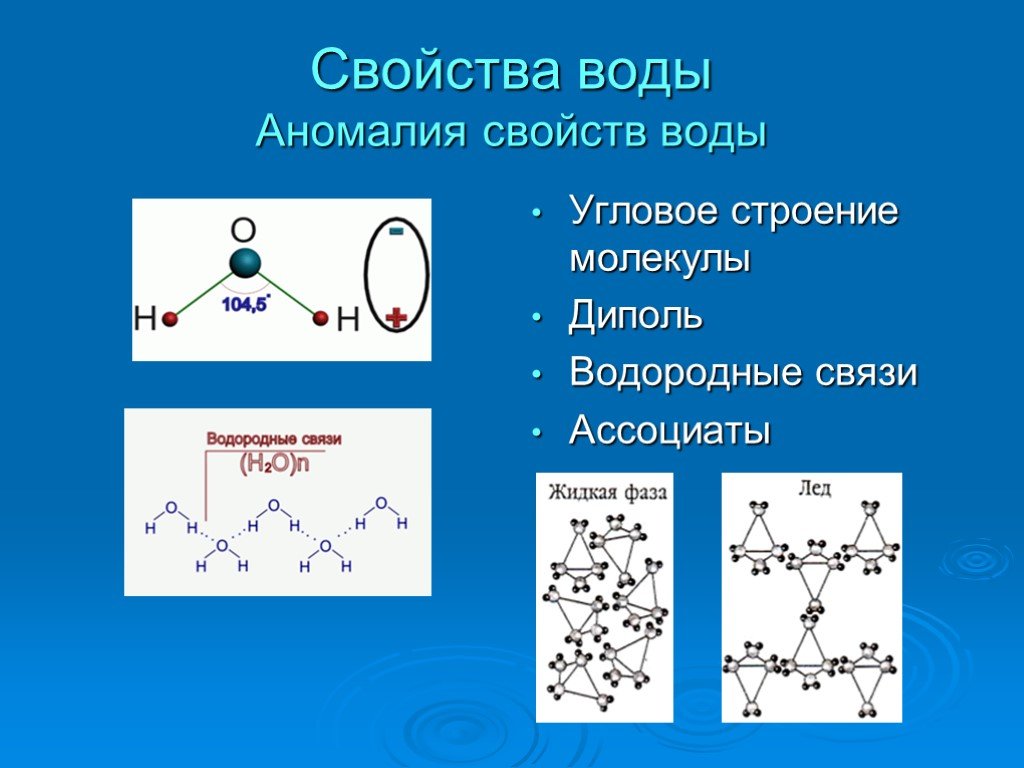 Таким образом, жидкая вода, находящаяся в равновесии со льдом при 0°С, более плотна, чем лед, который плавает. Вода имеет максимальную плотность в жидком состоянии при температуре 4°C. Это имеет огромные последствия для биосферы Земли. Озера и океаны замерзали бы снизу вверх, если бы лед был плотнее воды. Это привело бы к тому, что большая часть воды на Земле оказалась бы запертой в виде льда.
Таким образом, жидкая вода, находящаяся в равновесии со льдом при 0°С, более плотна, чем лед, который плавает. Вода имеет максимальную плотность в жидком состоянии при температуре 4°C. Это имеет огромные последствия для биосферы Земли. Озера и океаны замерзали бы снизу вверх, если бы лед был плотнее воды. Это привело бы к тому, что большая часть воды на Земле оказалась бы запертой в виде льда.
Среди химических свойств воды следует особо отметить то, что она является как очень слабой кислотой, так и очень слабым основанием, и между молекулами воды происходят реакции переноса протона
H 2 o ( L ) + H 2 O ( L ) = H 3 O + ( AQ ) + OH – ( AQ ) 9032. ( AQ ) 9039032. . w = [ H + ][ OH – ] = 1,0 × 10 −14 (при 25°С).
Это так называемое автоионизация реакция происходит только в очень небольшой степени, о чем свидетельствует небольшая величина K w , но это равновесие составляет основу химии
водных смесей кислых и основных растворенных веществ.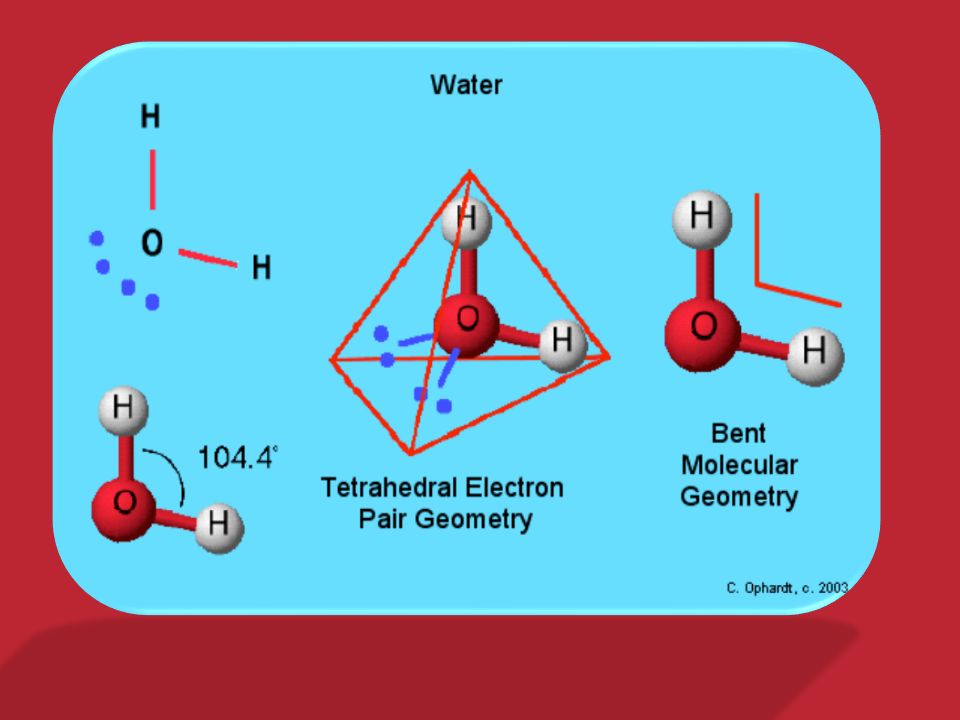 Вода действует как растворитель для многих полярных и ионных частиц, которые затем могут реагировать с водой.
как кислота, основание или и то, и другое. Применение химических концепций к таким водным системам,
трактуется в соответствии с формализмом Бренстеда-Лоури, обеспечивает важную основу для
биохимия и физиология. Свойства буфера в водных системах попадают в эту категорию.
Вода действует как растворитель для многих полярных и ионных частиц, которые затем могут реагировать с водой.
как кислота, основание или и то, и другое. Применение химических концепций к таким водным системам,
трактуется в соответствии с формализмом Бренстеда-Лоури, обеспечивает важную основу для
биохимия и физиология. Свойства буфера в водных системах попадают в эту категорию.
15.1: Структура воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53837
В своей известной поэме «Сказание о древнем мореплавателе» Сэмюэл Кольридж написал: «Вода, везде вода, ни капли для питья». Кольридж говорил о том, что он был в океане, но у него не было воды, потому что он убил альбатроса (очевидно, это принесло несчастье всем на корабле). \text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
\text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
Изогнутая форма молекулы воды имеет решающее значение, поскольку полярные связи \(\ce{O-H}\) не компенсируют друг друга, а молекула в целом полярна. На рисунке ниже показана чистая полярность молекулы воды. Кислород — отрицательный конец молекулы, а область между атомами водорода — положительный конец молекулы.
Рисунок \(\PageIndex{2}\): Вода является полярной молекулой, так как большая электронная плотность находится вокруг более электроотрицательного атома кислорода. Полярные молекулы притягиваются друг к другу диполь-дипольными силами, так как положительный конец одной молекулы притягивается к отрицательному концу соседней молекулы. В случае воды высокополярные связи \(\ce{O-H}\) приводят к очень малой электронной плотности вокруг атомов водорода. Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы.
Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы.
Поскольку каждый атом кислорода имеет две неподеленные пары, он может образовывать водородные связи с атомами водорода двух отдельных других молекул. На рисунке ниже показан результат — приблизительно тетраэдрическая геометрия вокруг каждого атома кислорода, состоящая из двух ковалентных связей и двух водородных связей.
Рисунок \(\PageIndex{4}\): В результате наличия двух ковалентных связей и двух водородных связей геометрия вокруг каждого атома кислорода приблизительно тетраэдрическая.Резюме
- Вода представляет собой молекулярное соединение, состоящее из полярных молекул изогнутой формы.
- Атом кислорода приобретает частичный отрицательный заряд, а атом водорода — частичный положительный заряд.


 Дальнейшие последствия использования воды как биологического растворителя.
Дальнейшие последствия использования воды как биологического растворителя.