Литий-ионный аккумулятор (Li-ion) | Принцип работы
В настоящее время литий-ионный аккумулятор используется абсолютно во всей домашней и портативной электронике.
 li-on аккумуляторы в гаджетах и устройствах
li-on аккумуляторы в гаджетах и устройствахМожно без преувеличения сказать: без портативных источников питания, мир современной техники был бы намного беднее. Все разнообразие карманных электронных гаджетов, приборов, смартфонов, гироскутеров, электромобилей наконец, стало возможным благодаря литий-ионным аккумуляторам.
Принцип работы литий-ионного аккумулятора
Давайте рассмотрим литий-ионный аккумулятор. Как видите, он состоит из нескольких слоев с различным химическим составом.
 состав литий-ионного аккумулятора
состав литий-ионного аккумулятораВ основе работы литий-ионного аккумулятора лежит, так называемый, электрохимический потенциал. Суть его в том, что металлы стремятся «отдавать» свои электроны. Как видно на рисунке ниже, наибольшая способность к отдаче электронов – у лития, а наименьшая – у фтора. Если такой атом отдает свой электрон, то он становится положительным ионом.
 электрохимический ряд элементов
электрохимический ряд элементов
Первая в истории электрическая батарейка, созданная более 200 лет назад Алессандро Вольтой, работала как раз на принципе электрохимического потенциала. Вольта взял два металла с разными электрохимическими потенциалами (цинк и серебро) и получил электрический ток. В честь его открытия такую “батарейку” назвали Вольтовым столбом.
 Вольтов столб
Вольтов столб
В 1991 г. Sony выпустила первый коммерчески успешный литий-ионный аккумулятор.
 первый литий-ионный аккумулятор
первый литий-ионный аккумуляторВ литий-ионных элементах используется металл с наибольшей способностью отдавать электроны – литий. У лития всего один электрон на внешней орбите, и он постоянно стремится его «потерять».
 атом лития
атом литияИз-за этого литий считается чрезвычайно химически активным металлом. Он реагирует даже с водой и воздухом. Но активен только чистый литий, а вот его оксид, напротив, очень стабилен.
 оксид лития
оксид литияЭто свойство лития как раз используется при создании литий-ионных аккумуляторов.
Допустим, мы каким-то образом отделили атом лития от оксида. Этот атом будет крайне нестабилен и сразу превратится в положительный ион, потеряв электрон.
 положительный ион
положительный ионОднако в составе оксида литий гораздо более стабилен, чем одинокий атом лития. Если мы сможем каким-то образом обеспечить движение по двум отдельным путям для электрона и для положительного иона лития, то ион самостоятельно достигнет оксида и встанет там на свое место. При этом мы получим электрический ток благодаря движению электрона.

Итак, можно получить электрический ток из оксида лития, если сначала отделить атомы лития от оксида и затем направить потерянные ими электроны по внешней цепи. Рассмотрим, как эти две задачи решаются в литий-ионных элементах.
Строение литий-ионного аккумулятора
Помимо оксида лития, элементы содержат также электролит и графит. В графите связь между слоями гораздо слабее, чем между атомами внутри слоев, поэтому графит имеет слоистую структуру.
 строение литий-ионного аккумулятора
строение литий-ионного аккумулятораЭлектролит, помещенный между оксидом лития и графитом, служит барьером, пропускающим сквозь себя только ионы лития. Электроны же не могут проникать сквозь электролит и отскакивают от него, как теннисный мячик об стенку. В качестве электролита используется органическая соль лития, которая наносится на слой разделителя (о разделителе ниже в статье).
 электролит пропускает ионы и не пропускает электроны
электролит пропускает ионы и не пропускает электроныПроцесс заряда и разряда литий-ионного аккумулятора
Итак, у нас есть разряженный аккумулятор
 литий-ионный аккумулятор разряженный
литий-ионный аккумулятор разряженныйДавайте же его зарядим. Для этого нам нужен какой-либо источник питания. Что произойдет в этот момент на самом литий-ионном аккумуляторе? Положительный полюс начнет притягивать электроны, «вытаскивая» их из оксида лития.
 процесс зарядки литий-ионного аккумулятора
процесс зарядки литий-ионного аккумулятораПоскольку электроны не могут проникать через электролит, то они движутся по внешней цепи через источник питания.

и в конце концов достигают графита

где очень удобно располагаются в слоях графита.

В этот же самый момент положительные ионы лития притягиваются отрицательным полюсом, проходя сквозь электролит и также попадают в графит, размещаясь между его слоями.

Когда все ионы лития достигнут графита и будут «захвачены» его слоями, батарея будет полностью заряжена.

Такое состояние батареи неустойчивое. Это можно представить как шар, который находится на самой верхушке холма и в любой момент может скатиться.

Вот мы и достигли первой цели: электроны и ионы лития отделены от оксида. Теперь надо как-то сделать так, чтобы электроны и ионы двигались разными путями. Как только мы подключим какую-либо нагрузку к нашему заряженному литий-ионному аккумулятору, то начнется обратный процесс. В этом случае ионы лития через электролит пожелают вернуться в свое изначальное состояние.

Поэтому они начнут двигаться обратно сквозь электролит, а электроны побегут через внешнюю цепь, то есть через нагрузку.
 генерация электрического тока в литий-ионном аккумуляторе
генерация электрического тока в литий-ионном аккумулятореТак как электрический ток – это не что иное, как упорядоченное движение заряженных частиц, то в цепи лампочки накаливания возникнет электрический ток, который заставит эту самую лампочку светиться.

Как только все электроны “убегут” из графита, то батарея полностью разрядится. Чтобы ее снова зарядить, достаточно поставить аккумулятор “на зарядку”.
 разряженный литий-ионный аккумулятор
разряженный литий-ионный аккумуляторПри этом графит сам по себе не участвует в химических реакциях – он лишь служит «складом» для ионов и электронов лития.
Слой разделителя в литий-ионном аккумуляторе
Если внутренняя температура элемента по какой-то причине начнет расти, жидкий электролит высохнет, и произойдет короткое замыкание между анодом и катодом. В результате элемент может загореться или даже взорваться.

Чтобы этого не произошло, между электродами помещается дополнительный изолирующий слой, называемый разделителем. Разделитель проницаем для ионов лития благодаря наличию микропор. Электроны он не пропускает.
 разделитель в литий-ионном аккумуляторе
разделитель в литий-ионном аккумулятореИз чего делают литий-ионный аккумулятор
В реальных литий-ионных аккумуляторах графит и оксид лития наносятся в виде покрытия на медную и алюминиевую фольгу. Ниже на рисунке мы видим, что на тонком листе меди у нас располагается графит, а на тонком листе алюминия – оксид лития.

Минус аккумулятора снимается с медной фольги, а плюс – с алюминиевой.

ну а между ними располагается еще разделитель, пропитанный электролитом

Для того, чтобы уменьшить объем, все эти три слоя сворачивают в “рулончик”.

 цилиндрический аккумулятор строение
цилиндрический аккумулятор строениеобразуя при этом всем нам знакомую литий-ионную цилиндрическую батарейку

Литий-ионные аккумуляторы в автомобиле Tesla
Вообразите мир, в котором все машины оснащены электродвигателями, а не двигателями внутреннего сгорания. Электромоторы превосходят ДВС практически по всем техническим показателям, да к тому же намного дешевле и надежнее. У ДВС есть существенный недостаток: он выдает достаточный крутящий момент лишь в узком диапазоне скоростей. В общем, электродвигатель – однозначно лучший выбор для автомобиля. Об этом мы писали еще в статье про автомобиль Тесла.
 Сравнение электромобилей и автомобилей с ДВС
Сравнение электромобилей и автомобилей с ДВСНо есть одно «узкое место», из-за которого электрическая революция в автопроме постоянно откладывается – это источники питания. Долгое время громоздкие, тяжелые, недолговечные и ненадежные аккумуляторы электромобилей никак не могли составить конкуренцию полному баку бензина. Но все изменилось, когда на рынок вышел производитель электромобилей Тесла.
Именно литий-ионные аккумуляторы использует компания Тесла для своих электрокаров.

Стандартный элемент выдает напряжение 3,7 – 4,2 В. Множество таких элементов, соединенных последовательно и параллельно, образуют модуль.
 батарейный модуль Тесла
батарейный модуль ТеслаЛитий-ионные элементы при работе выделяют много тепла. При этом высокая температура снижает срок службы и эффективность самих элементов. Для контроля температуры, а также их уровня заряда, защиты от перезаряда и общего состояния элементов питания, служит специальная система управления батареями (Battery management system, сокращенно BMS). В батареях Tesla используется спиртовая система охлаждения. BMS регулирует скорость движения спирта в системе, поддерживая оптимальную температуру батарей.
 радиатор для аккумуляторов Тесла
радиатор для аккумуляторов ТеслаЕще одна важнейшая функция BMS – защита от перезаряда. Допустим, есть три элемента с разной емкостью. Во время зарядки элемент с большей емкостью зарядится сильнее двух остальных. Чтобы этого не допустить, BMS использует так называемое выравнивание заряда элементов (cell balancing). При этом все элементы заряжаются и разряжаются равномерно и защищены от чрезмерного или недостаточного заряда.
 равномерный заряд аккумуляторов , благодаря технологии BMS
равномерный заряд аккумуляторов , благодаря технологии BMSИ в этом преимущество Tesla над технологией аккумуляторов Nissan. У Nissan Leaf серьезная проблема с охлаждением аккумулятора из-за большого размера элементов и отсутствия системы активного охлаждения.
 батарея Nissan Leaf и Tesla
батарея Nissan Leaf и TeslaУ конструкции с множеством маленьких цилиндрических элементов есть и еще одно преимущество: при большом расходе энергии нагрузка распределяется равномерно между всеми элементами. Если бы вместо множества маленьких элементов был один огромный элемент, из-за постоянных нагрузок он очень быстро бы пришел в негодность. Tesla сделала ставку на маленькие цилиндрические элементы, технология производства которых уже хорошо отработана. Более подробно про батарейный модуль Тесла читайте в этой статье.
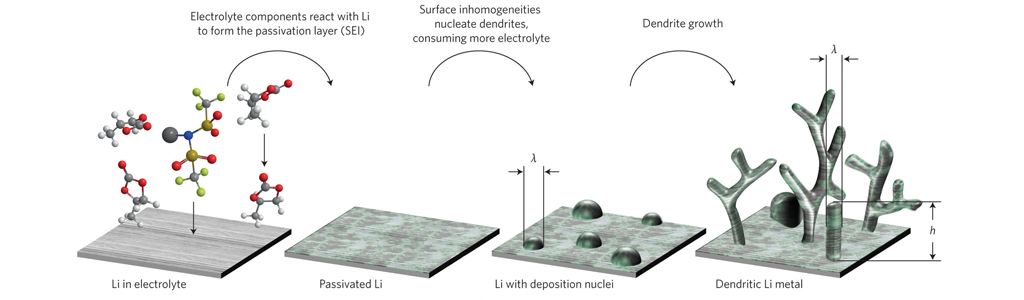
Защитный SEI-слой
Во время первой зарядки внутри литий-ионного элемента происходит одно замечательное явление, спасающее элемент от скорой «смерти». Неожиданной проблемой оказались электроны, находящиеся в слое графита. При контакте с электролитом они начинают разрушать его. Но одно случайное открытие позволило не допустить контакт электронов с электролитом. При первой зарядке элемента, как мы уже говорили, ионы лития движутся сквозь электролит. В процессе этого движения молекулы растворенного в электролите вещества покрывают ионы. Достигнув графитового слоя, ионы лития вместе с молекулами раствора электролита реагируют с графитом, образуя так называемая промежуточную фаза твердого электролита (solid electrolyte interphase, или SEI-слой). Этот слой предотвращает контакт электронов с электролитом, предохраняя электролит от разрушения.
 защитный SEI-слой
защитный SEI-слойВот так проблема случайным образом решилась сама собой. Хотя эффект SEI был открыт случайно, в последующие два десятилетия ученые целенаправленно улучшали процесс, подбирая наиболее эффективную толщину и химический состав.
Заключение
Сегодня уже удивительно, что еще два десятка лет назад в электронных гаджетах не применялись литий-ионные аккумуляторы. Индустрия литий-ионных аккумуляторов развивается с фантастической скоростью: ожидается, что в ближайшие несколько лет их рынок достигнет 90 млрд. долларов. Современные литий-ионные батареи способны выдержать примерно 3000 циклов зарядки-разрядки – это уже приличный показатель, но еще есть, куда расти. Лучшие умы во всем мире трудятся над тем, чтобы повысить их долговечность до 10 000 циклов. В этом случае аккумулятор электромобиля не придется заменять целых 25 лет. Миллионы долларов вкладываются в исследования, которые позволят заменить графит на кремний в качестве «хранилища» в литий-ионных элементах. Если это удастся сделать, их емкость возрастет более чем в пять раз! В настоящее время мир переходит уже на литий-полимерные аккумуляторы, которые показали себя чуточку лучше, чем литий-ионные.
Материал подготовлен по статье
www.ruselectronic.com
Новое поколение батареек: литий-металлические

Ученые вплотную приблизились к разработке более безопасных и долговечных литиево-металлических батарей.
Li-Metal-аккумуляторы, как ожидается, станут основой хранения энергии высокой плотности в будущем.
Исследования Университета штата Аризона подтолкнули учёных к разработке литиево-металлических батарей, которые имеют все шансы заменить литий-ионные и литий-полимерные элементы питания. Это наиболее перспективный кандидат.
Что из себя представляют литий-металлические батареи?
Первые варианты концепции «Li-Metal» оборачивались неконтролируемым ростом литий-дендрита, что приводило к недостаточной подзарядке и опасным химическим процессам.
Дендрит — отросток нейрона на аноде (отрицательный электрод), похожий на игольчатые наросты на поверхности литиевого металла. Они вызывают нежелательные побочные реакции, снижающие плотность энергии и приводящие к замыканию электродов при неправильной установке (такое может окончиться пожаром).
Университет штата Аризона решил эту проблему. Благодаря привлечению трёхмерного слоя Полидиметилсилоксана (ПДМС) или силикона в качестве изоляции литий-металлического анода образование дендритов уменьшилось в разы. В результате учёные смогли увеличить срок службы батареи и уменьшить риски безопасности.
Достижение затрагивает любые металлы в качестве анода — то есть теоретически относится и к литий-ионным и литиево-воздушным аккумуляторам. Исследование уже успешно проводили для батарей, где применяется цинк, натрий или алюминий.
Когда литий-металлические батареи появятся в продаже?
Чтобы довести новый тип аккумуляторов Li-Metal до коммерческого запуска, инженерам предстоит изобрести недорогую и надёжную конструкцию с применением нового изолятора. Изначально литий-металлические элементы питания планируется внедрить в электромобилях в ближайшем будущем. И только затем их сфера применения будет всё больше пересекаться с современными литий-ионными АКБ.
Это не единственная разработка учёных, направленная на исправление ситуации с остановившимся аккумуляторным прогрессом. Протонные батареи не так давно тоже вышли на финишную прямую, приближая то будущее, когда мы станём всё меньше задумываться о подзарядке мобильных гаджетов, электромобилей и портативных потребительских устройств.
neovolt.ru
Революция закончилась. Есть ли альтернатива литий-ионному аккумулятору?
Недавно мы рассказывали об истории изобретения литий-ионных аккумуляторов, которые дали мощнейший толчок развитию портативной электроники. Каждый год технологические СМИ сообщают нам о готовящейся энергетической революции — ещё чуть-чуть, еще год-другой, и мир увидит аккумуляторы с фантастическими характеристиками. Время идет, а революции не видно, в наших телефонах, ноутбуках, квадрокоптерах, электромобилях и смарт-часах по-прежнему установлены разные модификации литий-ионных батарей. Так куда делись все инновационные аккумуляторы и есть ли вообще какая-то альтернатива Li-Ion?
Когда ждать аккумуляторную революцию?
Жаль вас расстраивать, но она уже прошла. Просто растянулась на пару десятилетий и потому осталась почти незамеченной. Дело в том, что изобретение литий-ионных батарей стало апогеем эволюции химических аккумуляторов.
Химические источники тока основаны на окислительно-восстановительной реакции между элементами. В периодической таблице существует всего 90 природных элементов, которые могут участвовать в такой реакции. Так вот, литий оказался металлом с предельными характеристиками: самой низкой массой, самым низким электродным потенциалом (–3,05 В) и самой высокой токовой нагрузкой (3,83 А·ч/г).
Литий является лучшим активным веществом для катода из существующих на Земле. Использование других элементов может улучшить одну характеристику и неизбежно ухудшит другую. Именно поэтому уже 30 лет продолжаются эксперименты именно с литиевыми батареями — комбинируя материалы, среди которых бессменно есть литий, исследователи создают типы аккумуляторов с нужными характеристиками, которые находят очень узкое применение. Старый-добрый аккумулятор с катодом из оксида литий-кобальта, который пришел к нам аж из 80-х годов прошлого века, до сих пор можно считать самым распространенным и универсальным благодаря отличному сочетанию напряжения, токонагрузки и энергетической плотности.
Поэтому, когда очередной стартап устами СМИ громко обещает миру энергетическую революцию со дня на день, ученые скромно умалчивают о том, что у новых батарей есть некоторые проблемы и ограничения, которые только предстоит решить. Решить их обычно не получается.
Главная проблема «революционных» батарей
Сегодня существует множество типов аккумуляторов с разным химических составом, в том числе и без использования лития. Каждый из типов со своими характеристиками нашел свое применение в определенном виде техники. Легкие, тонкие и с высоким напряжением литий-кобальтовые аккумуляторы давно прописались в компактных смартфонах. Выносливые, мощные, но очень габаритные литий-титанатные батареи уместились в общественном транспорте. А малоемкие пожаробезопасные литий-фосфатные ячейки используются в виде больших массивов на электростанциях. Но всё же самыми востребованными являются именно литий-кобальтовые батареи для потребительской мобильной техники. Главные критерии, которым они отвечают, — высокое напряжение 3,6 В при сохранении высокой энергоемкости на единицу объема. К сожалению, многие альтернативные виды литиевых батарей имеют гораздо меньшее напряжение — ниже 3,0 В и даже ниже 2,0 В — запитать от которых современный смартфон невозможно.
Компенсировать проседание любой из характеристик можно объединением батарей в ячейки, но тогда растут габариты. Так что если очередная перспективная батарея с чудо-характеристиками оказывается непригодной для применения в мобильной технике или электромобилях, ее будущее почти гарантированно предрешено. Зачем нужен аккумулятор со сроком жизни в 100 тысяч циклов и быстрой зарядкой, от которого можно запитать разве что наручные часы со стрелками?
Неудачные эксперименты
Не все из описанных далее аккумуляторов можно считать неудачными — некоторые требуют очень долгой доработки, некоторые могут найти свое применение не в смартфонах, а специализированной технике. Тем не менее, все эти разработки позиционировали как замену литий-ионных батарей в смартфонах.
В 2007 году американский стартап Leyden Energy получил $4,5 млн инвестиций от нескольких венчурных фондов на создание, как они сами заявляли, литий-ионных батарей нового поколения. Компания использовала новый электролит (Solvent-in-Salt) и кремниевый катод, которые позволили значительно увеличить энергоемкость и стойкость к высоким температурам вплоть до 300 °C. Попытки сделать на основе разработок аккумуляторы для ноутбуков закончились неудачно, поэтому Leyden Energy переориентировался на рынок электромобилей.
Несмотря на постоянные вливания десятков миллионов долларов, компания так и не смогла наладить производство аккумуляторов со стабильными характеристиками — показатели плавали от экземпляра к экземпляру. Будь у компании больше времени и финансирования, возможно, ей и не пришлось бы в 2012 году распродавать оборудование, патенты и уходить под крыло другой энергетической компании, A123 Systems.
Литий-металлические батареи — не новость: к их числу относится любая неперезаряжаемая литиевая батарейка. SolidEnergy занялась созданием перезаряжаемых литий-металлических ячеек. Новый продукт обладал удвоенной энергоемкостью по сравнению с литий-кобальтовыми батареями. То есть в прежний объем можно было уместить вдвое больше энергии. Вместо традиционного графита на катоде в них использовалась литий-металлическая фольга. До недавних пор литий-металлические аккумуляторы были крайне взрывоопасны из-за роста дендритов (вырастающих на аноде и катоде деревообразных металлических образований), приводивших к короткому замыканию, но добавление в электролит серы и фосфора помогло избавиться от дендритов (правда, SolidEnergy пока не обладает технологией). Помимо очень высокой цены среди известных проблем аккумуляторов SolidEnergy значится долгая зарядка — 20% от емкости в час.
Сравнение размеров литий-металлической и литий-ионной батарей равной емкости. Источник: SolidEnergy Systems
Активные работы над серно-магниевыми элементами начали в 2010-х годах, когда Toyota объявила об исследованиях в этой области. Анодом в таких батареях является магний (хороший, но не равноценный аналог лития), катод состоит из серы и графита, а электролит представляет собой обычный соляной раствор NaCl. Проблема электролита в том, что он разрушает серу и делает аккумулятор неработоспособным, поэтому заливать электролит приходилось непосредственно перед использованием.
Инженеры Toyota создали электролит из ненуклеофильных частиц, неагрессивный к сере. Как оказалось, стабилизированный аккумулятор все равно невозможно использовать на протяжении долгого времени, так как спустя 50 циклов его емкость падает вдвое. В 2015 году в состав батареи интегрировали литий-ионную добавку, а спустя еще два года обновили электролит, доведя срок службы аккумулятора до 110 циклов. Единственная причина, по которой продолжаются работы над столь капризной батареей, это высокая теоретическая энергоемкость (1722 Вт·ч/кг). Но может оказаться, что к моменту появления удачных прототипов серно-магниевые элементы уже будут не нужны.
Выработка вместо накопления энергии
Некоторые исследователи предлагают пойти от обратного: не запасать, а вырабатывать энергию прямо в устройстве. Можно ли превратить смартфон в маленькую электростанцию? За последнее десятилетие было несколько попыток избавить гаджеты от необходимости в подзарядке через электросеть. Судя по тому, как мы сейчас заряжаем смартфоны, попытки оказались неудачными — напомним о самых «удачных» изобретениях.
Топливная ячейка с прямым распадом метанола (DFMC). Попытки внедрить топливные элементы на метаноле в мобильную технику начались в середине 2000-х. В это время как раз происходил переход от долгоживущих кнопочных телефонов к требовательным смартфонам с большим экраном — литий-ионных аккумуляторов в них хватало максимум на два дня работы, поэтому идея мгновенной перезарядки казалась очень привлекательной.
В топливной ячейке метанол на полимерной мембране, выступающей в роли электролита, окисляется в диоксид углерода. Протон водорода переходит к катоду, соединяется с кислородом и образует воду. Нюанс: для эффективного протекания реакции нужна температура около 120 °C, но ее можно заменить платиновым катализатором, что закономерно влияет на стоимость элемента.
Уместить топливный элемент в корпус телефона оказалось невозможно: слишком уж габаритным получался топливный отсек. Поэтому к концу 2000-х идея DFMC оформилась в виде портативных аккумуляторов (пауэр-банков). В 2009 году Toshiba выпустила в продажу серийный пауэр-банк на метаноле под названием Dynario. Он весил 280 г и размерами напоминал современные портативные аккумуляторы на 30000 мА·ч, то есть был размером с ладонь. Цена на Dynario в Японии составляла впечатляющие $328 и еще $36 за комплект из пяти пузырьков по 50 мл метанола. Одна «заправка» требует 14 мл, ее объема хватало на две зарядки кнопочного телефона через USB током 500 мА.
Видео с демонстрацией заправки и работы Toshiba DynarioДальше выпуска экспериментальной партии в 3000 экземпляров дело не пошло, потому что топливный пауэр-банк оказался слишком противоречивым: сам по себе дорог, с дорогими расходниками и высокой стоимостью одной зарядки телефона (около $1 для кнопочного). Кроме того, метанол ядовит и в некоторых странах требует лицензии на его продажу и даже покупку.
Прозрачные солнечные панели. Солнечные батареи — это отличное решение для добычи нескончаемой (на нашем веку) энергии Солнца. У таких панелей невысокий КПД при высокой стоимости и слишком малая мощность, при этом они являются самым простым способом выработки электричества. Но настоящей мечтой человечества являются прозрачные солнечные панели, которые можно было бы устанавливать вместо стекол в окна домов, автомобилей и теплиц. Так сказать, сочетать приятное с полезным — генерирование электроэнергии и естественное освещение пространства. Хорошая новость заключается в том, что прозрачные солнечные панели существуют. Плохая — в том, что они практически бесполезны.
Разработчик и Университете Мичигана демонстрирует прозрачную панель без рамки. Источник: YouTube / Michigan State University
Чтобы «поймать» фотоны света и превратить их в электричество, солнечная панель в принципе не может быть прозрачной, но новый прозрачный материал может поглощать УФ- и ИК-излучение, переводя всё в ИК-диапазон и отводя на грани панели. По краям прозрачной панели в качестве рамки установлены обычные кремниевые фотовольтаические панели, которые улавливают отведенный свет в ИК-диапазоне и вырабатывают электричество. Система работает, только с КПД 1-3%… Средний КПД современных солнечных батарей составляет 20%.
Несмотря на более чем сомнительную эффективность решения, известный производитель часов TAG Heuer в 2014 году анонсировал премиальный кнопочный телефон Tag Heuer Meridiist Infinite, в котором поверх экрана была установлена прозрачная солнечная панель производства Wysis. Еще во время анонса решения для смартфонов Wysis обещала мощность такой солнечной зарядки порядка 5 мВт с 1 см2 экрана, что крайне мало. Например, это всего 0,4 Вт для экрана iPhone X. Учитывая, что комплектный адаптер смартфона Apple ругают за неприлично низкую мощность 5 Вт, понятно, что с мощностью 0,4 Вт его не зарядишь.
Кстати, пускай с метанолом не получилось, но топливные ячейки на водороде получили билет в жизнь, став основой электромобиля Toyota Mirai и мобильных электростанций Toshiba.
А что получилось: удачные эксперименты с Li-Ion
Успеха достигли те, кто не рвался во что бы то ни стало перевернуть мир, а просто работал над совершенствованием отдельных характеристик аккумуляторов. Смена материала катода сильно влияет на напряжение, энергоемкость и жизненный цикл батарей. Далее мы расскажем о прижившихся разработках, которые лишний раз подтверждают универсальность литий-ионной технологии — на каждую «революционную» разработку находится более эффективный и дешевый существующий аналог.
Литий-марганцевый (LiMn2O4, или LMO). Рабочее напряжение: 3,7 В, энергоемкость до 150 Вт·ч/кг, срок жизни до 700 циклов. Первый эффективный альтернативный состав был разработан еще до начала продаж литий-ионных аккумуляторов как таковых. На катоде использовалась литий-марганцевая шпинель, позволившая уменьшить внутреннее сопротивление и значительно повысить отдаваемый ток. Литий-марганцевые аккумуляторы применяются в требовательном к силе тока оборудовании, например, электроинструменте.
Литий-никель-марганец-кобальтовые (LiNiMnCoO2, или NMC). Рабочее напряжение: 3,7 В, энергоемкость до 220 Вт·ч/кг, срок жизни до 2000 циклов. Сочетание никеля, марганца и кобальта оказалось очень удачным, аккумуляторы нарастили и энергоемкость, и силу отдаваемого тока. В тех же «банках» 18650 емкость поднялась до 2800 мА·ч, а максимальный отдаваемый ток — до 20 А. NMC-аккумуляторы устанавливают в большинство электромобилей, иногда разбавляя их литий-марганцевыми ячейками, так как у таких аккумуляторов большой срок жизни.
Новая NMC-батарея электрокара Nissan Leaf по расчетам производителя проживет 22 года. Прошлый LMO-аккумулятор имел меньшую емкость и изнашивался гораздо быстрее. Источник: Nissan
Литий-железо-фосфатный (LiFePO4, или LFP). Рабочее напряжение: 3,3 В, энергоемкость до 120 Вт·ч/кг, срок жизни до 2000 циклов. Открытый в 1996 году состав помог увеличить силу тока и повысить жизненный цикл литий-ионных аккумуляторов до 2000 зарядок. Литий-фосфатные батареи безопаснее предшественников, лучше выдерживают перезаряд. Вот только энергоемкость у них неподходящая для мобильной техники — при поднятии напряжения до 3,2 В энергоемкость снижается минимум вдвое относительно литий-кобальтового состава. Но зато у LFP меньше проявляется саморазряд и наблюдается особая выносливость к низким температурам.
Массив литий-фосфатных ячеек с общей емкостью 145,6 кВт⋅ч. Такие массивы используют для безопасного накопления энергии с солнечных батарей. Источник: Yo-Co-Man / Wikimedia
Литий-никель-кобальт-алюминий-оксидный (LiNiCoAlO2, или NCA). Рабочее напряжение: 3,6 В, энергоемкость до 260 Вт·ч/кг, срок жизни до 500 циклов. Очень похож на NMC-аккумулятор, обладает отличной энергоемкостью, подходящим для большинства техники номинальным напряжением 3,6 В, но высокая стоимость и скромный срок жизни (порядка 500 циклов зарядки) не дают NCA-батареям победить конкурентов. Пока что их используют лишь в некоторых электромобилях.
Литий-титанатный (Li4Ti5O12, или SCiB/LTO). Рабочее напряжение: 2,4 В, энергоемкость до 80 Вт·ч/кг, срок жизни до 7000 циклов (SCiB: до 15 000 циклов). Один из самых интересных типов литий-ионных аккумуляторов, в которых анод состоит из нанокристаллов титаната лития. Кристаллы помогли увеличить площадь поверхности анода с 3 м2/г в графите до 100 м2/г, то есть более чем в 30 раз! Литий-титанатный аккумулятор заряжается до полной емкости в пять раз быстрее и отдает в десять раз более высокий ток, чем другие батареи. Однако у литий-титанатных аккумуляторов есть свои нюансы, ограничивающие сферу применения батарей. А именно, низкое напряжение (2,4 В) и энергоемкость в 2-3 раза ниже, чем у других литий-ионных аккумуляторов. Это значит, что для достижения аналогичной емкости литий-титанатную батарейку надо увеличить в объеме в несколько раз, из-за чего в тот же смартфон ее уже не вставишь.
SCiB-модуль производства Toshiba с емкостью 45 А·ч, номинальным напряжением 27,6 В и током разрядки 160 А (импульсно до 350 А). Весит 15 кг, а размером с коробку для обуви: 19х36х12 см. Источник: Toshiba
Зато литий-титанатные батареи сразу же прописались в транспорт, где важна быстрая зарядка, высокие токи при разгоне и устойчивость к холодам. Например, электромобилях Honda Fit-EV, Mitsubishi i-MiEV и в московских электробусах! На старте проекта московские автобусы использовали другой тип батарей, из-за чего возникали неполадки еще на середине первого проезда по маршруту, но после установки литий-титанатных батарей производства Toshiba сообщений о разрядившихся электробусах больше не поступало. SCiB-аккумуляторы Toshiba благодаря использованию в аноде титана-ниобия восстанавливают до 90% емкости всего за 5 минут — допустимое время для стоянки автобуса на конечной остановке, где есть зарядная станция. Число циклов зарядки, которое выдерживает SCiB-батарея, превосходит 15 000.
Энергетическая сингулярность
Больше полувека человечество мечтает уместить в батарейки энергию атома, которая обеспечивала бы электричество многие годы. На самом деле еще в 1953 году был изобретен бетавольтаический элемент, в котором в результате бета-распада радиоактивного изотопа электроны превращали атомы полупроводника в ионы, создавая электрический ток. Такие батареи используются, например, в кардиостимуляторах.
А что насчет смартфонов? Да пока ничего, мощность атомных элементов ничтожна, она измеряется в милливаттах и даже микроваттах. Купить такой элемент питания можно даже в интернет-магазине, правда, запитать от него не выйдет даже пресловутые наручные часы.
Долго ли ждать атомных батареек? Пожалуйста, City Labs P200 — 2,4 В, 20 лет службы, правда, мощность до 0,0001 Вт и цена около $8000. Источник: City Labs
С момента изобретения стабильных литий-ионных аккумуляторов до начала их серийного производства прошло более 10 лет. Возможно, одна из очередных новостей о прорывном источнике питания станет пророческой, и к 2030-м годам мы попрощаемся с литием и необходимостью ежедневной зарядки телефонов. Но пока именно литий-ионные батареи определяют прогресс в области носимой электроники и электромобилей.
habr.com
история создания литий-ионных аккумуляторов / Toshiba corporate blog / Habr
Перед тем как перейти к чтению, посчитайте, сколько устройств с аккумуляторами находится рядом с вами в радиусе нескольких метров. Наверняка, вы увидите смартфон, планшет, «умные» часы, фитнес-трекер, ноутбук, беспроводную мышь? Во всех этих устройствах установлены литий-ионные аккумуляторы — их изобретение можно считать одним из самых важных событий в области энергетики.
Легкие, ёмкие и компактные литий-ионные аккумуляторы способствовали буму портативной электроники, существование которой ранее было невозможным. Вот только гаджеты за последние 30 лет совершили фантастический технологический скачок, а современные литий-ионные аккумуляторы почти не отличаются от первых серийных образцов начала 1990-х годов. Кто и как изобрел литий-ионные перезаряжаемые батареи, какие составы в них используются и существует ли мировой заговор против «вечных» аккумуляторов? Рассказываем.
Легенда о первой батарейке
Между первой попыткой добыть электричество химическим способом и созданием литий-ионных аккумуляторов прошло, возможно, два тысячелетия. Существует неподтверждённая догадка, что первым рукотворным гальваническим элементом в истории человечества была «багдадская батарейка», найденная в 1936 году близ Багдада археологом Вильгельмом Кёнигом. Находка, датируемая II-IV веком до н. э., представляет собой глиняный сосуд, в котором находятся медный цилиндр и железный стержень, пространство между которыми могло заполняться «электролитом» — кислотой или щелочью. Современная реконструкция находки показала, что при заполнении сосуда лимонным соком можно добиться напряжения до 0,4 вольт.
«Багдадская батарейка» вполне похожа на портативный аккумулятор. Или чехол для папирусов? Источник: Ironie / Wikimedia
Для чего могла использоваться «багдадская батарейка», если до открытия электричества оставалась пара тысяч лет? Возможно, ее использовали для аккуратного нанесения золота на статуэтки методом гальванизации — тока и напряжения с «батарейки» для этого вполне хватает. Впрочем, это только теория, ибо никаких свидетельств об использовании электричества и этой самой «батарейки» древними народами до нас не дошло: позолоту в то время наносили методом амальгамирования, а сам необычный сосуд с тем же успехом мог быть всего лишь защищенным контейнером для свитков.
Теория небольшого взрыва
Русская поговорка «Не было бы счастья, да несчастье помогло» как нельзя лучше иллюстрирует ход работ над литий-ионными батареями. Без одного неожиданного и неприятного происшествия создание новых аккумуляторов могло бы задержаться на несколько лет.
Еще в 1970-х годах британец Стэнли Уиттингэм (Stanley Whittingham), работавший в топливно-энергетической компании Exxon, при создании перезаряжаемой литиевой батареи использовал анод из сульфида титана и литиевый катод. Первая перезаряжаемая литиевая батарея демонстрировала сносные показатели по току и напряжению, только периодически взрывалась и травила окружающих газом: дисульфид титана при контакте с воздухом выделял сероводород, дышать которым как минимум неприятно, как максимум — опасно. Помимо этого, титан во все времена был очень дорогим, а в 1970-е цена дисульфида титана составляла порядка $1000 за килограмм (эквивалент $5000 в наше время). Не говоря уже о том, что металлический литий на воздухе горит. Так что Exxon свернули проект Уиттингэма от греха подальше.
В 1978 году Коити Мидзусима (Koichi Mizushima), защитивший докторскую по физике, занимался исследовательской работой в Токийском университете, когда из Оксфорда ему пришло приглашение присоединиться к группе Джона Гуденафа (John Goodenough), занимавшейся поиском новых материалов для батарейных анодов. Это был очень многообещающий проект, так как потенциал литиевых источников питания уже был известен, но укротить капризный металл толком никак не удавалось — недавние эксперименты Уиттингэма показывали, что до начала серийного производства желанных литий-ионных батарей еще далеко.
В экспериментальных аккумуляторах использовались литиевый катод и сульфидный анод. Превосходство сульфидов над другими материалами в анодах задало Мидзусиме и его коллегам направление для поисков. Ученые заказали в свою лабораторию печь для производства сульфидов прямо на месте, чтобы быстрее экспериментировать с различными соединениями. Работа с печью закончилась не очень хорошо: в один день она взорвалась и вызвала пожар. Инцидент заставил команду исследователей пересмотреть свои планы: возможно, сульфиды, несмотря на их эффективность, были не лучшим выбором. Ученые сместили свое внимание в сторону оксидов, синтезировать которые было гораздо безопасней.
После множества тестов с различными металлами, в том числе железом и марганцем, Мидзусима обнаружил, что оксид литий-кобальта демонстрирует наилучшие результаты. Вот только использовать его надо не так, как до этого предполагала команда Гуденафа, — искать не материал, поглощающий ионы лития, а материал, который охотнее всего отдает ионы лития. Кобальт подходил лучше прочих ещё и потому, что отвечает всем требованиям по безопасности и к тому же повышает напряжение элемента до 4 вольт, то есть вдвое больше по сравнению с ранними вариантами батарей.
Применение кобальта стало важнейшим, но не последним шагом в деле создания литий-ионных аккумуляторов. Справившись с одной проблемой, ученые столкнулись с другой: плотность тока оказалась слишком мала, чтобы использование литий-ионных элементов было экономически оправданным. И команда, совершившая один прорыв, совершила и второй: при уменьшении толщины электродов до 100 микрон удалось повысить силу тока до уровня других типов аккумуляторов, при этом с удвоенным напряжением и емкостью.
Первые коммерческие шаги
На этом история изобретения литий-ионных батарей не заканчивается. Несмотря на открытие Мидзусимы, у команды Гуденафа ещё не было образца, готового к серийному производству. Из-за использования металлического лития в катоде во время заряда аккумулятора ионы лития возвращались на анод не ровным слоем, а дендритами — рельефными цепочками, которые, вырастая, вызывали короткое замыкание и фейерверк.
В 1980 году марокканский ученый Рашид Язами (Rachid Yazami) обнаружил, что графит отлично справляется с ролью катода, при этом он абсолютно пожаробезопасен. Вот только существующие в то время органические электролиты быстро разлагались при соприкосновении с графитом, поэтому Язами заменил их твердым электролитом. Графитовый катод Язами был вдохновлен открытием проводимости полимеров профессором Хидэки Сиракавой (Hideki Shirakawa), за что тот получил Нобелевскую премию по химии. А графитовый катод Язами до сих пор используется в большинстве литий-ионных аккумуляторов.
Запускаем в производство? И снова нет! Прошло еще 11 лет, исследователи повышали безопасность батарей, повышали напряжение, экспериментировали с разными материалами катода, прежде чем в продажу поступил первый литий-ионный аккумулятор.
Коммерческий образец был разработан Sony и японским химическим гигантом Asahi Kasei. Им стала батарея для пленочной любительской видеокамеры Sony CCD-TR1. Она выдерживала 1000 циклов зарядки, а остаточная емкость после такого износа была вчетверо выше, чем у никель-кадмиевого аккумулятора аналогичного типа.
Кобальтовый камень преткновения
До открытия Коити Мидзусимой литий-кобальтового оксида кобальт не был особо востребованным металлом. Его основные залежи были обнаружены на территории Африки в государстве, сейчас известном как Демократическая Республика Конго. Конго является крупнейшим поставщиком кобальта — 54% этого металла добывается здесь. Из-за политических потрясений в стране в 1970-х цена на кобальт взлетала на 2000%, но позже вернулась к прежним значениям.
Высокий спрос рождает высокие цены. Ни в 1990-х, ни в 2000-х годах кобальт не был одним из главных металлов на планете. Но что началось с популяризацией смартфонов в 2010-е! В 2000 году спрос на металл составлял примерно 2700 тонн в год. К 2010-му, когда по планете победно шагали iPhone и Android-смартфоны, спрос подскочил до 25000 тонн и продолжил расти год от года. Сейчас количество заказов превышает объем продаваемого кобальта в 5 раз. Для справки: более половины добываемого в мире кобальта идет на производство батарей.
График цен на кобальт за последние 4 года. Комментарии излишни. Источник: Elec.ru
Если в 2017 году цена за тонну кобальта составляла в среднем $24000, то с 2017 года она пошла круто вверх, в 2018 году достигнув пика на отметке $95500. Хоть в смартфонах используется всего 5-10 грамм кобальта, рост цен на металл отразился на стоимости устройств.
И это же одна из причин, почему производители электрокаров озаботились уменьшением доли кобальта в аккумуляторах автомобилей. Например, Tesla снизила массу дефицитного металла с 11 до 4,5 кг на одну машину, а в будущем планирует найти эффективные составы без кобальта вообще. Поднявшаяся аномально высоко цена на кобальт к 2019 году опустилась до значений 2015 года, но разработчики батарей активизировали работу по отказу или снижению доли кобальта.
В традиционных литий-ионных батареях кобальт составляет порядка 60% от всей массы. Используемый в автомобилях литий-никель-марганцевый состав включает от 10% до 30% кобальта в зависимости от желаемых характеристик батареи. Литий-никель-алюминиевый состав — всего 9%. Однако эти смеси не являются полноценной заменой оксиду литий-кобальта.
Проблемы Li-Ion
На сегодняшний день литий-ионные батареи различных типов — это лучшие аккумуляторы для большинства потребителей. Ёмкие, мощные, компактные и недорогие, они всё же имеют серьёзные недостатки, ограничивающие область использования.
Пожароопасность. Для нормальной работы литий-ионному аккумулятору обязательно нужен контроллер питания, предотвращающий перезаряд и перегрев. В противном случае батарея превращается в очень пожароопасную вещь, норовящую раздуться и взорваться на жаре или при заряде от некачественного адаптера. Взрывоопасность — пожалуй, главный недостаток литий-ионных аккумуляторов. Для повышения ёмкости внутри батарей уплотняется компоновка, из-за чего даже незначительное повреждение оболочки моментально приводит к пожару. Все помнят нашумевшую историю с Samsung Galaxy Note 7, в которых из-за тесноты внутри корпуса оболочка аккумулятора со временем перетиралась, внутрь проникал кислород и смартфон внезапно вспыхивал. С тех пор некоторые авиакомпании требуют перевозить литий-ионные батареи только в ручной клади, а на грузовых рейсах на упаковки с батареями лепят большую предупреждающую наклейку.
Разгерметизация — взрыв. Перезаряд — взрыв. За энергетический потенциал лития приходится платить мерами предосторожности
Старение. Литий-ионные батареи подвержены старению, даже если их не использовать. Поэтому купленный в качестве коллекционного нераспакованный смартфон 10-летней давности, например, самый первый iPhone, будет держать заряд значительно меньше из-за того самого старения батареи. Кстати, рекомендации хранить аккумуляторы заряженными до половины емкости имеют под собой основания — при полном заряде во время долгого хранения батарея гораздо быстрее теряет свою максимальную ёмкость.
Саморазряд. Накапливать в литий-ионных батареях энергию и хранить ее долгие годы — плохая идея. В принципе, все аккумуляторы теряют заряд, но литий-ионные делают этого особенно быстро. Если NiMH-ячейки теряют 0,08–0,33% за месяц, то Li-Ion-ячейки — по 2-3% в месяц. Таким образом, за год литий-ионных аккумулятор потеряет треть заряда, а через три года «сядет» до нуля. Справедливости ради скажем, что у никель-кадмиевых батарей всё ещё хуже — 10% в месяц. Но это совсем другая история.
Чувствительность к температуре. Охлаждение и перегрев сильно влияют на параметры такого аккумулятора: +20 °C градусов считаются идеальной температурой окружающей среды для литий-ионных батарей, если её уменьшить до +5 °C, то батарея отдаст устройству на 10% энергии меньше. Охлаждение ниже нуля забирает от емкости десятки процентов и к тому же влияет на здоровье аккумулятора: если пытаться его зарядить, например, от пауэр-банка — проявится «эффект памяти», а батарея безвозвратно потеряет емкость из-за образования на аноде металлического лития. При средних зимних российских температурах литий-ионная ячейка нефункциональна — оставьте телефон в январе на улице на полчаса, чтобы убедиться в этом.
Чтобы справиться с описанными проблемами, ученые экспериментируют с материалами анодов и катодов. При замене состава электродов одна большая проблема заменяется проблемами поменьше — пожаробезопасность влечет снижение жизненного цикла, а высокий ток разряда понижает удельную энергоемкость. Поэтому состав для электродов выбирается в зависимости от области применения аккумулятора.
Кто украл революцию?
Каждый год на новостных лентах появляются сообщения об очередном прорыве в деле создания чрезвычайно ёмких и выносливых аккумуляторов — вроде как, смартфоны будут работать по году без подзарядки, а заряжаться — за десять секунд. И где же та аккумуляторная революция, которую всем обещают учёные?
Часто в таких сообщениях журналисты передергивают факты, опуская какие-нибудь очень важные подробности. Например, у батареи с мгновенной зарядкой может оказаться очень низкая ёмкость, годная только для питания прикроватного будильника. Или напряжение не дотягивает и до одного вольта, хотя для смартфонов нужно 3,6 В. А ещё для получения путевки в жизнь аккумулятору нужно иметь низкую себестоимость и высокую пожаробезопасность. К сожалению, подавляющее большинство разработок уступало хотя бы по одному параметру, из-за чего «революционные» аккумуляторы так и не выходили за пределы лабораторий.
В конце 00-х Toshiba экспериментировала с перезаряжаемыми топливными ячейками на метаноле (на фото заправка батареи метанолом), но литий-ионные аккумуляторы всё равно оказались удобней. Источник: Toshiba
И, конечно, оставим в стороне теорию заговоров «производителям не выгодны бесконечные аккумуляторы». В наше время аккумуляторы в потребительских устройствах незаменяемые (вернее, поменять их можно, но сложно). 10-15 лет назад заменить испорченную батарею в мобильном телефоне было просто, но тогда источники питания и правда сильно теряли ёмкость за год-два активного использования. Современные литий-ионные аккумуляторы работают дольше, чем составляет средний жизненный цикл устройства. В смартфонах о замене батареи можно задумываться не ранее, чем через 500 циклов зарядки, когда она потеряет 10-15% емкости. И скорее сам телефон утратит актуальность, прежде чем аккумулятор окончательно выйдет из строя. То есть производители аккумуляторов зарабатывают не на замене, а на продаже батарей для новых устройств. Так что «вечная» батарейка в десятилетнем телефоне не нанесёт ущерба бизнесу.
Команда Гуденафа снова в деле
А что же стало с учеными группы Джона Гуденафа, совершившими открытие литий-кобальтового оксида и тем самым давшими жизнь эффективным литий-ионным аккумуляторам?
В 2017 году 94-летний Гуденаф заявил, что вместе с учеными Техасского университета разработал новый тип твердотельных аккумуляторов, которые могут хранить в 5-10 раз больше энергии, чем прежние литий-ионные батареи. Для этого электроды были сделаны из чистого лития и натрия. Обещана и низкая цена. Но конкретики и прогнозов о начале массового производства нет до сих пор. Учитывая долгий путь между открытием группы Гуденафа и началом серийного производства литий-ионных батарей, реальные образцы можно ждать лет через 8-10.
Коити Мидзусима продолжает исследовательскую работу в Toshiba Research Consulting Corporation. «Оглядываясь назад, я удивляюсь тому, что никто до нас не догадался использовать на аноде такой простой материал как оксид литий-кобальта. К тому моменту было испробовано множество других оксидов, поэтому, вероятно, если бы не мы, то в течение нескольких месяцев кто-нибудь другой совершил бы это открытие», — считает он.
Коити Мидзусима с наградой Королевского химического общества Великобритании, полученной за участие в создании литий-ионных аккумуляторов. Источник: Toshiba
История не терпит сослагательных наклонений, тем более что и сам господин Мидзусима признает, что прорыв в создании литий-ионных аккумуляторов был неизбежен. Но всё же интересно представить, каким был бы мир мобильной электроники без компактных и емких батарей: ноутбуки с толщиной в несколько сантиметров, огромные смартфоны, требующие зарядки два раза в день, и никаких умных часов, фитнес-браслетов, экшн-камер, квадрокоптеров и даже электромобилей. Каждый день ученые всего мира приближают новую энергетическую революцию, которая подарит нам более мощные и более компактные аккумуляторы, а вместе с ними — невероятную электронику, о которой мы пока можем только мечтать.
habr.com
Литий-ионным аккумуляторам исполнилось 25 лет. Почему за четверть века их активные материалы так мало изменились
В этом году исполнилось 25 лет с момента выхода в продажу первых литий-ионных аккумуляторов, которые изготовила корпорация Sony в 1991 году. За четверть века их ёмкость практически удвоилась с 110 Втч/кг до 200 Втч/кг, но, несмотря на такой колоссальный прогресс и на многочисленные исследования электрохимических механизмов, сегодня химические процессы и материалы внутри литий-ионных аккумуляторов практически те же, что и 25 лет назад. В этой статье будет рассказано, как шло становление и развитие данной технологии, а также с какими трудностями сталкиваются сегодня разработчики новых материалов.
Источник
1. Развитие технологии: 1980-2000
Ещё в 70х годах учёными было установлено, что существуют материалы под названием халькогениды (например, MoS2), которые способны вступать в обратимую реакцию с ионами лития, встраивая их в свою слоистую кристаллическую структуру. Тут же был предложен первый прототип литий-ионного аккумулятора, состоящий из халькогенидов на катоде и металлического лития на аноде. Теоретически, во время разрядки, ионы лития, “высвобождаемые” анодом, должны встраиваться в слоистую структуру MoS2, а при зарядке оседать обратно на аноде, возвращаясь в исходное состояние.
Но первые попытки создания таких аккумуляторов были неудачны, так как при зарядке ионы лития никак не хотели обратно превращаться в ровную пластину металлического лития, а оседали на аноде как попало, приводя к росту дендритов (цепочек металлического лития), короткому замыканию, и взрыву аккумуляторов. За этим следовал этап детального изучения реакции интеркаляции (встраивания лития в кристаллы с особой структурой), что позволило заменить металлический литий на углерод: сначала на кокс, а потом и на графит, который используется до сих пор и тоже имеет слоистую структуру, способную встраивать ионы лития.
Литий-ионный аккумулятор с анодом из металлического лития (а) и анодом из слоистого материала (b). Источник: nature.com
Начав использовать углеродные материалы на аноде, учёные поняли, что природа сделала человечеству большой подарок. На графите, при самой первой зарядке, образуется защитный слой из разложившегося электролита, названный SEI (Solid Electrolyte Interface). Точный механизм его формирования и состав еще не до конца изучены, но известно, что без этого уникального пассивирующего слоя электролит продолжал бы разлагаться на аноде, электрод бы разрушался, и аккумулятор приходил бы в негодность. Так появился первый работающий анод на основе углеродных материалов, который был выпущен в продажу в составе литий-ионных аккумуляторов в 90-х годах.
Одновременно с анодом видоизменялся и катод: выяснилось, что слоистой структурой, способной встраивать ионы лития, обладают не только халькогениды, но и некоторые оксиды переходных металлов, например LiMO2 ( M = Ni, Co, Mn), которые не только более стабильны химически, но и позволяют создавать ячейки с более высоким напряжением. И именно LiCoO2 был использован в катоде первого коммерческого прототипа аккумуляторов.
Источник: www.iycr2014.org
2. Новые реакции и мода на наноматериалы: 2000-2010
В 2000х в науке начался бум наноматериалов. Естественно, прогресс в нанотехнологиях не обошёл стороной и литий-ионные аккумуляторы. И именно благодаря им учёные сделали совершенно, казалось бы, непригодный для данной технологии материал, LiFePO4, одним из лидеров по использованию в катодах электромобильных аккумуляторов.
А дело всё в том, что обычные, объёмные частицы железофосфата очень плохо проводят ионы, да и электронная проводимость у них очень низкая. Но засчёт наноструктурирования литию не надо продвигаться на большие расстояния чтобы встроиться в нанокристалл, поэтому интеркаляция проходит гораздо быстрее, а покрытие нанокристаллов тонкой углеродной плёнкой улучшает их проводимость. В результате в продажу вышел не только менее опасный материал, который не выделяет кислород при высокой температуре (как оксиды), но и материал имеющий способность работать на более высоких токах. Именно поэтому такой катодный материал предпочитают производители автомобилей, несмотря на чуть меньшую ёмкость чем у LiCoO2.
В то же время учёные искали новые материалы, взаимодействующие с литием. И, как выяснилось, интеркаляция, или встраивание лития в кристалл- не единственный вариант реакции на электродах в литий-ионных аккумуляторах. Так, например, некоторые элементы, а именно Si, Sn, Sb, и т.д., формируют “сплав” с литием, если использовать их в аноде. Ёмкость такого электрода в 10 раз превышает ёмкость графита, но есть одно “но”: такой электрод во время формирования сплава сильно увеличивается в объёме, что приводит к его быстрому растрескиванию и приходу в негодность. И для того, чтобы уменьшить механическое напряжение электрода при таком увеличении объёма, элемент (например, кремний) предлагают использовать в виде наночастиц, заключённых в углеродную матрицу, которая “амортизирует” изменения объёма.
Источник: chargedevs.com
Но изменения объёма- не единственная проблема материалов, образующих сплавы, и препятствующая их широкому применению. Как было сказано выше, на графите образуется “подарок природы”- SEI. А на материалах, образующих сплав, электролит разлагается непрерывно и повышает сопротивление электрода. Но тем не менее, периодически мы видим в новостях, что в некоторых аккумуляторах используется “кремниевый анод”. Да, кремний в нём действительно используется, но в очень маленьких количествах и смешанный с графитом, чтобы “побочные эффекты” не слишком были заметны. Естественно, когда количество кремния в аноде составляет всего несколько процентов, а остальное- графит, значительного увеличения ёмкости не получится.
И если тема анодов, образующих сплавы, сейчас развивается, то некоторые исследования, начатые в прошлом десятилетии, очень быстро заходили в тупик. Это касается, например, так называемых реакций конверсии. В этой реакции некоторые соединения металлов (оксиды, нитриды, сульфиды и т.д.) взаимодействуют с литием, превращаясь в металл, смешанный с соединениями лития:
MaXb ==> aM + bLinX
M: металл
X: O, N, C, S…
И, как можно себе представить, с материалом во время такой реакции происходят такие изменения, которые даже кремнию не снились. Например, оксид кобальта превращается в наночастицы металлического кобальта, заключённые в матрицу из оксидов лития:
Источник: J. Phys. Chem C 117, 14518 (2013)
Естественно, такая реакция плохо обратима, к тому же между зарядкой и разрядкой большая разница напряжений, что делает такие материалы бесполезными в применении.
Интересно заметить, что когда эта реакция была открыта, в научных журналах стали публиковаться сотни статей на эту тему. Но тут хочестся процитировать профессора Тараскона из Коллеж де Франс, который сказал, что “реакции конверсии были настоящим полем экспериментов для исследования материалов с наноархитектурой, что давало учёным возможность делать красивые картинки с помощью просвечивающего электронного микроскопа и публиковаться в известных журналах, несмотря на абсолютную практическую бесполезность этих материалов”.
В общем, если подвести итог, то, несмотря на то, что в последнее десятилетие были синтезированы сотни новых материалов для электродов, в аккумуляторах до сих под используются практически те же материалы, что и 25 лет назад. Почему же так получилось?
3. Настоящее время: главные трудности в разработке новых аккумуляторов.
Как можно заметить, в вышеописанном экскурсе в историю литий-ионных аккумуляторов ни слова не было сказано об ещё одном, важнейшем элементе: электролите. И на это есть причина: электролит за 25 лет практически не изменился и работающих альтернатив предложено не было. Сегодня, как и в 90-е годы, в виде электролита используются соли лития (в основном LiPF6) в органическом растворе карбонатов (этилен карбонат (EC) + диметил карбонат (DMC)). А ведь именно из-за электролита прогресс в увеличении ёмкости аккумуляторов в последние годы замедлился.
Приведу конкретный пример: на сегодняшний день существуют материалы для электродов, которые могли бы значительно увеличить ёмкости литий-ионных аккумуляторов. К ним относится, например, LiNi0.5Mn1.5О4, который позволил бы сделать аккумулятор с напряжением ячейки в 5 Вольт. Но увы, в таких диапазонах напряжения электролит на основе карбонатов становится нестабильным. Или ещё один пример: как было сказано выше, сегодня, чтобы использовать значительные количества кремния (или других металлов, образующих сплавы с литием) в аноде, надо решить одну из главных проблем: образование пассивирующего слоя (SEI), который бы препятствовал непрерывному разложению электролита и разрушению электрода, а для этого надо разработать принципиально новый состав электролита. Но почему же так сложно найти альтернативу существующему составу, ведь солей лития полно, да и органических растворителей достаточно?!
А трудность заключаетя в том, что электролит должен одновременно обладать следующими характеристиками:
- Он должен быть химически стабилен во время работы аккумулятора, а точнее, он должен быть стойким по отношению к окисляющему катоду и восстанавливающему аноду. Это значит, что попытки увеличить энергоёмкость аккумулятора, то есть, использование ещё более окисляющих катодов и восстанавливающих анодов, не должны приводить к разложению электролита.
- Электролит также должен обладать хорошей ионной проводимостью и низкой вязкостью для транспортировки ионов лития в широком диапазоне температур. Именно для этого в вязкий этилен карбонат добавляют DMC начиная с 1994 года.
- Соли лития должны хорошо растворяться в органическом растворителе.
- Электролит должен формировать эффективный пассивирующий слой. У этилен карбоната это прекрасно получается, в то время как другие растворители, например пропилен карбонат, который был изначально опробован Sony, разрушает структуру анода, так как встраивается в него параллельно с литием.
Естественно, создать электролит, обладающий сразу всеми данными характеристиками очень сложно, но учёные не теряют надежды. Во-первых, ведутся активные поиски новых растворителей, которые бы работали в более широком диапазоне напряжений, чем карбонаты, что позволило бы использовать новые материалы и увеличить энергоёмкость аккумуляторов. В разработке находятся несколько видов органических растворителей: эстеры, сульфоны, сульфоксиды и т.д. Но увы, увеличивая устойчивость электролитов к окислению, уменьшается их устойчивость к восстановлению, и в результате напряжение ячейки никак не меняется. К тому же, не все растворители формируют на аноде защитный пассивирующий слой. Именно поэтому зачастую в электролит подмешивают специальные добавки, например, винилен карбонат, которые искусственно способствуют формированию этого слоя.
Параллельно с улучшением уже существующих технологий, учёные работают и над принципиально новыми решениями. И решения эти можно свести к попытке избавиться от жидкого растворителя на основе карбонатов. К таким технологиям относятся, к примеру, ионные жидкости. Ионные жидкости-это, по сути, расплавленные соли, у которых очень низкая температура плавления, и некоторые из них даже при комнатной температуре остаются жидкими. А всё из-за того, что у этих солей особенная, стерически затрудненная структура, которая усложнят кристаллизацию.
Источник: www.eurare.eu
Казалось бы, отличная идея- полностью исключить растворитель, который легко воспламеняется и вступает в паразитические реакции с литием. Но на деле, исключение растворителя создаёт на данный момент больше проблем, чем решает. Во-первых, в обычных электролитах часть растворителя “приносит себя в жертву” для построения защитного слоя на поверхности электродов. А компоненты ионных жидкостей с этой задачей пока не справляются (анионы, кстати, тоже могут вступать в паразитические реакции с электродами, как и растворители). Во-вторых, очень сложно подобрать ионную жидкость с правильным анионом, так как они влияют не только на температуру плавления соли, но и на электрохимическую стабильность. И увы, самые стабильные анионы формируют соли, которые плавятся при высоких температурах, и, соответственно, наоборот.
Ещё один способ избавиться от растворителя на основе карбонатов- использование твёрдых полимеров (например, полиэфиров), проводящих литий, которые, во-первых, минимизировали бы риск утечки электролита наружу, а также препятствовали бы росту дендритов при использовании металлического лития на аноде. Но главная сложность, стоящая перед создателями полимерных электролитов- их очень низкая ионная проводимость, так как ионам лития сложно передвигаться в такой вязкой среде. Это, конечно, сильно ограничивает мощность аккумуляторов. А понижения вязкости влечёт за собой прорастание дендритов.
Источник: www.polito.it
Также исследователи изучают твёрдые неорганические вещества, проводящие литий с помощью дефектов в кристалле, и пытаются применить их в виде электролитов для литий-ионных аккумуляторов. Такая система на первый взгляд идеальна: химическая и электрохимическая стабильность, устойчивость с повышению температуры и механическая прочность. Но у этих материалов, опять же, очень низкая ионная проводимость, и использовать их целесеобразно только в виде тонких плёнок. К тому же, работают такие материалы лучше всего при высокой температуре. И последнее, с твёрдым электролитом очень сложно создать механический контакт между электолитом и электродами (в этой области жидким электролитам нет равных).
4. Заключение.
С момента выхода в продажу литий-ионных аккумуляторов, попытки увеличить их ёмкость не прекращаются. Но в последние годы увеличение ёмкости замедлилось, несмотря на сотни новых предложенных материалов для электродов. А дело всё в том, что большинство этих новых материалов “лежат на полке” и ждут, пока не появится новый, подходящий им электролит. А разработка новых электролитов- на мой взгляд гораздо более сложная задача, чем разработка новых электродов, так как нужно учитывать не только электрохимические свойства самого электролита, но и все его взаимодействия с электродами. В общем, читая новости типа “разработан новый супер-электрод…” надо проверять, как такой электрод взаимодействует с электролитом, и есть ли для такого электрода подходящий электролит в принципе.
Источники:
Electrochem. Soc. Interface Fall 2016 volume 25, issue 3, 79-83
Chem. Rev., 2014, 114 (23), pp 11503–11618
habr.com
Правда и мифы о литий-ионных и свинцово-кислотных аккумуляторах
- Главная
- Статьи и обзоры
- Правда и мифы о литий-ионных и свинцово-кислотных аккумуляторах

Рано или поздно каждый собственник складской техники сталкивается с тем, что ему нужно купить новый электропогрузчик или заменить на своём погрузчике отслужившую свой срок аккумуляторную батарею. Такая же задача может стоять и в отношении остальной складской техники – электротележек, штабелёров, комплектовщиков и т.д. Одной из важных задач в этом случае будет вопрос, какой тип аккумулятора выбрать? Поставщики тяговых батарей для напольного грузоподъемного транспорта предлагают как классические свинцово-кислотные аккумуляторы, так и необслуживаемые клапанно-регулируемые или гелевые батареи. Альтернативой свинцово-кислотным аккумулятором является более современный литий-ионный (литий-железо-фосфатный) источник питания. Правда многие потребители до сих пор опасаются данной технологии и по старинке используют аккумуляторы старого типа. Такой подход на наш взгляд может быть из-за недостатка информации о плюсах и минусах тяговых аккумуляторов различных типов. Ниже мы попытаемся развеять мифы о литий-ионных аккумуляторах.
Перейти на страницу товара: Li-Ion тяговая батарея→
Миф первый
Литий-ионные аккумуляторы не безопасны и лучше их не использовать в качестве источника питания электрического погрузчика, штабелёра, электротележки. Они могут взрываться, самовозгораться, поэтому лучше с ними не связываться
Трудно было бы с этим спорить, если бы мы были в 80-х годах прошлого века. Действительно первые образцы литий-ионных батарей не отличались высокой безопасностью. При работе такой батареи существовал риск короткого замыкания внутри элементов, нагрева и даже возгорания. Обычно это могло произойти в конце срока службы по причине низкой химической стабильности компонентов батареи.
В первых коммерческих литий-ионных батареях, выпущенных компанией Sony в 1991 году, металлический литий был заменен на более безопасную ионную форму. Однако даже после этого сфера использования данных аккумуляторов ограничивалась мелкой бытовой электроникой. Речи об использовании литий-ионных батарей в качестве источника питания складской техники тогда даже не было.

Ситуация кардинально изменилась в 1997 году, когда было изобретено новое соединение – литий-железо-фосфат (LiFePo4) в качестве катодного материала литий-ионных аккумуляторов. Это соединение является безопасным, и не содержит ядовитых веществ. Правда только в 2005-2006 годах ученым в США удалось окончательно доработать эту «химию», так чтобы стало возможным её коммерческое использование. В результате появились на свет литий-железо-фосфатные аккумуляторы с поистине революционными характеристиками в сравнении с обычными свинцово-кислотными батареями. Именно литий-железо-фосфатные батареи используются для питания электропогрузчиков и складской техники.
Кроме безопасного химического состава каждая литий-ионная тяговая батарея имеет блок управления (BMS), который управляет процессом заряда-разряда, защищает ячейки батареи от перезаряда и глубокого разряда. Даже если по какой-то причине BMS не отключит батарею в экстренной ситуации, то каждая ячейка имеет предохранительный клапан на случай перезаряда или короткого замыкания. Клапан сбросит внутреннее давление в ячейке в нештатной ситуации, чтобы избежать взрыва.
А как же относится к случаям возгорания и/или взрыва литий-ионных батарей смартфонов, планшетов, электронных сигарет и прочих девайсов, которые то и дело появляются в СМИ? К счастью эти аккумуляторы имеют мало общего с тяговыми батареями. В основном все эти случаи связаны с коротким замыканием внутри аккумулятора по причине физической деформации в результате ударов или других повреждений.
Миф второй
Я привык работать со свинцово-кислотными батареями и меня всё в них устраивает. Литий-ионные батареи для вилочных погрузчиков – это что-то из области фантастики и мне это не очень интересно
Разница между литий-ионными и свинцово-кислотными аккумуляторами примерно такая же, как между современной электричкой и паровозом. Свинцово-кислотный аккумулятор был изобретён в 1859 году. Это даже не прошлый, а позапрошлый век. Широко известны главные недостатки этих аккумуляторов, от которых они никогда не избавятся.
Перечислим пять самых критичных:
- Во-первых, это использование в качестве электролита свинцово-кислотных аккумуляторов раствора серной кислоты. Отсюда едкий запах, взрывоопасное выделение газа при зарядке, необходимость доливки воды. Как результат нам нужно оборудовать зарядную комнату и нести затраты на обслуживание таких батарей.
- Во-вторых, риски значительного сокращения срока службы в силу небрежного отношения персонала. Срок службы может серьезно сократиться по причине отсутствия контроля за уровнем и плотностью электролита, хранения разряженной батареи, разрядов ниже допустимой глубины, нарушений температурного режима использования, не соблюдения полных циклов заряда-разряда. Другими словами свинцово-кислотный аккумулятор это довольно капризная вещь, требующая регулярного присмотра.
- В-третьих, длительное время зарядки. Чтобы полностью нормально зарядить классическую кислотную батарею с жидким электролитом необходимо как минимум 7,5-8 часов. Возможны более быстрые режимы зарядки, но это нельзя делать ежедневно. Для быстрой зарядки необходимы высокие токи, что сильно сокращает срок службы свинцово-кислотных батарей в силу особенности данной технологии.
- В-четвертых, для организации многосменной работы требуется не просто оборудовать зарядную комнату, но и иметь комплект из 2-х батарей на каждую единицу техники. Обычно тяговые кислотные батареи весят от нескольких сотен килограмм до 1 тонны и более. Поэтому необходимо ещё и оборудование для транспортировки и безопасной замены. Как правило это специальные рольганги, столы или кран-балки.
- В-пятых, низкий КПД. Свинцово-кислотные батареи только 80% потраченной на их зарядку энергии затем отдают на питание складской техники. Остальное улетучивается в виде тепла.
Давайте посмотрим сколь это в деньгах, к примеру, для ричтрака с кислотной батареей 48 В 750 Ач. Такая батарея за один цикл с учётом глубины разряда 80% отдает 48*750*80%/1000 = 28,8 кВт. За средний срок службы 5 лет при условии 1 цикла в день и 250 рабочих дней получится 28,8*250*5= 36 000 кВт. Но реально мы потратим на электричество на 20% больше, что составит при цене 0,15 евро/1 кВтч – 36 000*20%*0,15=1080 евро. Больше 1000 евро просто улетучится с каждой батареи. Это еще не при самом интенсивном режиме работы.
Всех этих недостатков лишены литий-железо-фосфатные батареи для питания напольного электрического транспорта. Они ничего не выделяют во время зарядки и разрядки, не требуют какого-либо обслуживания, сами автоматически выключаются, чтобы не допускать глубокого разряда и могут без ущерба сроку службы подвергаться любому количеству промежуточных зарядов. Время полной зарядки составляет как правило 1,5-2 часа. Можно использовать одну батарею для многосменной работы, если есть хотя бы небольшие перерывы для промежуточных зарядов. КПД литий-железо-фосфатных аккумуляторов составляет 96%, срок службы в среднем 3000-5000 циклов в зависимости от производителя.


Миф третий
Свинцово-кислотные батареи постоянно совершенствуются. Есть гелевые необслуживаемые батареи, для которых не требуется зарядная комната. Есть батареи типа HFC (Hawker NexSys), которые не выделяют газов при зарядке и могут подвергаться промежуточным зарядам
Действительно, такие батареи есть, но всё это похоже на попытки ехать на загнанной лошади. Сама свинцово-кислотная технология уже себя исчерпала. Никакие ухищрения производителей не позволят побороть основные её недостатки.
Клапанно-регулируемые батареи действительно почти не выделяют газов. Однако они являются условно не обслуживаемыми. Электролит в них представляет собой тот же раствор серной кислоты в связанном состоянии. Соответственно на эти батареи распространяются все те же недостатки свинцово-кислотных батарей, перечисленные выше, в том числе и необходимость отвода газов при зарядке. В руководстве по эксплуатации клапанно-регулируемых батарей указывается, что батареи в процессе зарядки выделяют крайне мало газов. Однако при их эксплуатации необходимо соблюдать те же требования безопасности, как и для батарей с жидким электролитом (Стандарт EN 50272-3/ IEC 62485_3 «Тяговые батареи для промышленных погрузчиков»). Другими словами, необходимо предусмотреть отвод газов.
Что касается стандартных гелевых батарей, то это самый неэффективный источник питания для электропогрузчиков и складской техники. Срок службы таких батарей составляет всего 1200 циклов при глубине разряда не более 60%. Для нормального режима заряда таких аккумуляторов можно использовать относительно небольшие токи заряда, обычно 0,25-0,3 С. Поэтому время полного заряда составляет обычно 10-12 часов, а у некоторых батарей 12-14 часов. По этой причине их невозможно использовать для многосменной работы. Не слишком любят такие батареи и эксплуатацию при низких температурах окружающей среды. Работа в условиях отрицательных температур значительно снижает полезную ёмкость гелевой батареи.
Миф четвёртый
Литий-ионные батареи для вилочных погрузчиков – это что-то диковинное. Их пока мало кто покупает
На самом деле рынок литий-ионных аккумуляторов для грузоподъемной складской техники бурно развивается как минимум последние пять-семь лет. Ведущие производители техники активно добавляют в свою производственную линейку модели техники с литий-ионными источниками питания.
Наша компания, как официальный дилер немецкого производителя STILL, не безуспешно предлагает купить погрузчики, штабелёры, электрические тележки с литий-ионным аккумулятором нашим постоянным клиентам в Минске и по всей территории Республики Беларусь. Благодаря нашей помощи в экономическом обосновании покупки литий-ионных батарей в последние годы практически каждая вторая единица техники поставляется нашим клиентам с современным источником питания.
Очень интересной тенденцией является еще и то, что в последние годы в литий-ионную технологию поверили даже производители традиционных свинцово-кислотных батарей. Если пять-семь лет назад они и слышать о литий-ионных батареях не хотели, то теперь сами их производят на ряду с традиционными свинцово-кислотными. Тенденция на наш взгляд такова, что в скором будущем литий-ионные батареи полностью вытеснят обычные свинцово-кислотные.
Миф пятый
Литий-ионные батареи слишком дорогие. Они в разы дороже свинцово-кислотных и нет смысла тратить на них деньги. Подождем пока они подешевеют
Конечно, подождать всегда можно. Действительно есть вероятность, что бурное развитие литий-ионной технологии приведёт к появлению новых игроков на рынке и цены могут пойти вниз. Но даже при нынешнем уровне цен стоит обратить внимание на данный тип аккумуляторов. Если смотреть не просто на покупную стоимость, а ещё учесть срок службы, то окажется, что во многих случаях «дешёвые» свинцово-кислотные батареи обходятся потребителю дороже, чем современные литий-ионные.
Возьмём к примеру ситуацию, когда предприятие имеет парк складской техники, но не имеет специальной комнаты для зарядки обычных свинцово-кислотных батарей. В таком случае приходится либо инвестировать в строительство зарядной, либо использовать гелевые батареи, которые почти не имеют газовыделения в процессе зарядки. Многие идут по второму варианту.
Теперь давайте сравним две простые цифры. Срок службы гелевой батареи любого премиального бренда при соблюдении всех условий эксплуатации составляет не более 1200 циклов заряда-разряда. При этом максимальная глубина разряда допускается не более 60%. Другими словами, если ваша батарея имеет номинальную емкость 100 Ач, то реально вы используете только 60Ач и можете «снять» с неё за весь срок службы 100 Ач х 60% х 1200 = 72 000 Ач. Срок службы такой же литий-железо-фосфатной батареи, собранной, к примеру, на ячейках Winston составляет 5000 циклов при допустимой глубине разряда 80%. Её ресурс составит 100 Aч х 80% х 5000 = 400 000 Ач.
Теперь попробуйте сопоставить стоимость той и другой батареи с учётом ресурса. Литий-ионная батарея заряжается за 2 часа, а не за 11-12 часов, как гелевая. Если сюда добавить более высокий КПД (96% у Li-Ion против 80% у гелевой), то выбор становится очевидным.

Подведем итог:
Литий-железо-фосфатные аккумуляторы для электрических вилочных погрузчиков и другой складской грузоподъёмной техники уверенно отвоёвывают позиции у традиционных свинцово-кислотных батарей. Свинцово-кислотные батареи никогда не избавятся от своих основных недостатков в силу особенностей данной устаревшей технологии. Единственное их преимущество – это низкая покупная стоимость.
При выборе типа аккумуляторов для складской техники мало учитывать только их покупную стоимость. Стоит сопоставить срок службы, допустимую глубину разряда, время полной зарядки, необходимость обслуживания и пр.
Перейти на страницу товара: Li-Ion тяговая батарея→
www.tehnoviza.by
маркетинговые уловки и распространенные ошибки / Habr
Неоднократно сталкиваюсь в статьях и комментариях (в статьях все же гораздо реже) с использованием неправильных данных или названий, которые впоследствии приводятся, как аргументы, хотя на самом деле они ошибочны изначально. И эти ошибки распространяются по всем ресурсам, включая Гиктаймс.Этой статьей я бы хотел разъяснить некоторые моменты и провести своеобразный ликбез.
Литий-полимерные аккумуляторы
Сразу с главного — в свободном доступе на рынке не существует литий-полимерных аккумуляторов в техническом смысле этого слова. В англоязычном мире с этим уже разобрались, а вот на постсоветском пространстве существуют некоторые издержки в терминологии, которыми пользуются маркетологи. Маленькое отступление — не то, чтобы этим не пользовались в других регионах, но там хотя бы есть возможность проверки этой информации на родном языке.
Немного истории
Любой литий-ионный аккумулятор имеет 4 основных составляющих — два электрода (анод и катод), электролит и сепаратор. Все 4 элемента развивались и развиваются дальше. Для электролита на начало исследований (1970-ые) было предложено два варианта — жидкий или твердый электролит. В то время твердый электролит обещал больше перспектив в эксплуатации — электролит не вытекает при повреждении корпуса, сам элемент более прочный. Главным недостатком было и остается высокое сопротивление твердого электролита, оно сводит на нет физические характеристики.
Фактически снижение количества ресурсов, выделяемых компаниями на разработку твердых электролитов, произошло в начале 1990-х, когда Sony вывела на рынок аккумулятор с жидким электролитом. Сама компания Sony еще в 1988 году была уверена в будущем успехе твердого электролита.
Не смотря на ориентацию на жидкий электролит компании не перестали искать альтернативы. Одним из вариантов стали так называемые гибридные электролиты. Фактически для них используется сепаратор с мелкими отверстиями и тем же жидки электролитом. Хотя он на ощупь кажется сухим, на самом деле количество электролита в нем не отличается от подобного в обычном аккумуляторе. Как в принципе и конструкция:
Схематическая модель литий-ионного аккумулятора с катодом LiCoO2 и графитовым анодом из Википедии на немецком языке.
Подобные аккумуляторы довольно распространены, их коммерческое распространение началось еще в начале 2000-х, но физически и химически это те же самые литий-ионные аккумуляторы с жидким электролитом и их в общем не очень много.
Что же представлено на рынке?
Одним из способов классификации аккумуляторов является его корпус. На сегодня существуют три популярных способа упаковки:
- Цилиндрические ячейки
- Призматические ячейки
- «Мешочек» или pouch-bag ячейки
Первый тип аккумуляторов известен своим использованием в ноутбуках и автомобилях Тесла (там используется его самый распространенный размер 18650).
Второй тип является измененной формой цилиндрических. Алюминиевый корпус, прямоугольник или квадрат в поперечном сечении. Популярен для стационарного применения и в транспорте.
Третий тип имеет мягкий корпус и не всегда оснащается встроенной системой защиты. Фактически удешевленный вариант призматической ячейки. Этот тип аккумуляторов используется, в частности, в мобильных телефонах.
Последние в списке и есть те самые «полимерные». Они так называются по нескольким причинам. Самый наглый способ маркетологов — корпус из полимеров, потому и «полимерные».
Второй вариант — использование полимерного мелкопористого сепаратора. Фактически ничем не отличается от обычного литий-ионного аккумулятора.
Третий вариант, который я не встречал — давать название «полимерный» на основании использования полимерных элементов в качестве основ катодов, анодов и прочих элементов. Как правило попадает в множество аккумуляторов в пластиковом корпусе.
Проблемы терминологии
При разработке концепции идея была такова, что под понятием «жидкий электролит» понимались жидкий или гелеобразный раствор соли лития, в то время как под понятием «твердый электролит» (solid electrolyte) — твердое состояние вещества. Так как возникло желание продать то, что обещалось но чего нет, то сегодня даже в среде исследователей гелевый электролит вносят в перечень «твердых» электролитов, хотя его характеристики все же скорее гибридные. Потому можно встретить описание в научных работах «твердый гелевый электролит», которое некоторыми учеными считается вводящим в заблуждение.
Будущее полимерных электролитов
Разработки ведутся и в перспективе возможно появление аккумуляторов с настоящим полимерным электролитом. Однако по состоянию на 2015 год лабораторные образцы полимерных электролитов на основе органической химии не показывали ощутимого прогресса, потому на дату публикации статьи в обозримом будущем не предвидится массового ухода от жидкого электролита.
Проблемы с наименованием типов аккумуляторов
На рынке представлено несколько различных типов литий-ионных аккумуляторов. Они имеют различные наименования, которые позволяют описывать их характеристики в плане емкости или безопасности. В целом можно встретить следующие типы:
- Литий-кобальтовые с катодом LiCoO2 — самые емкие модели имеют графитовый анод.
- Литий-марганцево-оксидные с катодом LiMn2O4, Li2MnO3 или LMnO, последние могут выступать как просто литий-марганцовые
- Литий-никель-марганец-кобальт-оксидные или NMC с катодом LiNiMnCoO2
- Литий-железо-фосфатные с катодом LiFePO4 (LFP)
- Литий-никель-кобальт-алюминий-оксидные (NCA) с катодом LiNiCoAlO2
- Литий-титанат-оксидные (LTO) с анодом Li4Ti5O12
Сразу можно заметить неравномерность наименований. Некоторые названы в честь катода, некоторые — в честь анода. И если в первом случае еще можно попытаться угадать с высокой степенью вероятности, что анод будет графитовый, то в случае названия по аноду остается только гадать. Также на сегодня ведутся разработки и в принципе можно найти на рынке аккумулятор с катодом LiFePO4 и анодом Li4Ti5O12, т.е. литий-железо-фосфатные литий-титанатовые, которые в этой системе не имеют простого маркетингового наименования По ссылке — научная статья 2013 года с испытаниями такого аккумулятора.
Причина существования такого большого числа катодов и анодов аккумуляторов в различных требованиях к аккумуляторам. Где-то нужна бóльшая безопасность, а где-то емкость или мощность. Получить представление о запасаемой энергии можно исходя из того, что каждый тип катода и анода имеет разный потенциал, как видно из изображений ниже (в качестве потенциала в 0 В выбирается потенциал металлического лития, больше разница напряжений — больше мощность, энергетическая плотность зависит от количества атомов лития):
Общая схема с потенциалами от университета г. Киль. Источник
Материал из статьи 2013 года авторов Jiantie Xu, Shixue Dou и др. Источник
Еще одна картинка от Purdue School of Engineering and Technology. Источник
Общее представление о причинах может давать следующее грубое изображение связи потенциалов элементов и возможности металлизация лития при очень низком разряде или термической нестабильности при перезаряде:
Изображения взято из курса лекций
Самые небезопасные в эксплуатации из представленных на рынке — литий-кобальтовые с графитовый анодом, самые безопасные — с катодом LiFePO4 и анодом Li4Ti5O12. Естественно, наличие BMS (Battery Management System) уменьшает риски, но пренебрегать ими не стоит, тот же слишком сильный разряд эта система предотвратить не сможет, что критично для аккумуляторов с графитовым анодом.
Распространенные ошибки
Общие ошибки
Самая главная и часто встречаемая ошибка — противопоставление «обычному литий-ионному аккумулятору». Как видно выше, такого понятия, как «обычный» просто нет. И разница в напряжениях может быть самой разной для вроде бы одинаковых катодов и одинаковой для разных наборов катодов и анодов.
Вторая ошибка, не столь существенная, связанная с предыдущим пунктом, написание материала катода LiFePO4 следующим образом — LiFePo4. Здесь путаница довольно распространенная и сразу показывает, насколько можно доверять такому источнику.
Еще одна крупная ошибка — противопоставление LiPo-аккумулятора литий-ионному. Здесь несколько вариантов сравнения. Первое — это общее, связанное с заблуждением о существовании на рынке аккумуляторов с полимерным электролитом. Второе, имеющее более узкое применение, которое обычно озвучивается в следующем виде «литий-полимерный аккумулятор [речь о корпусе] лучше/хуже LFP/LTO/NCA (подставить нужное)».
Здесь идет смешение типа корпуса и начинки.
Например, по этой ссылке можно прочитать о LFP аккумуляторе в формате литий-полимерного (призматический корпус в данном случае).
Аккумулятор А долговечнее аккумулятора Б
Это еще одно своеобразное перекручивание фактов для аргументации при продаже. Такой метод применяется для разных типов аккумуляторов, но чаще всего сравнивается LFP вариант аккумулятора и литий-кобальтовый или NMC с графитовым катодом. В статьях в интернете, как рекламных так и просто популярных, можно найти соотношение полных эквивалентных циклов в 2000 к 500 в пользу LFP и как результат — рассказ о значительном превосходстве первого.
Здесь есть несколько неточностей. Во-первых, бóльшее число статей по литий-кобальтовым датировано 2005-2006 годами, в то время как для LFP — с 2012-2013. Данные по циклам основаны на этих статьях. Тем не менее разработки на останавливались и были одинаково активными для всех типов аккумуляторов и разрыв не настолько большой в один и тот же временной интервал. Во-вторых, не уточняется объем энергии, который передаст за свою жизнь аккумулятор, а ведь при равных размерах LFP имеет меньшую емкость.
Что же касается главного преимущества — бóльшего числа циклов, то если брать новые исследования и сравнивать в равных условиях серийные образцы, то разница не такая и драматическая. В общей сложности она составляет 20-30% (800 циклов против 1000 для 40°C, например), что не всегда оправдывает покупку того же LFP, так как будет передано меньше энергии за счет меньшей разницы напряжений за весь срок эксплуатации.
Источников с непосредственным сравнением нет, поскольку сам процесс тестирования длительный и дорогостоящий, осложненный договорами про не раскрывание названий участников, но сравнивая по ряду данных можно сделать вывод об аналогичных характеристиках на сегодня для всех литий-ионных аккумуляторов в плане срока эксплуатации во всех возможных сценариях, в т.ч. и простого хранения. Эти данные приведены, например, в источниках 1, 2, 3, 4, 5, 6, 7.
Прочие источники
BU-206: Lithium-polymer: Substance or Hype?
Kazuo Murata, Shuichi Izuchi, Youetsu Yoshihisa «An overview of the research and development of solid polymer electrolyte batteries»
A. Manuel Stephan, K.S. Nahm «Review on composite polymer electrolytes for lithium batteries. Polymer»
D. Golodnitskya, E. Straussc, E. Peleda and S. Greenbaum «Review — On Order and Disorder in Polymer Electrolytes»
Моя предыдущая статья про литий-ионные аккумуляторы — Эксплуатация литий-ионных аккумуляторов
habr.com
