85 фото лучших проектов и монтаж своими руками
Главным элементом дачного хозяйства, несомненно, выступает сама дача. Естественное желание каждого дачника попытаться сделать ее более удобной, комфортабельной, красивой. Те, кто приобрел дачный участок с готовыми строениями, как правило, начинает переделывать все по своему вкусу, менять и что-то достраивать, проводить перепланировку, доводить «до ума» уже возведенные постройки.
В случае, когда строите «с нуля», перестраивать и переделывать, конечно, не нужно, однако необходимо спроектировать и выполнить все работы исходя из своего понимания комфорта и удобства, в контексте ваших представлений красоты. В том и другом случае, важным элементом главного строения всего дачного хозяйства – дачного домика является крыша.
Насколько она правильно сделана, зависит тепло, уют и комфорт жилища, его долговечность. Одним из ключевых и важных конструктивных элементов в конструкции крыши, является водосточная система.
В целом для того, чтобы правильно спроектировать водоотвод и смонтировать его, недостаточно посмотреть фото водосточной системы на страницах сайтов, нужно знать все особенности, принципы работы, а также множество неявных моментов практической сборки. Именно обо всем этом и пойдет речь в этой статье.
Краткое содержимое статьи:
Назначение и основные типы водоотводов
Казалось бы, назначение водостока очевидно, однако не все так просто, как может показаться на первый взгляд неискушенному в строительстве домашнему мастеру. Классическое определение водосточной системы выглядит следующим образом:
Водоотвод – это комплекс отдельных элементов и технических приспособлений, смонтированных на кровле и фасаде здания в строго определенной последовательности, с целью надежной защиты всех элементов строительной конструкции от проникновения влаги, а также для отвода дождевой воды.
Как можно видеть из определения, в данном конкретном случае мы имеем дело с некой технической конструкцией, в которой однозначно определенны функции каждого ее элемента. Таким образом, водоотвод предназначен для того, что бы собирать с кровли атмосферные осадки, а также влагу от таящего снега и льда в весенний период, и выводить за пределы строительной конструкции, а именно – к определенному месту сбора.
Кроме всего прочего, монтаж водосточной системы осуществляется в строгом соблюдении определенных правил, направленных на обеспечение ее эффективной работы в течении длительного периода времени.
Важно будет заметить, вся конструкция водостока не должна портить внешний вид строения, т.е., кроме технических, к ней выдвигаются некие эстетические требования, в число которых входит соответствие общей концепции дизайна здания.
Вы конечно можете приобрести готовый водоотвод. Его главное преимущество в стандартизации всех элементов, т. е., домашний мастер легко можете соединить отдельные детали в готовую конструкцию, а в случае необходимости – перестраивать и переделывать без изменения самих деталей.
е., домашний мастер легко можете соединить отдельные детали в готовую конструкцию, а в случае необходимости – перестраивать и переделывать без изменения самих деталей.
Однако иногда промышленная конструкция не подходит, и дело даже не в высокой стоимости. Просто иногда будет правильней собрать ее самостоятельно, поскольку подобрать промышленную просто нет возможности, а также при желании сделать все своими руками.
Кроме того, самостоятельно выполненная конструкция собрать ее под конкретную крышу, при этом в полной мере учесть все требования, как технические, так и эстетические.
Все водостоки различают по типу используемого в конструкции материала.
Первый вид, набирающий популярность в настоящее время – пластиковый. В данном случае мы имеем дело с двумя разновидностями: конструкцию, собираемую посредством соединения отдельных элементов с помощью клея, а также — при помощи специальных резиновых уплотнителей.
В целом, пластиковые водоотводы имеют ряд неоспоримых преимуществ:
- малый вес готовой конструкции;
- устойчивость к коррозии и ультрафиолетовому солнечному излучению;
- широкий спектр цветовых оттенков;
- относительная простота сборки;
- долговечность.
К недостаткам можно отнести:
- Малая прочность к механическим воздействиям. Данный недостаток предопределяет спектр использования: их можно устанавливать только на одноэтажные строения;
- Невозможность или излишняя себестоимость и трудность проведения ремонтных работ;
- Горючесть материала;
- В случае использования резиновых уплотнителей, их необходимо периодически менять.
Следующий вид — металлические конструкции. В данном случае, название предопределяет материал.
Достоинства будут определяться спецификой материала:
- Высокая прочность конструкции – она выдерживает длительные механические нагрузки и однократные воздействия;
- Пожаробезопасность;
- Широкий диапазон рабочих температур.

Однако, кроме «плюсов», металлическим водоотводам присущи специфические недостатки:
- Высокий вес готовой конструкции;
- Сложность сборки и изготовления отдельных элементов;
- Коррозия и необходимость периодического обслуживания;
- Невозможность соединения множества отдельных элементов не позволяют использовать металлический водоотвод на крышах со сложными выступами;
- Высокая себестоимость.
Выбирая тип, отталкивайтесь от особенностей вашего здания, от того, какой вариант будет более предпочтителен в каждом конкретном случае. При проектировании помните, вопрос цены не должен превалировать, первостепенное значение имеет функциональность и надежность.
Проектирование
Составление проекта будущего водостока, является необходимым гарантом того, что водосток будет эффективно справляться со своими задачами, а также позволяет рационально использовать материалы и соответственно, в какой-то степени сэкономит ваш семейный бюджет.
Для правильного расчета необходимо учитывать среднестатистическое количество осадков в вашей местности, а также площадь кровли. Начинать расчеты, нужно от промеров периметра здания.
В целом, при определении длины водосточных желобов полученную длину увеличивайте на 5%, этот запас делает с учетом необходимого наклона водостоков. Учитывайте возможные обходы каких-либо элементов кровли или выступов.
На каждые десять метров кровли необходимо устанавливать одну воронку для забора воды. Если крыша имеет сложный периметр, количество воронок может быть больше.
Количество водосточных труб должно быть равно количеству воронок. Длина трубы делают равной высоте здания – от края кровли и до поверхности земли.
Особенности сборки
Для того, что бы водосточная система кровли получилась эффективной, необходимо соблюдать ряд требований при сборке.
Помните. Монтаж начинают еще до того, как вы начали покрывать крышу кровлей, поскольку сами держатели водосточных желобов необходимо крепить к нижней части обрешетки.
Естественно, что для монтажных работ вам потребуется некоторый минимум инструмента, а именно:
- Набор отверток;
- Шуруповерт;
- Ножовка по металлу;
- Болгарка;
- Линейка, складной метр или рулетка;
- Ножницы по металлу;
- Дрель и набор сверл по металлу;
- Молоток, киянка.
Кроме всего прочего, перед началом монтажных работ подумайте о лестнице, стремянке или строительных лесах — без этого вы вряд ли сможете что-нибудь сделать.
Исходя из типа применяемого материала, существует некоторая особенность соединения отдельных элементов: для металлических конструкций используют специальные замки и уплотнительные прокладки, а для пластиковых – клей или специальную сварочную машину.
Для монтажа водоотвода предопределен некоторый набор обязательных правил, а именно:
- Начинать все монтажные работы нужно с верхней точки – т.е. с крыши, и постепенно смещаться вниз;
- Соединяя отдельные желоба, обязательно соблюдайте некоторый угол наклона по всей длине.

Правила сборки водоотвода
Специалисты советуют определенный порядок сборки системы своими руками, именно следуя ему, вы сможете все сделать без лишних проблем и неожиданных «сюрпризов», получив быстрый и ожидаемый результат. Выглядит эта последовательность монтажных работ следующим образом:
- Устанавливаются все необходимые держатели;
- Закрепляют воронки водосливов;
- Устанавливают водосточные желоба и необходимые заглушки;
- Крепят угловые колена;
- Монтируют стоковые колена;
- Устанавливаются системы водосточных труб;
- Монтируют все необходимые хомуты;
- Устанавливают и крепят конечные сливные элементы.
Проверить качество выполненной работы вы естественно сможете только во время дождя, но если все сделано правильно, водоотвод будет безотказно служить долгие годы и ваш дом будет сухим, теплым и уютным.
Фото водосточной системы
Пост опубликован: 01.11
Присоединяйтесь к обсуждению: Copyright © 2021 LandshaftDizajn.Ru – портал о ландшафтном дизайне №1 ***Система фото-и видеофиксации нарушений ПДД
Cистема фото-и видеофиксации нарушений правил дорожного движения входит в состав Автоматизированной системы управления дорожным движением (АСУДД), разработанной компанией «ВойсЛинк» и позволяет решать следующие задачи:- Организовывать контроль выполнения водителями транспортных средств положений ПДД.

- Получать, хранить и обрабатывать данные от комплексов фото-и видеофиксации, установленных на автомобильной дороге или улично-дорожной сети.
- Передавать данные в ЦАФАП.
- Хранить, в течение сроков, определяемых действующим законодательством, и извлекать видеоданные, входящие в состав доказательных материалов по нарушениям ПДД.
- Обрабатывать данные, обеспечивающие подготовку в автоматизированном режиме постановлений об административном правонарушении.
- Нарушение скоростного режима.
- Движение по выделенной полосе.
- Пересечение стоп-линии на запрещающий сигнал светофора.
- Проезд на красный свет.
- Движение по полосе встречного направления.
- Пересечение или движение по сплошной линии.
- Пересечение или движение по двойной сплошной линии.

- Движение на запрещающие знаки дорожного движения.
- Стоянка и (или)остановка в неположенном месте.
- Фиксация невключения (неисправности) ходовых огней в заданное время суток.
- Запрет движения транспортного средства по заданному участку или в заданном направлении.
Кроме того, комплекс фото-и видеофиксации может использоваться для наблюдения за оперативной дорожной обстановкой, в том числе, и с применением средств автоматизированного видеонаблюдения и видеоаналитики.
Вместе с тем, Cистема фото-и видеофиксации АСУДД, разработки ООО «ВойсЛинк», имеет возможность интегрироваться с любыми комплексами фото-и видеофиксации в случаях, если такие комплексы поддерживают стандартизированные протоколы обмена информацией. Cистема фото-и видеофиксации может быть интегрирована с ЦАФАП в соответствии с ведомственными инструкциями и техническими условиями.
виды, фото работ, цены на установку в стоматологии
Связавшись с администратором стоматологической клиники «Улыбка», вы можете узнать стоимость брекетов в Омске, а также все подробности относительно разновидностей таких систем, обеспечивающих эффективное устранение дефектов зубного ряда и исправление прикуса. Но для начала лучше все же обратиться к опытному стоматологу, который определит уровень серьезности проблемы и наиболее подходящий способ ее решения в соответствии с результатами обследования. Только после тщательного обследования можно будет понять, какая именно брекет-система поможет пациенту добиться наилучших результатов.
Но для начала лучше все же обратиться к опытному стоматологу, который определит уровень серьезности проблемы и наиболее подходящий способ ее решения в соответствии с результатами обследования. Только после тщательного обследования можно будет понять, какая именно брекет-система поможет пациенту добиться наилучших результатов.
Виды брекетов и особенности их выбора
Сегодня для корректировки прикуса применяется несколько видов ортодонтических систем, отличающихся используемыми в изготовлении материалами:
- металлические брекеты, которые пользуются высоким спросом из-за своей надежности и доступной цены. Они могут иметь разные размеры и конфигурацию, благодаря чему несложно подобрать варианты на любой вкус и даже цвет;
Комментарий доктора:
Металлическая брекет—система одна из самых надежных и прочных. В ней есть свои плюсы и минусы. Главный плюс — это прочность и возможность повторной фиксации брекетов при отрыве.Минус — видимость для окружающих. Но современные тенденции моды говорят обратное: чем заметней и ярче, тем молодежнее и модней. Идеальный выбор для детей и подростков.
- керамические брекеты, которым отдают предпочтение взрослые люди. Основная причина заключается в том, что такие системы практически незаметны. Кроме того, они не изменяют свой цвет после приема пищи;
Комментарий доктора:
Прекрасный вариант эстетических вестибулярных брекетов. Благодаря встроенному металлическому пазу, у керамических брекетов коэффициент трения в несколько раз ниже, чем у сапфировых брекетов. Привычные нам керамические брекеты матового цвета,но сейчас стали появляться, благодаря новой обработке, прозрачные керамические брекеты. Минус этих брекетов также связан с затруднениями при повторной фиксации, а также, в сравнении с металлическими брекетами, они более хрупкие.
- сапфировые брекеты, главным достоинством которых является повышенная прочность.
 Выполняются они из монокристаллического сапфира;
Выполняются они из монокристаллического сапфира;
Комментарий доктора:
Да, безусловно, это одни из самых незаметных брекетов. Они идеально подходят для взрослого контингента людей. Но так же есть и свои отрицательные стороны: процесс исправления прикуса через сапфировые брекеты несколько медленнее, чем с использованием металлических брекетов. Связано это с тем, что сапфировые брекеты обладают большим трением, которое создается между пазом брекета и дугой, в результате чего зуб перемещается медленнее. Так же они достаточно хрупкие, часто возникают проблемы с повторной фиксацией при отрыве брекета.
Кроме того, все брекет-системы можно разделить на два основных типа по способу крепления:
- лигатурные брекеты, в которых используется специальный элемент (именно он называется лигатурой), прочно удерживающий дугу в пазе. К данной категории можно отнести вестибулярные и лингвальные, невидимые брекеты, закрепляющиеся на внутренней стороне зубов;
- безлигатурные или самолигирующие брекеты, в которых используются скользящие фиксаторы.
 Они дают возможность быстро осуществлять замену дуги, а также значительно сокращают сроки выравнивания зубов и коррекции прикуса.
Они дают возможность быстро осуществлять замену дуги, а также значительно сокращают сроки выравнивания зубов и коррекции прикуса.
Выбор одной из систем зависит исключительно от рекомендаций врача, формируемых по результатам обследования.
Выравнивание зубов брекетами
Система фото- и видеофиксации АТС
Министерством экономического развития России подготовлен проект поправок в закон о техосмотре, которые вступят в силу в 2018 году.Обязательной частью техосмотра планируется сделать фото- и видеофиксацию процесса осмотра автомобиля. На снимке должен быть зафиксирован номер автомобиля, а также дата и место прохождения техосмотра. Видеосъемка должна гарантировать, что машина прошла проверку по всем правилам.
Проект закона предполагает установить требования к операционно-технической базе операторов техосмотра, «включая требования к системам фото- и видеофиксации процедуры технического осмотра транспортного средства».
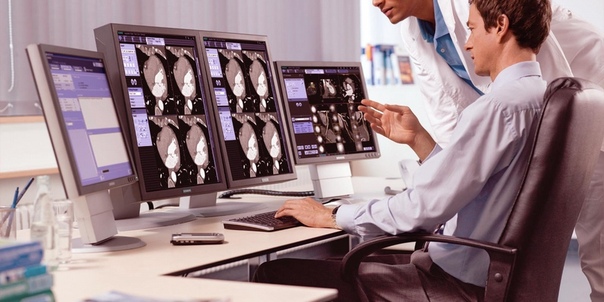
Группа Компаний ГАРО предлагает пунктам техосмотра полностью соответствующий планируемым законодательным изменениям прибор собственного производства – систему фото- и видеофиксации осмотра автомобиля.
Система видеофиксации АТС – это система автоматической фото- и видео фиксации автотранспортных средств (АТС) находящихся на тормозном стенде. Система предназначена для использования на пунктах технического осмотра с целью фотовидеофиксации АТС, проходящих техосмотр. Программное обеспечение ЛТК ГАРО позволяет регистрировать внешний облик и государственный регистрационный знак АТС при проверке тормозных сил на первой оси с указанием даты, времени и регистрационного знака, а также автоматически оформлять диагностические карты по идентифицированному регистрационному номеру и данным базы регистрации ЕАИСТО.
Функции системы видеофиксации АТС:
– Обзор и наблюдение событий на станции ТО в режиме реального времени на рабочем месте контролера.
– Автоматическая фотофиксация АТС в виде электронных фотооригиналов с указанием даты и времени и занесением фотоматериала в базу данных.
– Автоматическое занесение фотографии АТС, находящегося на инструментальном контроле тормозных сил в диагностическую карту.
Состав системы видеофиксации АТС:
– Видеокамера – 1 шт.
– Блок питания камеры с кабелем 15 м – 1 шт.
– Блок преобразования сигнала с программным обеспечением – 1 шт.
– Обновление программного обеспечения ЛТК для работы с системой видеорегистрации на электронном носителе – 1 шт.
Принцип действия системы видеофиксации АТС:
Видеокамера общего вида ведет непрерывное наблюдение за зоной инструментального контроля тормозных сил АТС. Изображение в реальном времени непрерывно выводится на монитор контролера.
Фотография фиксируется в базе данных с привязкой к соответствующему осмотру АТС с указанием даты и времени регистрации и автоматически заносится в диагностическую карту.
При применении IP камер имеется возможность делать запись всего происходящего в зоне инструментального контроля тормозных сил АТС на сервер потребителя.
За более подробной информацией и по вопросам приобретения системы видеофиксации обращайтесь по телефону 8-800-350-53-53 и по электронной почте [email protected]
отличия, фото, достоинства и недостатки
Безлигатурные и лигатурные брекет-системы – ортодонтические конструкции, исправляющие неправильный прикус и неровный зубной ряд. Системы обладают разной силой действия, поэтому решение о выборе индивидуального метода лечения лучше предоставить стоматологу.
Содержание
- Лигатурные брекеты
- Преимущества и недостатки лигатурных систем
- Безлигатурные брекеты
- Плюсы и минусы безлигатурных систем
- В чем отличия лигатурных и безлигатурных брекетов?
Лигатурные брекеты
Дуга в лигатурной брекет-системе удерживается в пазах при помощи металлических элементов из медицинского сплава или силиконовых резинок. Они контролируют степень натяжения дуги и влияют на скорость выравнивания зубов. Лигатуры со временем растягиваются, теряют силу воздействия или рвутся, поэтому пациенту необходимо регулярно посещать ортодонта для замены металлических элементов.
Они контролируют степень натяжения дуги и влияют на скорость выравнивания зубов. Лигатуры со временем растягиваются, теряют силу воздействия или рвутся, поэтому пациенту необходимо регулярно посещать ортодонта для замены металлических элементов.
Если вспомогательные приспособления выполнены из эластичного материала, человек может научиться их менять без помощи врача. К ним относятся классические металлические аппараты, часто устанавливаемые в детском возрасте, когда зубы и кости челюсти намного легче поддаются коррекции.
Преимущества и недостатки лигатурных систем
Для изготовления более эстетичных современных брекетов используют керамику, золото или кристаллы искусственных сапфиров, которые имеют возможность лигатурного и безлигатурного исполнения. Главные достоинства наличия лигатуры:
-
Специалисту легче контролировать лечебный процесс, изменяя уровень воздействия брекет-системы. Так достигается достаточно быстрое и эффективное исправление аномалий размещения зубов, расширение или сужение челюсти.

- Если несъемный аппарат брекетов с лигатурой носит ребенок, для маленьких пациентов существует большое разнообразие интересных цветных резиночек для фиксации дуги.
- Для керамических пластин можно подобрать лигатуры прозрачные или белые, заменяя их по степени изменения цвета. Как правило, красящие вещества, содержащиеся в еде, заставляют эластические элементы приобретать желтоватый оттенок через две недели.
- Замена декоративных лигатур на металлические позволяет доктору влиять на скорость перемещения зубов в конце лечения. Такая техника помогает скорее достичь нужного эффекта без получения травм – зубы на этот момент достигают хорошей подвижности.
- Надежная лигатурная система успешно применяется для исправления патологии роста зубов в любом возрасте, имеет наиболее доступную цену среди брекет-систем.
-
По сравнению с другими типами ортодонтических аппаратов, лигатурная система брекетов требует меньше времени для достижения желаемого результата.

Лигатуры служат для прочного соединения брекетов, поэтому высокопрочная конструкция способна выдерживать напряжение любой силы и обеспечивать отличную точность контроля вращения зуба. Однако старая громоздкая конструкция брекетов с лигатурами имеет несколько существенных недостатков:
- Пациент вынужден постоянно бывать на приеме у врача.
- Период адаптации к лигатурным брекетам немного дольше.
- Болевые ощущения достаточно выраженные и возникают каждый раз после замены лигатуры новым элементом.
- Лигатуры для брекетов из искусственных сапфиров и керамики быстро поддаются окрашиванию, требуя частой замены.
- Ортодонтический аппарат требует очень тщательного соблюдения гигиены полости рта после каждого приема пищи.
Наличие лигатурной системы делает конструкцию более заметой. Существуют лингвальные брекеты, крепящиеся к внутренней поверхности зубной эмали, однако их использование в сочетании с лигатурами негативно влияет на качество дикции.
Безлигатурные брекеты
Безлигатурной брекет-системе исправления дефектов ротовой полости отдают предпочтение большинство пациентов. Ее принцип действия заключается в отсутствии элементов крепления благодаря особому строению самого брекета. На нем есть удобные для стоматолога замочки, фиксирующие металлическую дугу в пазах. Данное приспособление стоит дороже, но обладает большей эстетикой. Самолигирующее изделие имеет хорошие показатели быстрого исправления ортодонтических дефектов, поэтому особенно нравится стоматологам.
Плюсы и минусы безлигатурных систем
Многие ортодонты и пациенты выбирают самолигирующие приспособления, которые занимают минимальное место на коронке зуба, что в значительной степени влияет на внешний вид. Основные положительные качества брекет-систем:
-
Конструкции без лигатур выполняются из керамики, пластика и искусственно выращенного сапфира, что делает аппарат эстетичным аксессуаром, а не только вынужденным вестибулярным изделием, портящим внешность.

- Передвижение зубов осуществляется постепенно, с приложением одинакового усилия.
- Скольжение дуги в пазах происходит более плавно благодаря гладкой шлифованной поверхности брекета.
- Брекеты безлигатурных систем приносят меньше дискомфорта для пациентов и вызывают менее выраженные болезненные ощущения.
- Необходимость частого посещения врача ортодонта сводится к минимуму, обычно консультация могут быть через 8-12 недель.
- Одной из наиболее популярных безлигатурных систем является Damon, американская конструкция, для которой характерен красивый современный дизайн и удобное ношение.
В некоторых случаях несложных патологий аппараты без лигатур способны быстро корректировать положение зубов. Также возможно их применение на завершающем этапе лечения – для закрепления результата, полученного от металлической лигатурной конструкции. Материалы для безлигатурных изделий обладают устойчивостью к окрашиванию натуральными пищевыми красителями, что является дополнительным преимуществом.
Небольшие минусы изделий без лигатур:
- С их помощью нельзя исправить значительные дефекты и аномалии развития челюсти.
- Меньшая сила воздействия при выпрямлении зубов, чем в классических лигатурных устройствах.
- Высокая цена, которая не всегда оправдана в итоге лечения.
- Результативность применения зависит от квалификации ортодонта – даже брекеты не всегда могут исправить прикус.
Перед использованием несъемных ортодонтических аппаратов врачами часто осуществляется подготовка, в которую иногда входит удаление здорового зуба. Это нужно для образования свободного места, которое постепенно заполняется другими зубами в долгом процессе выравнивания. Перед установкой безлигатурной конструкции такая подготовка проводиться не всегда.
В чем отличия лигатурных и безлигатурных брекетов?
Разница между воздействием двух разновидностей аппаратов заключается в наличии вспомогательного элемента – лигатуры. От наличия маленькой составной части зависит эстетичный вид и скорость получения эффекта лечения. Брекеты без лигатур обладают молодежным и привлекательным видом, однако применяются в случаях легкой коррекции зубного ряда. Положительное воздействие, а также отличия лигатурных и безлигатурных брекетов:
От наличия маленькой составной части зависит эстетичный вид и скорость получения эффекта лечения. Брекеты без лигатур обладают молодежным и привлекательным видом, однако применяются в случаях легкой коррекции зубного ряда. Положительное воздействие, а также отличия лигатурных и безлигатурных брекетов:
- Пациентами меньше чувствуется боль в начале ношения безлигатурных брекет-систем. Благодаря медленному смещению зубов с их постоянного места, дискомфорт проявляется меньше в отличие от аппаратов с лигатурами, для которых свойственно даже повышение температуры в первые сутки после установки.
-
Проведение гигиенических процедур значительно проще при наличии самолигирующего устройства. Каждый прием пищи должен завершаться тщательной очисткой ротовой полости, которая проводится с помощью специальных зубных щеток для брекетов, зубными ершиками и ирригаторами. Такой набор необходим для удаления частиц еды в межзубном пространстве между дугой и зубом.

- Скорость лечения и получения удовлетворительного результата выше при использовании лигатурных ортопедических установок. Их действие можно назвать более агрессивным, но способным устранить большие нарушения анатомической формы челюсти и зубного ряда.
- Достоинством является то, что брекеты без лигатур мало выделяются на фоне коронки зуба, делая конструкцию малозаметной. Прозрачные сапфировые брекеты имитируют оттенок эмали, придают конструкции особый блеск.
После долгого периода лечения системой брекета с лигатурой или без, стоматологами всегда назначается ношение ортодонтических конструкций, закрепляющих полученный результат. Пациент должен знать, что для установления и фиксирования зубов в окончательной иногда это время занимает от 1,5 – 2-х до пожизненного.
Современные лигатурные и безлигатурные брекеты изготавливаются с применением медицинской нержавеющей стали и других компонентов, выполняющих лечебное и эстетическое назначение. Каждый пациент при помощи компетентного ортодонта может подобрать оптимальный вариант лечения, подходящий его проблеме.
Каждый пациент при помощи компетентного ортодонта может подобрать оптимальный вариант лечения, подходящий его проблеме.
Фото лигатурных и безлигатурных брекетов
Красивые безлигатурные брекеты на фото смотрятся более эстетично:
Фото лигатурных брекетов:
Комбинированная система для откачки масла Lubeworks 10101141 – подвесное оборудование, которое используется в автомастерской, а также в сервисных центрах по замене масла. Устройство оборудуется насосом, способным перекачивать жидкотекучие смазочные вещества. Скорость откачки составляет от 1 до 3.5 литров в минуту. Для удобства пользования модель имеет возможность крепления на стену.
Комплектация установки Lubeworks 10101141 *
Параметры упакованного товара Единица товара: Штука Длина, мм: 130
Произведено
Указанная информация не является публичной офертой ОтзывыОставить свой отзыв На данный момент для этого товара нет расходных материаловСпособы получения товара в МосквеДоставка Вес брутто товара: 22 кг В каком городе вы хотите получить товар? выберите городАбаканАксайАктауАлександровАльметьевскАнадырьАнгарскАрзамасАрмавирАрсеньевАртемАрхангельскАстраханьАхтубинскАчинскБалаковоБалашовБалезиноБарнаулБатайскБелгородБелогорскБерезникиБийскБиробиджанБлаговещенскБодайбоБокситогорскБорБорисоглебскБратскБрянскБугульмаБугурусланБуденновскБузулукВеликие ЛукиВеликий НовгородВеликий УстюгВельскВитебскВладивостокВладикавказВладимирВолгоградВолгодонскВолжскВолжскийВологдаВолховВольскВоркутаВоронежВоскресенскВыборгВыксаВышний ВолочекВязьмаВятские ПоляныГеоргиевскГлазовГорно-АлтайскГрозныйГубкинскийГусь-ХрустальныйДальнегорскДедовскДербентДзержинскДимитровградДмитровДонецкДудинкаЕвпаторияЕгорьевскЕкатеринбургЕлецЕссентукиЗаводоуковскЗеленодольскЗлатоустЗубовоИвановоИгнатовоИжевскИзбербашИнтаИркутскИшимЙошкар-ОлаКазаньКалининградКалугаКаменск-УральскийКаменск-ШахтинскийКамень-на-ОбиКанашКанскКарагандаКарасукКаргопольКемеровоКерчьКинешмаКиришиКировКиселевскКисловодскКлинКлинцыКоломнаКолпашевоКомсомольск-на-АмуреКоролевКостромаКотласКраснодарКрасноярскКропоткинКудьмаКузнецкКуйбышевКумертауКунгурКурганКурскКызылЛабинскЛабытнангиЛаговскоеЛангепасЛенинск-КузнецкийЛесосибирскЛипецкЛискиЛуневоЛюдиновоМагаданМагнитогорскМайкопМалые КабаныМахачкалаМеждуреченскМиассМинскМихайловкаМичуринскМоскваМуравленкоМурманскМуромНабережные ЧелныНадеждаНадымНазраньНальчикНаро-ФоминскНарьян-МарНаходкаНевинномысскНерюнгриНефтекамскНефтеюганскНижневартовскНижнекамскНижний НовгородНижний ТагилНовая ЧараНовозыбковНовокузнецкНовороссийскНовосибирскНовочебоксарскНовочеркасскНовый УренгойНогинскНорильскНоябрьскНурлатНяганьОбнинскОдинцовоОзерскОктябрьскийОмскОнегаОрелОренбургОрехово-ЗуевоОрскПавлодарПангодыПензаПермьПетрозаводскПетропавловскПетропавловск-КамчатскийПикалевоПлесецкПолярныйПригородноеПрокопьевскПсковПятигорскРеутовРоссошьРостов-на-ДонуРубцовскРыбинскРязаньСалаватСалехардСамараСанкт-ПетербургСаранскСарапулСаратовСаянскСвободныйСевастопольСеверныйСеверобайкальскСеверодвинскСеверскСерпуховСимферопольСлавянск-на-КубаниСмоленскСоликамскСорочинскСочиСтавропольСтарый ОсколСтерлитамакСургутСызраньСыктывкарТаганрогТаксимоТамбовТаштаголТверьТихвинТихорецкТобольскТольяттиТомскТуапсеТулаТуркестанТюменьУдомляУлан-УдэУльяновскУрайУральскУрюпинскУсинскУсолье-СибирскоеУссурийскУсть-ИлимскУсть-КутУсть-ЛабинскУфаУхтаФеодосияХабаровскХанты-МансийскХасавюртЧайковскийЧебоксарыЧелябинскЧеремховоЧереповецЧеркесскЧитаЧусовойШарьяШахтыЭлектростальЭлистаЭнгельсЮгорскЮжно-СахалинскЯкутскЯлтаЯлуторовскЯрославль Самовывоз: бесплатно
Сервис от ВсеИнструменты.руМы предлагаем уникальный сервис по обмену, возврату и ремонту товара! Обратиться по обмену, возврату или сдать инструмент в ремонт вы можете в любом магазине или ПВЗ ВсеИнструменты.ру.Гарантия производителяГарантия производителя 1 годГарантийный ремонтЗдесь вы найдете адреса расположенных в вашем городе лицензированных сервисных центров.
| Может понадобиться |
Система здравоохранения показала способность к быстрой трансформации
Завершившийся год стал серьезным испытанием для системы здравоохранения нашей страны.
Все последние годы она подвергалась жесткой критике в СМИ, социальные опросы показывали рост недовольства ею со стороны пациентов, многие вспоминали достижения советского здравоохранения и сожалели о допущенных системных ошибках, и об утрате нравственных принципов медперсоналом и т.д.
– Мы имеем два взаимоисключающих процесса: с одной стороны, идет рост, развитие инфраструктуры, меняются внешний вид и “начинка” медицинских организаций, – отметил в своем выступлении на Гайдаровском форуме министр здравоохранения РФ Михаил Мурашко. – В то же время удовлетворенность населения качеством оказания медицинской помощи снижется. И одна из важных задач – преодолеть этот крест. Развитие инфраструктуры и удовлетворенность населения, конечно, должны идти параллельно.
Однако при всем своем несовершенстве и потерях, понесенных за последние десятилетия, российское здравоохранение не только справилось с новыми вызовами, но и доказало способность быстро исправлять ошибки, умело перестраиваться. А наши врачи, медсестры, фельдшеры и другие работники отрасли доказали, что традиции служения людям, созданные предыдущими поколениями медиков, сохранены и преумножены.
– В 2020 году мы поняли, что скорость принятия решений должна быть совершенно другой, чтобы буквально в течение месяца могли появиться новые прорывные методы диагностики и лечения, переформатированы маршрутизация и методы оказания медпомощи. Правительство своим постановлением от 2 июля приняло инновационное решение, утвердив временные порядки оказания медпомощи и методические рекомендации по лечению. И весь 2020 год система фактически работала всего по двум документам, причем оба они постоянно развивались. Необходимо было также переформатировать койки, появился термин “койки двойного назначения”, минимальные требования к оснащению койки, норматив расчета – все это позволило создать подушку безопасности, обеспечить готовность к оказанию одновременной помощи тысячам пациентов. Требовалась мобилизация специалистов для борьбы с новыми вызовами. Формат дистанционного обучения позволил за считанные недели обучить более 1 миллиона 400 тысяч медицинских работников правилам работы в новых условиях.
Этот год показал, что необходимо развивать санэпиднадзор и методы локализации инфекционных заболеваний, подчеркнул Михаил Мурашко. Вышедшее в конце 2020 года распоряжение правительства включает в себя эти меры: разработку технологии раннего обнаружения и детекции возбудителя, методов лечения и профилактики, стандартизацию платформ для разработки средств специфической профилактики. А указ президента от 4 января 2021 года определил и этапы модернизации системы в целом, начиная от возникновения заболеваний на территориях других стран и их до борьбы с распространением внутри нашей страны.
Но возник и ряд неинфекционных вызовов: где взять достаточное количество средств защиты, лекарств, которые одновременно начинают использоваться в больших объемах и практически во всех странах? Как сохранить управляемость, организовать быстрый сбор данных для принятия организационных решений? Сделать это позволяет только цифровая трансформация отрасли. И конечно, нужно помнить и о социально значимых заболеваниях, которые развиваются независимо от эпидситуации -онкологических, аутоиммунных, сахарном диабете и т.д. Они тоже приобрели новое звучание, поскольку такие пациенты более уязвимы.
Не помешала пандемия и выполнению важнейших федеральных проектов. Примером является, в частности, проект “Борьба с онкологическими заболеваниями”.
– Когда мы принимали решения по организации медпомощи в 2020 году, этой категории пациентов всегда уделялось особое внимание, – подчеркнул в своем докладе на Гайдаровском форуме заместитель министра здравоохранения РФ Евгений Камкин. – Во всех нормативных документах и рекомендациях было прописано, что медицинские организации, которые оказывают им помощь, не должны участвовать в перепрофилировании под лечение больных с коронавирусной инфекцией. Все объемы помощи и все ее финансирование было сохранено в полном объеме. По предварительным данным, удалось не только не увеличить смертность от онкозаболеваний, но даже снизить ее. Мы также наращиваем объемы по числу курсов необходимой химиотерапии и по ее сложности: если раньше использовались наиболее простые схемы, то сейчас они достаточно сложные, с применением дорогостоящих препаратов. Сейчас помощь этим пациентам оказывают больше 90 организаций, и в течение всего года шло обновление их материально-технической базы. Мы не снизили планы по количеству оборудования, которое было поставлено и введено в эксплуатацию. В целом планы по реализации федерального проекта на 2020 год, были выполнены.
Подробный анализ работы системы здравоохранения в период пандемии еще впереди. Но уже сегодня можно сделать вывод, что она оказалась готова и к инфекционным вызовам, и в целом к работе в условиях чрезвычайной ситуации, и к быстрому развитию в интересах пациентов.
Фотосистема– обзор | ScienceDirect Topics
5.5.1 Метаболиты, связанные с активными формами кислорода, очищающимися под действием светового стресса
Перевозбуждение фотосистемы высокой интенсивностью света вызывает перепроизводство супероксидных радикалов, а также приводит к увеличению времени жизни возбужденной молекулы хлорофилла, что приводит к увеличению шансов производства АФК. Одним из наиболее эффективных механизмов, используемых растениями для смягчения последствий фотоповреждения, является цикл ксантофилла (Latowski et al., 2011). Некоторые каротиноиды этого цикла действуют как тушитель синглетного хлорофилла, снижая образование АФК (Gruszecki et al., 2006). Среди шести циклов ксантофилла цикл Vx является наиболее изученным и также называется циклом ксантофилла. Основным продуктом этого цикла является стимулированное светом производство зеаксантина путем деэпоксидирования (Latowski et al., 2011). Лучшая корреляция между повышенным уровнем зеаксантина и нефотохимическим тушением (NPQ) была установлена в изолированных хлоропластах Spinacia oleracea (Latowski et al., 2011). Однако цикл ксантофилла работает одновременно с циклом лютеина, что способствует быстрому взаимодействию NPQ с одновременным накоплением зеаксантина, вызывая сильное рассеяние энергии в растениях (García-Plazaola et al., 2007). Чтобы контролировать уровень АФК, растения изменяют свой метаболизм, чтобы синтезировать различные молекулы антиоксидантов. Молекулы низкомолекулярных антиоксидантов, такие как аскорбат и глутатион, являются основными молекулами антиоксидантов, уровни которых повышаются во время легкого и умеренного стресса, но снижаются в условиях тяжелого стресса (Fini et al., 2011). Следовательно, в тяжелых стрессовых условиях в игру вступают другие вторичные антиоксидантные молекулы, то есть в тяжелых стрессовых условиях происходит синтез изопреноидов и флавоноидов, дополняющих первичную антиоксидантную систему (Brunetti et al., 2015). Neugart et al. (2016) изучали реакцию Brassica oleracea на высокую интенсивность света, и было обнаружено, что растения, выращенные при высокой интенсивности света, имеют более высокий уровень общих флавоноидов с повышенными уровнями гликозидов кверцетина, кофейной кислоты, моноацилированного кемпферола. тригликозид и дезинапоилгентиобиоза.Накопление флавоноидов также наблюдалось в листьях Ligustrum vulgare во время чрезмерного воздействия солнечного света (Tattini et al., 2004). Эти исследования, показывающие более высокое накопление флавоноидов при избытке света, предполагают роль флавоноидов как молекулы антиоксиданта.
Разрушение озонового слоя из-за увеличения производства хлорфторуглерода привело к увеличению воздействия УФ-излучения на растения. УФ-свет в диапазоне 280–320 (УФ-В) является наиболее разрушительным и вызывает повреждение ДНК, РНК и белков, а также генерирует АФК в растениях.В растениях происходят биохимические и физиологические изменения, чтобы свести к минимуму негативные эффекты окислительного повреждения растений, вызванного УФ-излучением. Флавоноиды и антоцианы являются основными метаболитами, поглощающими УФ-излучение, они избирательно поглощают УФ-излучение и позволяют фотосинтетически активному излучению проходить через слой клеток мезофилла (Hidema and Kumagai, 2006). Основными соединениями, которые активируются во время УФ-стресса, являются метаболиты, связанные с метаболическим путем шикимата. Лютеолин-7-глюкуронид представляет собой флавоноидное соединение, связанное с устойчивостью к ультрафиолетовому излучению в Salix sp.(Тегельберг и Юлкунен-Тийтто, 2001). Точно так же кверцетин-3-6′-малонил-глюкозид и кверцетин-3-глюкуронид представляют собой флавоноидные соединения, концентрация которых увеличивается во время УФ-стресса в Lactuca sativa и плодах клубники, соответственно (DuPont et al., 2000). Кроме того, аскорбат, токоферол, витамин B 6 и каротиноиды также обеспечивают защиту от УФ-стресса (Harvaux and Kloppstech, 2001). Полиамины также играют важную роль в поддержании структуры и функции фотосинтетического аппарата.Сообщалось, что полиамины, такие как путресцин, спермин и спермидин, связаны со светособирающим комплексом и комплексом ФСII, на которые больше всего влияет высокая интенсивность света и УФ-облучение (Lütz et al., 2005). Эффекты положительного заряда полиаминов на защиту ФСII от чрезмерного освещения были исследованы на изолированных тилакоидах, и было замечено, что применение полиаминов, таких как спермин и спермидин, улучшает фотосинтетическую эффективность растения (Hamdani et al., 2011).
Границы | Структура и функции суперкомплексов фотосистемы
Введение
Фотосинтез выполняет ряд биофизических и биохимических процессов, в конечном итоге преобразуя солнечную энергию в химическую. Кислородный фотосинтез расщепляет молекулы воды на кислород, который необходим для поддержания аэробной жизни на Земле (Dismukes et al., 2001). Считается, что фотосинтез произошел только один раз за всю историю эволюции цианобактерий.У водорослей и высших растений они приобрели способность к фотосинтезу через эндосимбионтов цианобактерий, которые эволюционировали в хлоропласты растений (Tomioka and Sugiura, 1983). Листья растений являются основными органами фотосинтеза, в каждой клетке мезофилла содержится около 100 хлоропластов (Woodson, 2016). Благодаря своей важной роли в сборе света и производстве энергии, хлоропласты являются жизненно важными органеллами фотосинтетических клеток водорослей и высших растений, выступая в качестве поставщиков источников углерода и энергии. Хлоропласт – это большая органелла со сложной структурой, несущая две внешние мембраны, называемые оболочкой хлоропластов, и третью сильно сложенную внутреннюю мембранную систему, называемую тилакоидом (Arvidsson and Sundby, 1999; Kirchhoff, 2013).Тилакоидная мембрана состоит из двух морфологически различных доменов: домена грана, который характеризуется ~ 5-20 слоями цилиндрических стопок тилакоидных мембранных дисков (Mullineaux, 2005; Mustárdy et al., 2008), и домена ламелл стромы, которые являются обнаженные стромой мембранные пары, соединяющие стеки гран (Dekker and Boekema, 2005).
У цианобактерий, водорослей и высших растений есть два типа фотосистем, называемых фотосистемой I (PSI, пластоцианин-ферредоксин оксидоредуктаза) и фотосистемой II (PSII, водно-пластохинон оксидоредуктаза), оба из которых представляют собой многосубъединичные мембранные комплексы.PSI располагается в ламелле стромы тилакоида, тогда как PSII находится в стековом грана домене (Albertsson, 2001; Dekker and Boekema, 2005). Каждая фотосистема состоит из основного комплекса и периферической антенной системы, светособирающего комплекса I (LHCI) для PSI и светособирающего комплекса II (LHCII) для PSII, соответственно. Недавно появились сообщения о новых структурах фотосистем с атомным разрешением и подробном понимании процесса расщепления воды с развитием одночастичной криоэлектронной микроскопии, последовательной кристаллографии с временным разрешением и других методов.Здесь мы рассмотрим недавний прогресс в исследованиях структур и функций фотосистем различного происхождения с акцентом на PSII-LHCII.
Биохимия фотосистем
Полные фотосинтетические реакции в цианобактериях, водорослях и растениях выполняются четырьмя основными белковыми суперкомплексами, включая PSI, PSII, цитохром b 6 f (пластохинон-пластоцианин оксидоредуктаза) и F-АТФаза (АТФ-синтаза, управляемая протонной движущей силой) ( Nelson and Benshem, 2004; Nelson and Yocum, 2006).Суперкомплексы PSI и PSII связывают молекулы хлорофилла, воспринимая разные спектры и интенсивности света (Remelli et al., 1999; Nelson and Yocum, 2006; Croce and van Amerongen, 2013; van Amerongen and Croce, 2013; Caffarri et al., 2014). ; Рубан, 2015). Свет, собранный хлорофиллами и другими пигментами в PSI и PSII, передается в центр фотосинтетической реакции (RC), дополнительно вызывая возбуждение хлорофиллов, известных как P680 для PSII и P700 для PSI, чтобы инициировать перемещение протонов через мембрану (Nelson and Junge , 2015).В ФСII P680 подвергается разделению зарядов, и генерируемые электроны последовательно передаются акцептору хинона феофитину и пластохинону (Grabolle and Dau, 2005; Johnson, 2016). Между тем, молекула воды, подлинный донор электронов, окисляется до молекулярного кислорода, и в конечном итоге P680 восстанавливается. После реакции электроны в конечном итоге переносятся на цитохром b 6 f, встроенный в тилакоид, который окисляет пластохинолы до пластохинонов и восстанавливает пластоцианины (Cramer et al., 1996). Затем пластоцианин окисляется PSI, во время которого восстановленный белок-переносчик электронов ферредоксин используется для восстановления NADP + до NADPH ферментом ферредоксин-NADP + редуктаза (FNR) (Brettel and Leibl, 2001; Sétif, 2001; Golbeck, 2006). Вместе PSII генерирует наиболее положительный окислительно-восстановительный потенциал, тогда как PSI генерирует мощный природный восстановитель НАДФН (Hope, 2000; Holzwarth et al., 2006; Nelson, 2011). Фотокаталитическая активность ФСII и ФСI связана с комплексом цитохрома b 6 f, и протонодвижущая сила, генерируемая во время процесса, используется F-АТФазой для генерации АТФ, который вместе с НАДФН поставляется в качестве энергетических соединений для синтез сахара из углекислого газа по реакции темноты (Pfannschmidt, 2003).
Первая структура PSI термофильной цианобактерии Synechococcus elongatus ( S. elongatus ) показала комплекс из 12 белковых субъединиц и 127 кофакторов (96 хлорофиллов, 22 каротиноидов, 2 филлохинона, 3 Fe 4 S 4 кластеров. , и 4 липидов), обеспечивая самую первую детальную молекулярную архитектуру PSI (Fromme et al., 2001; Jordan et al., 2001). S. elongatus PSI представляет собой тример с диаметром 210 Å и максимальной высотой 90 Å (Jordan et al., 2001), а суперкомплекс PSI растений – мономер (Ben-Shem et al., 2003). Основной комплекс в значительной степени консервативен от цианобактерий до растений с девятью встроенными в мембрану субъединицами, тогда как комплексы LHCI различаются по составу субъединиц, связывающим пигментам и размерам из-за различных сред обитания цианобактерий, водорослей и растений (Ben-Shem et al. , 2003; Qin et al., 2015). Однако, хотя PSI и PSII произошли от одного и того же предка, принадлежащего к одному суперсемейству, их структуры во многом различаются.
Структура суперкомплекса PSII цианобактерий
Гомодимер PS II из Thermosynechococcus elongatus ( T. elongatus ) имеет размеры 105 Å в глубину (45 Å в мембране), 205 Å в длину и 110 Å в ширину (Ferreira et al., 2004). Суперкомплекс PSII у цианобактерий включает белки реакционного центра (RC) D1 и D2, антенные субъединицы CP47 и CP43, 13 присущих мембране малых субъединиц (PsbE, PsbF, PsbH-M, PsbN, PsbX, PsbY, PsbZ и PsbYcf12). и 3 внешние субъединицы (PsbO, PsbU и PsbV).Структуры D1 и D2 подобны друг другу, обе содержат по пять спиралей, все наклонены относительно плоскостей мембран (Zouni et al., 2001; Kamiya and Shen, 2003), и они образуют центр комплекса PSII. CP43 и CP47 окружают ядро D1-D2 аналогичными структурами из шести спиралей, соответственно. Впоследствии Loll et al. (2005) представили первую полную структуру фотосистемы II цианобактерий, дающую полное представление о кофакторах PSII. Они отображали положения 20 белковых субъединиц и их взаимодействия с 77 кофакторами (рис. 1А).Общие структуры суперкомплекса и белковых субъединиц сходны с ранее описанными (Zouni et al., 2001; Kamiya and Shen, 2003; Biesiadka et al., 2004). Долгое время считалось, что липиды играют роль в сборке и функционировании PSII, и впервые авт. Показали, что липиды интегрально связаны с PSII. Одиннадцать липидов, окружающих RC, образуют пояс, отделяющий его от антенны и небольших белковых субъединиц, в то время как остальные липиды в основном расположены на границе раздела мономер-мономер.Свойство богатства липидами придает PSII как структурную гибкость для локальной подвижности, так и удобство в распознавании субъединица-субъединица (Guskov et al., 2009). Одиннадцать молекул каротиноидов были смоделированы как β-каротины в полностью транс-конфигурациях в их исследовании, а дополнительный Car15 был идентифицирован в исследовании Guskov et al. (2009). В исследовании Гуськова и соавт. (2009), они также успешно отнесли малые белковые субъединицы Psbycf12, PsbY и PsbX к ранее не назначенным позициям (Loll et al., 2005; Гуськов и др., 2009). Сводная информация о составе субъединиц, включая взаимодействия субъединица-кофактор в PSII из T. elongatus , представлена в таблице 1 (Guskov et al., 2009). В 2009 году Broser et al. представили первую структуру мономерной формы корового комплекса ФСII (PSIIcc) с высокой способностью выделять кислород из T. elongatus (Broser et al., 2010). Сборка белковых субъединиц, тетрапиррольных кофакторов и негемового железа в мономерной PSIIcc идентична таковой в димерной структуре.
РИСУНОК 1. Общие структуры основного комплекса ФСII из Tynechococcus elongatus (A) и шпината (B) . Граница раздела мономер-мономер обозначена черной пунктирной линией. Показаны только четыре большие субъединицы и внутренние субъединицы PSII. Субъединицы D1 (синий), D2 (салатовый), CP43 (желтый) и CP47 (голубой), а также другие маленькие субъединицы помечены в мономере слева. Кофакторы показаны в виде палочек, включая Chl (зеленый), Car (оранжевый), гем (светло-пурпурный) и липиды (красный).Кластер Mn показан сферами.
ТАБЛИЦА 1. Трансмембранные (TM) спирали, хлорофиллы и другие кофакторы РЦ ФСII цианобактерий и растений 1 .
Во время фотосинтеза окисление воды происходит в кислородно-выделяющем комплексе (OEC), который включает кластер Mn 4 CaO 5 в качестве каталитического центра. Разделение воды – это процесс, выполняемый в пять последовательных этапов с названиями от S 0 до S 4 .Это модельная система для синтеза катализаторов окисления неорганической воды и выделения дикислорода (Kanady and Agapie, 2011; Mukherjee et al., 2012). В работе Ferreira et al. (2004), они сообщили, что OEC содержит «кубаноподобный» кластер Mn 3 CaO 4 , связанный с четвертым Mn моно-μ-оксомостиком, что специально не предполагалось ранее. Однако ни вода, ни гидроксид не смогли точно определить место окисления воды в их исследовании.В первой полной структуре ФСII кластер Mn 4 Ca был предложен как «Y-образный крючок», что значительно отличалось от «кубановидной» модели (Loll et al., 2005). Затем рентгеновская структура ФСII с разрешением 1,9 Å из T. vulcanus показала четкую картину кластера Mn 4 CaO 5 , в котором концентрации электронов для каждого иона металла и оксомостиковых атомов кислорода были полностью разделены, что позволило четко определить принадлежность каждого из атомов. Они обнаружили, что кластер OEC Mn 4 CaO 5 демонстрирует конформацию «искаженное кресло» с тремя атомами Mn, одним Ca и четырьмя атомами кислорода, образующими асимметричное кубаноподобное основание сиденья и четвертый Mn (Mn 4 ) вместе. с пятым атомом кислорода (O 4 ), образующим спинку стула (Umena et al., 2011). Впоследствии одновременная фемтосекундная рентгеновская спектроскопия и дифракция системы PSII показали, что карты электронной плотности темного и освещенного состояний схожи с общим коэффициентом корреляции (CC) 0,77 (CC 0 означает отсутствие корреляции; CC 1 указывает на полную корреляцию), указывая на отсутствие значительных конформационных изменений между состояниями S 1 и S 2 (Kern et al., 2013). Однако с помощью последовательной кристаллографии с временным разрешением авторы получили структуры ФСII в темноте S 1 и предполагаемых состояниях S 3 , в которых они обнаружили, что расстояние между кубаном Mn 3 O x Ca и удаленный выступающий Mn (dangler Mn) увеличивался в предполагаемом состоянии S 3 , позволяя связывать вторую молекулу воды во время перехода между состояниями S 2 и S 3 (Kupitz et al., 2014). Более того, с помощью фемтосекундного рентгеновского лазера на свободных электронах (XFEL) «без радиационных повреждений» Suga et al. (2015, 2017) обнаружили, что расстояния Mn-Mn и Mn-O показали заметные отличия OEC от XFEL: все расстояния примерно на 0,1–0,2 Å короче, чем расстояния от структур дифракции рентгеновских лучей (XRD). К тому же позиция O5 тоже необычна. Результаты показали, что он действует больше как гидроксид-ион, а не как обычный кислородный дианион, выступающий в качестве одного из атомов кислорода субстрата (Suga et al., 2015). В их недавней работе описаны вызванные светом структурные изменения в ФС II с помощью двух вспышек освещения, смоделирован шестой атом кислорода (O6), близкий к O5, и дано важное значение для механизма образования связи O = O (Suga et al., 2017) . Кроме того, сообщалось, что ион хлорида необходим для выделения кислорода, и есть два сайта связывания анионов, расположенные по обе стороны от кластера MnCa на одинаковом расстоянии от кластера, чтобы стабилизировать его структуру (Kawakami et al., 2009).
Структура суперкомплекса ФСИИ завода
ФСII растений имеет общую структуру димерного суперкомплекса, аналогичную цианобактериальной ФСII. Первая структура комплекса растительных ФСII-LHCII из шпината была получена 17 лет назад при 17 Å (Nield et al., 2000), а недавно – шпинат 3,2 Å. C 2 S 2 -тип (C: ядерный комплекс ФСII. ; S: сильно ассоциированный тример LHCII) о суперкомплексной структуре сообщалось с развитием методов криоэлектронной микроскопии одиночных частиц (Wei et al., 2016) (Рисунок 1B). Совсем недавно структура доминирующего типа суперкомплекса у растений, C 2 S 2 M 2 -типа (M: умеренно связанные LHCII), также была решена при 2,7 и 3,2 Å для стекированных и неупакованных форм из Pisum sativum (горох) и 5,3 Å от Arabidopsis thaliana соответственно (Su et al., 2017; van Bezouwen et al., 2017). По сравнению со структурой суперкомплекса типа C 2 S 2 из шпината, структура, описанная Su et al.(2017) был определен в более физиологических условиях, содержащих три мономера светособирающего комплекса (LHC) (CP29, CP26 и CP24) и два тримера (S-LHCII и M-LHCII) на ядро. Напротив, CP24 и M-LHCII отсутствуют в предыдущей структуре Wei et al. (2016). ФСII растений действительно демонстрирует такой же состав и организацию субъединиц и кофакторов, что и их цианобактериальные аналоги (Таблица 1). Каталитический центр в ядре комплекса состоит из четырех крупнейших внутренних субъединиц мембраны PsbA (D1), PsbB (CP47), PsbC (CP43) и PsbD (D2).В частности, D1 и D2 образуют фотохимический RC, который отвечает за разделение зарядов и перенос электронов, а CP47 и CP43 действуют как внутренние антенные белки, участвующие в сборе света и транспортировке энергии от периферийной антенны к RC. В базовом комплексе также есть 12 низкомолекулярных (ММ) мембранных субъединиц, окружающих реакционный центр, образующих ленточную структуру. В комплексе шпината PSII-LHCII этими субъединицами являются PsbE, PsbF, PsbH-M, PsbTc, PsbW, PsbX и PsbZ.Большинство этих субъединиц структурно консервативны с одной трансмембранной спиралью, за исключением PsbZ с двумя спиралями. Эти субъединицы важны как для димеризации, так и для стабилизации основного комплекса, а также для ассоциации между основным комплексом и периферическим антенным комплексом. Кроме того, они связывают цитохром b -559 для защиты комплекса PSII от фотоповреждений. Три внешние субъединицы PsbO, PsbP и PsbQ составляют OEC, который также включает люминальный домен CP43 и C-концевой домен D1, защищая механизм расщепления воды.Среди них PsbO стабилизирует комплекс Mn, в то время как PsbP и PsbQ участвуют в оптимизации выделения кислорода при физической концентрации ионов кальция и хлорида. Сравнение структур также показало, что гибкие области этих субъединиц испытывают значительные конформационные изменения, когда они связываются с основным комплексом (Wei et al., 2016). Вне основного комплекса находится LHCII, структура которого в суперкомплексе PSII почти такая же, как и в комплексе LHCII гороха (Standfuss et al., 2005).
LHCII растений занимает около 30% всех белков в хлоропластной мембране, поэтому представляет собой самый распространенный мембранный белок на Земле (Peter and Thornber, 1991; Standfuss et al., 2005). LHCII действует как гетеротример, состоящий из Lhcb1, Lhcb2 и Lhcb3. Каждый полипептид трижды охватывает тилакоидную мембрану, при этом его С-конец располагается на просветной стороне (Kuhlbrandt et al., 1994). Комплекс LHCII жизненно важен как для фотосинтеза, так и для образования гран хлоропластов. Для первой функции гетеротримеры LHCII связаны с основным комплексом фотосистемы с помощью минорных антенных субъединиц Lhcb4 (CP29), Lhcb5 (CP26) и Lhcb6 (CP24).В суперкомплексе шпината PSII-LHCII два гетеротримера LHCII вместе с двумя белками CP26 фланкируют димерный комплекс ядра с обеих сторон (Wei et al., 2016). В то время как в суперкомплексе C 2 S 2 M 2 из Arabidopsis и гороха имеется четыре тримера LHCII, из которых два прочно связанных тримера LHCII (S 2 ) вместе с CP26 и CP24, и умеренно связанные тримеры (M 2 ) с CP29 вместе образуют остовный комплекс для транспорта электронов (Su et al., 2017; van Bezouwen et al., 2017). Для второй функции стромальная поверхность тримера LHCII заряжена отрицательно, тогда как его первые 15 остатков на N-конце содержат 4 положительно заряженных остатка. Эта поразительная картина заряда напоминает режим «липучки», гарантирующий неспецифические взаимодействия тримеров LHCII в соседних тилакоидных мембранах (Standfuss et al., 2005), что кажется важным для образования гран хлоропластов. Сообщалось, что конститутивная экспрессия Lhcb1 значительно увеличивала стеки гран в трансгенных растениях табака (Labate et al., 2004), тогда как нокдаун Lhcb1 и Lhcb2 препятствует образованию стеков гран (Andersson et al., 2003; Garab, 2014, 2016). В недавней работе, чтобы выяснить, как суперкомплексы PSII-LHCII взаимодействуют друг с другом в тилакоиде хлоропластов, авторы выделили суперкомплексы PSII-LHCII в ионной концентрации, которая напоминает естественное окружение хлоропластов, и обнаружили, что большинство суперкомплексов существуют в парной форме C 2 S 2 M (Albanese et al., 2017).Это исследование предоставило новое понимание того, как соседние тилакоиды могут быть связаны, чтобы обеспечивать укладку мембран грана посредством взаимодействий между парами суперкомплексов PSII-LHCII.
Кофакторы в суперкомплексе PSII-LHCII незаменимы для их соответствующих функций. Как и у цианобактерий, эти кофакторы в основном включают хлорофиллы, каротиноиды, липиды и т. Д. (Таблица 1). В суперкомплексе шпината C 2 S 2 PSII-LHCII всего 105 молекул хлорофилла, 28 β-каротинов и ксантофиллов, один гем, один кластер Mn 4 CaO 5 , один пластохинон и множество липидов.Интересно, что мономер LHCII демонстрирует сходство как аминокислотной последовательности, так и структуры с таковыми у CP29, однако тип, количество и расположение хлорофиллов, которые они связывают, значительно отличаются (Liu et al., 2004; Standfuss et al., 2005; Pan и др., 2011). LHCII – крупнейшие антенные субъединицы, связанные с хромофором, содержащие хлс, которые поглощают солнечное излучение с различными длинами волн 660 ± 20 нм.
Выводы и перспективы
Фотосинтез играет очень важную роль в производстве молекулярного кислорода, контроле над углекислым газом в атмосфере и глобальном обеспечении продуктами питания.Структурная информация о фотосистемах неоценима для нашего понимания фотосинтеза, вероятно, самого важного процесса на Земле. Информация также поможет разработать искусственную фотосинтетическую систему для улучшения производства биоэнергии и повышения продуктивности сельского хозяйства. Совсем недавно также сообщалось о структуре крупнейшего светособирающего комплекса фикобилисом (PBS) из Griffithsia pacifica (Zhang et al., 2017). Как основная светособирающая антенна у цианобактерий и красных водорослей, она демонстрирует очень высокую скорость передачи энергии с высоким квантовым выходом (Glazer, 1989).Структурная информация PBS обеспечит прочную основу для понимания путей передачи энергии и дальнейшего применения в конструкциях механизмов искусственного сбора света.
Последние достижения в области криоЭМ одиночных частиц предоставили беспрецедентную структурную информацию об этих огромных мембранных комплексах. Однако есть также несколько открытых вопросов, на которые необходимо ответить. Во-первых, точный механизм реакции, лежащий в основе окисления воды и возможных структурных перестроек во время переходов в S-состояния, все еще ожидает структур ФСII в более промежуточных S-состояниях.Во-вторых, все еще не совсем понятно, почему в PSII функционирует только одна цепь переноса электронов (как в бактериальных RC), тогда как в PSI функционируют обе (Santabarbara et al., 2010). Поскольку статические структуры, решенные до сих пор, не дали убедительных ключей в этом отношении, новые исследования, изучающие динамическую природу ФСII, могут пролить больше света на это, что очень важно для того, чтобы сделать ФСII не только протонным насосом, но и местом расположения O 2. Evolution. В-третьих, требуется больше структурной информации для выяснения локализации и функций PsbR и PsbS, субъединиц PSII, которые необходимы для активности выделения кислорода (Allahverdiyeva et al., 2007) и фотозащиты растений (Fan et al., 2015) соответственно. Наконец, новые структуры фотосистем с высоким разрешением из цианобактерий, водорослей и растений дадут больше информации об эволюции кислородного фотосинтеза, на основе которого могут быть разработаны более совершенные механизмы искусственного фотосинтеза.
Авторские взносы
JG написал рукопись с помощью HW и QY. YF просмотрел и отредактировал рукопись.
Финансирование
Работа была поддержана Национальным фондом естественных наук Китая (гранты №31400635 и 31670766).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Приносим свои извинения коллегам, чьи работы не удалось процитировать из-за нехватки места.
Ссылки
Альбанезе, П., Мелеро, Р., Энгель, Б. Д., Гринзато, А., Берто, П., Манфреди, М., и другие. (2017). Суперкомплексы PSII-LHCII гороха образуют пары, создавая соединения через стромальную щель. Sci. Отчет 7: 10067. DOI: 10.1038 / s41598-017-10700-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альбертссон, П. (2001). Количественная модель доменной структуры фотосинтетической мембраны. Trends Plant Sci. 6, 349–354. DOI: 10.1016 / S1360-1385 (01) 02021-0
CrossRef Полный текст | Google Scholar
Аллахвердиева Ю., Мамедов, Ф., Суорса, М., Стайринг, С., Васс, И., и Аро, Э. М. (2007). Изучение функции белка PsbR в Arabidopsis thaliana. Биохим. Биофиз. Acta 1767, 677–685. DOI: 10.1016 / j.bbabio.2007.01.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андерссон, Дж., Вентворт, М., Уолтерс, Р. Г., Ховард, К. А., Рубан, А. В., Хортон, П. и др. (2003). Отсутствие белков Lhcb1 и Lhcb2 светособирающего комплекса фотосистемы II влияет на фотосинтез, укладку гран и приспособленность. Plant J. Cell Mol. Биол. 35, 350–361. DOI: 10.1046 / j.1365-313X.2003.01811.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арвидссон, П. О. и Сундби, К. (1999). Модель топологии тилакоидной мембраны хлоропластов. Функц. Plant Biol. 26, 687–694. DOI: 10.1071 / PP99072
CrossRef Полный текст | Google Scholar
Биесядка, Дж., Лолл, Б., Керн, Дж., Иррганг, К. Д., и Зуни, А. (2004). Кристаллическая структура фотосистемы цианобактерий II в позиции 3.Разрешение 2 Å: более пристальный взгляд на Mn-кластер. Phys. Chem. Chem. Phys. 6, 4733–4736. DOI: 10.1039 / B406989G
CrossRef Полный текст | Google Scholar
Бреттель, К., Лейбл, В. (2001). Электронный перенос в фотосистеме I. Биохим. Биофиз. Acta 1507, 100–114. DOI: 10.1016 / S0005-2728 (01) 00202-X
CrossRef Полный текст | Google Scholar
Брозер М., Габдулхаков А., Керн Дж., Гуськов А., Мюх Ф., Зенгер В. и др. (2010).Кристаллическая структура мономерной фотосистемы II из Thermosynechococcus elongatus при разрешении 3,6 Å. J. Biol. Chem. 285, 26255. doi: 10.1074 / jbc.M110.127589
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каффарри, С., Тибилетти, Т., Дженнингс, Р. К., и Сантабарбара, С. (2014). Сравнение архитектуры и функционирования фотосистемы I растений и фотосистемы II. Curr. Prot. Peptide Sci. 15, 296–331. DOI: 10.2174 / 1389203715666140327102218
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крамер, В.А., Сориано, Г. М., Пономарев, М., Хуанг, Д., Чжан, Х., Мартинес, С. Э. и др. (1996). Некоторые новые структурные аспекты и старые противоречия относительно комплекса цитохрома b6f оксигенного фотосинтеза. Annu. Rev. Plant Physiol. Завод Мол. Биол. 47, 477–508. DOI: 10.1146 / annurev.arplant.47.1.477
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Деккер, Дж. П., и Бокема, Э. Дж. (2005). Надмолекулярная организация белков тилакоидной мембраны зеленых растений. Biochim. Биофиз. Acta 1706, 12–39. DOI: 10.1016 / j.bbabio.2004.09.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дисмукес, Г. К., Климов, В. В., Баранов, С. В., Козлов, Ю. Н., ДасГупта, Дж., И Тырышкин, А. (2001). Происхождение атмосферного кислорода на Земле: инновация кислородного фотосинтеза. Proc. Natl. Акад. Sci. США 98, 2170–2175. DOI: 10.1073 / pnas.061514798
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вентилятор, м., Li, M., Liu, Z., Cao, P., Pan, X., Zhang, H., et al. (2015). Кристаллические структуры белка PsbS, необходимые для фотозащиты растений. Nat. Struct. Мол. Биол. 22, 729–735. DOI: 10.1038 / nsmb.3068
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феррейра К. Н., Айверсон Т. М., Маглауи К., Барбер Дж. И Ивата С. (2004). Архитектура фотосинтетического центра выделения кислорода. Наука 303, 1831–1838. DOI: 10.1126 / наука.1093087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фромме П., Джордан П. и Краусс Н. (2001). Строение фотосистемы I. Биохим. Биофиз. Acta 1507, 5–31. DOI: 10.1016 / S0005-2728 (01) 00195-5
CrossRef Полный текст | Google Scholar
Гараб Г. (2016). Самосборка и структурно-функциональная гибкость кислородных фотосинтетических устройств: личные перспективы. Photosynth. Res. 127, 131–150. DOI: 10.1007 / s11120-015-0192-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Голбек, Дж. Х. (2006). Фотосистема I: управляемый светом пластоцианин: ферредоксин оксидоредуктаза . Дордрехт: Спрингер.
Google Scholar
Граболле М. и Дау Х. (2005). Энергетика первичного и вторичного переноса электронов в мембранных частицах шпината Фотосистемы II, пересмотренная на основе измерений рекомбинации-флуоресценции. Biochim. Биофиз.Acta 1708, 209–218. DOI: 10.1016 / j.bbabio.2005.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуськов А., Керн Дж., Габдулхаков А., Брозер М., Зуни А. и Зенгер В. (2009). Фотосистема II цианобактерий при разрешении 2,9 Å и роль хинонов, липидов, каналов и хлоридов. Nat. Struct. Мол. Биол. 16, 334–342. DOI: 10.1038 / nsmb.1559
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хольцварт, А.Р., Мюллер, М. Г., Реус, М., Новачик, М., Сандер, Дж., И Рёгнер, М. (2006). Кинетика и механизм переноса электрона в интактной фотосистеме II и в изолированном реакционном центре: феофитин является первичным акцептором электронов. Proc. Natl. Акад. Sci. США 103, 6895–6900. DOI: 10.1073 / pnas.0505371103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Надежда, А. Б. (2000). Переносы электронов между цитохромом f, пластоцианином и фотосистемой I: кинетика и механизмы. Biochim. Биофиз. Acta 1456, 5–26. DOI: 10.1016 / S0005-2728 (99) 00101-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джордан, П., Фромме, П., Витт, Х. Т., Клукас, О., Зенгер, В., и Краусс, Н. (2001). Трехмерная структура фотосистемы I цианобактерий с разрешением 2,5 Å. Природа 411, 909–917. DOI: 10.1038 / 35082000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камия Н. и Шен Дж.Р. (2003). Кристаллическая структура выделяющей кислород фотосистемы II из Thermosynechococcus vulcanus при разрешении 3,7 Å. Proc. Natl. Акад. Sci. США 100, 98–103. DOI: 10.1073 / pnas.0135651100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каваками К., Умена Ю., Камия Н. и Шен Дж. Р. (2009). Расположение хлорида и его возможные функции в выделяющей кислород фотосистеме II, выявленные с помощью рентгеновской кристаллографии. Proc. Natl. Акад.Sci. США 106, 8567. doi: 10.1073 / pnas.0812797106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Керн, Дж., Алонсо-Мори, Р., Тран, Р., Хаттне, Дж., Гилдеа, Р. Дж., Эчолс, Н., и др. (2013). Одновременная фемтосекундная рентгеновская спектроскопия и дифракция фотосистемы II при комнатной температуре. Наука 340, 491–495. DOI: 10.1126 / science.1234273
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Купиц, К., Басу, С., Grotjohann, I., Fromme, R., Zatsepin, N.A., Rendek, K. N., et al. (2014). Последовательная кристаллография фотосистемы II с временным разрешением с использованием фемтосекундного рентгеновского лазера. Природа 513, 261–265. DOI: 10.1038 / природа13453
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лабате, М. Т., Ко, К., Ко, З. В., Пинто, Л. С., Реал, М. Дж., Романо, М. Р. и др. (2004). Конститутивная экспрессия гороха Lhcb 1-2 в табаке влияет на развитие растений, морфологию и фотосинтетическую способность. Завод Мол. Биол. 55, 701–714. DOI: 10.1007 / s11103-004-1963-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю З., Ян, Х., Ван, К., Куанг, Т., Чжан, Дж., Гуй, Л. и др. (2004). Кристаллическая структура основного светособирающего комплекса шпината при разрешении 2,72 Å. Природа 428, 287–292. DOI: 10.1038 / nature02373
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лолл, Б., Керн, Дж., Сэнгер, В., Зуни, А., и Biesiadka, J. (2005). К полному расположению кофакторов в структуре разрешения 3,0 Å фотосистемы II. Природа 438, 1040–1044. DOI: 10.1038 / nature04224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мукерджи, С., Стулл, Дж. А., Яно, Дж., Стамататос, Т. К., Прингури, К., Стич, Т. А., и др. (2012). Синтетическая модель асимметричного [Mn3CaO4] кубанового ядра кислород-выделяющего комплекса фотосистемы II. Proc. Natl. Акад. Sci.США 109, 2257–2262. DOI: 10.1073 / pnas.11152
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мустарди, Л., Баттл, К., Стейнбах, Г., и Гараб, Г. (2008). Трехмерная сеть тилакоидных мембран у растений: квазигелическая модель сборки гранум-строма. Растительная клетка 20, 2552–2557. DOI: 10.1105 / tpc.108.059147
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нельсон, Н., Юнге, В.(2015). Структура и перенос энергии в фотосистемах кислородного фотосинтеза. Annu. Rev. Biochem. 84, 659–683. DOI: 10.1146 / annurev-biochem-092914-041942
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нилд, Дж., Орлова, Э. В., Моррис, Э. П., Гоуэн, Б., Ван Хил, М., и Барбер, Дж. (2000). Трехмерная карта суперкомплекса фотосистемы растений II, полученная методами криоэлектронной микроскопии и анализа одиночных частиц. Nat. Struct. Биол. 7, 44–47.DOI: 10.1038 / 71242
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пан, X., Ли, М., Ван, Т., Ван, Л., Цзя, К., Хоу, З. и др. (2011). Структурные представления о регулировании энергии светособирающего комплекса CP29 из шпината. Nat. Struct. Мол. Биол. 18, 309–315. DOI: 10.1038 / nsmb.2008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Питер, Г. Ф., и Торнбер, Дж. П. (1991). Биохимический состав и организация светособирающих пигмент-белков фотосистемы II высших растений. J. Biol. Chem. 266, 16745–16754.
PubMed Аннотация | Google Scholar
Цинь, X., Шуга, М., Куанг, Т., и Шен, Дж. Р. (2015). Фотосинтез. Структурные основы путей передачи энергии в суперкомплексе PSI-LHCI растений. Наука 348, 989–995. DOI: 10.1126 / science.aab0214
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ремелли Р., Варотто К., Сандона Д., Кроче Р. и Басси Р. (1999). Связывание хлорофилла с мономерным светособирающим комплексом.Анализ мутаций хромофор-связывающих остатков. J. Biol. Chem. 274, 33510–33521. DOI: 10.1074 / jbc.274.47.33510
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сантабарбара С., Галуппини Л. и Казацца А. П. (2010). Двунаправленный перенос электронов в реакционном центре фотосистемы I. J. Integr. Plant Biol. 52, 735–749. DOI: 10.1111 / j.1744-7909.2010.00977.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сетиф, П.(2001). Восстановление ферредоксина и флаводоксина фотосистемой I. Biochim. Биофиз. Acta 1507, 161–179. DOI: 10.1016 / S0005-2728 (01) 00205-5
CrossRef Полный текст | Google Scholar
Standfuss, J., Ac, T. V. S., Lamborghini, M., and Kühlbrandt, W. (2005). Механизмы фотозащиты и нефотохимического тушения в светособирающем комплексе гороха при разрешении 2,5 Å. EMBO J. 24, 919–928. DOI: 10.1038 / sj.emboj.7600585
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вс, Х., Ma, J., Wei, X., Cao, P., Zhu, D., Chang, W., et al. (2017). Строение и механизм сборки растительного суперкомплекса PSII-LHCII типа C2S2M2. Наука 357, 815–820. DOI: 10.1126 / science.aan0327
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шуга, М., Акита, Ф., Хирата, К., Уэно, Г., Мураками, Х., Накадзима, Ю. и др. (2015). Собственная структура фотосистемы II при разрешении 1,95 Å, видимая фемтосекундными импульсами рентгеновского излучения. Природа 517, 99–103.DOI: 10.1038 / природа13991
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шуга, М., Акита, Ф., Сугахара, М., Кубо, М., Накадзима, Ю., Накане, Т. и др. (2017). Индуцированные светом структурные изменения и место образования связи O = O в ФСII, захваченное XFEL. Природа 543, 131–135. DOI: 10.1038 / природа21400
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томиока, Н., Сагиура, М. (1983). Полная нуклеотидная последовательность гена рибосомной РНК 16S из сине-зеленой водоросли, Anacystis nidulans.Мол. Genet Genet. 191, 46–50. DOI: 10.1007 / BF00330888
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Умена Ю., Каваками К., Шен Дж. Р. и Камия Н. (2011). Кристаллическая структура фотосистемы II с выделением кислорода с разрешением 1,9 Å. Природа 473, 55–60. DOI: 10.1038 / nature09913
PubMed Аннотация | CrossRef Полный текст | Google Scholar
van Bezouwen, L. S., Caffarri, S., Kale, R. S., Kouřil, R., Thunnissen, A. W.Х., Остергетель, Г. Т. и др. (2017). Субъединичная и хлорофилльная организация суперкомплекса фотосистемы растений II. Nat. Растения 3: 17080. DOI: 10.1038 / nplants.2017.80
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wei, X., Su, X., Cao, P., Liu, X., Chang, W., Li, M., et al. (2016). Структура суперкомплекса фотосистемы шпината II-LHCII при разрешении 3,2 Å. Природа 534, 69–74. DOI: 10.1038 / природа18020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Дж., Ma, J., Liu, D., Qin, S., Sun, S., Zhao, J., et al. (2017). Строение фикобилисом красной водоросли Griffithsia pacifica. Природа 551, 57–63. DOI: 10.1038 / природа24278
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зуни, А., Витт, Х. Т., Керн, Дж., Фромм, П., Краусс, Н., Саенгер, В. и др. (2001). Кристаллическая структура фотосистемы II из Synechococcus elongatus при разрешении 3.8 Å. Природа 409, 739–743. DOI: 10.1038 / 35055589
PubMed Аннотация | CrossRef Полный текст | Google Scholar
PDB-101: Молекула месяца: Фотосистема I
Посмотрите вокруг.Практически везде, куда бы вы ни пошли, вы увидите что-то зеленое. Растения покрывают Землю, а их более мелкие собратья, водоросли и фотосинтезирующие бактерии, можно найти почти в каждом уголке. Повсюду они заняты преобразованием углекислого газа в сахар, создавая живые органические молекулы из воздуха, используя энергию солнечного света в качестве энергии. Этот процесс, называемый фотосинтезом, обеспечивает материальную основу, на которой держится вся жизнь.
Улавливание света
В центре фотосинтеза находится класс белков, называемых центрами фотосинтетических реакций.Эти белки захватывают отдельные фотоны света и используют их для производства сахара. Показанный здесь пример – фотосистема I (запись PDB 1jb0 ), один из двух крупных реакционных центров, используемых в цианобактериях, водорослях и растениях. Фотосистема I – это тримерный комплекс, образующий большой диск. В клетках комплекс плавает в мембране (мембрана обозначена двумя красными линиями на нижнем рисунке) с большими плоскими поверхностями, открытыми над и под мембраной.Цветные кофакторы
Каждая из трех субъединиц фотосистемы I представляет собой комплекс из дюжины белков, которые вместе поддерживают и позиционируют более сотни кофакторов.Некоторые из этих кофакторов, показанные здесь зеленым и оранжевым цветом, обнажены по краю комплекса, а многие другие погребены внутри. Кофакторы – это небольшие органические молекулы, которые используются для выполнения химических задач, которые выходят за рамки возможностей чистых белковых молекул. Кофакторы в фотосистеме I включают множество маленьких ярко окрашенных молекул, таких как ярко-зеленый хлорофилл и оранжевые каротиноиды. Фактически, цвета являются причиной того, что эти молекулы полезны: цвета указывают на то, что кофакторы сильно поглощают другие цвета.Например, хлорофилл поглощает синий и красный свет, оставляя нам красивый зеленый цвет. Затем энергия этих поглощенных цветов улавливается для фотосинтеза.
Цепь переноса электрона
Сердце фотосистемы I – это цепь переноса электрона, цепь хлорофилла (показана зеленым), филлохинон (показана оранжевым) и три кластера железо-сера (желтый и красный вверху). Эти кофакторы преобразуют энергию света в энергию, которую может использовать клетка. Две молекулы хлорофилла внизу улавливают свет первыми.Когда они это делают, электрон переходит в более высокое энергетическое состояние. Обычно этот электрон быстро распадается, выделяя тепло или новый фотон с немного меньшей энергией. Но прежде, чем это произойдет, фотосистема I передает этот электрон по цепочке кофакторов. Вверху электрон переносится на небольшой белок ферредоксин (здесь не показан), который затем переносит его на другие этапы фотосинтеза. Внизу отверстие, оставленное этим блуждающим электроном, заполнено электроном другого белка, пластоцианина.Это может показаться довольно обыденным, пока вы не увидите трюк, который выполняет фотосистема. Белки на обоих концах этого процесса, ферредоксин и пластоцианин, тщательно отбираются. Из-за особой конструкции их собственных кофакторов сложнее добавить электрон к ферредоксину, чем к пластоцианину – обычно поток будет в противоположном направлении. Но фотосистема I использует энергию света для возбуждения электрона, перемещая его в трудном направлении. Затем, поскольку электрон находится в таком энергетическом положении, его можно использовать для выполнения неблагоприятных задач, таких как производство сахара из углекислого газа.
Фотосинтезирующие кузены
Различные фотосинтезирующие организмы используют разные фотосистемы. Высшие растения, водоросли и некоторые бактерии имеют фотосистему I, показанную здесь, и вторую, называемую фотосистемой II. Фотосистема II использует воду вместо пластоцианина в качестве донора электронов, чтобы заполнить дыру, оставшуюся, когда заряженный электрон проходит вверх по цепочке. Когда фотосистема II захватывает электроны из молекулы воды, она расщепляет воду и выделяет газообразный кислород. Эта реакция является источником всего кислорода, которым мы дышим.Некоторые фотосинтезирующие бактерии содержат меньший фотосинтетический реакционный центр, такой как тот, который показан справа (запись PDB 1prc ). Как и в фотосистеме I, стопка хлорофилла и других кофакторов переносит заряженный светом электрон на энергичный переносчик электронов.Harvesting Light
Конечно, растения не полагаются на небольшую вероятность столкновения фотона с одной крошечной молекулой хлорофилла в центре реакционного центра. Как и все в жизни, клетки нашли еще лучший способ.Фотосистема I, показанная здесь сверху, содержит цепь переноса электронов, окрашенную здесь яркими цветами, в центре каждой из трех субъединиц. Каждый из них окружен плотным кольцом из молекул хлорофилла и каротиноидов, которые действуют как антенны. На этом изображении белок прозрачен, поэтому видны только кофакторы. Каждая из этих антенных молекул поглощает свет и передает энергию своим соседям. Быстро вся энергия направляется в три реакционных центра, где улавливается для создания активированных электронов.
Вы можете посмотреть на множество кофакторов фотосистемы I цепи переноса электрона и антенны в записи PDB 1jb0 . В файл включен только один из трех субъединиц, но вы обнаружите, что это достаточно сложно. Если вы отобразите только кофакторы, вы получите изображение, подобное показанному здесь. На этом рисунке показана цепочка переноса электронов в центре, нарисованная в сферах, заполняющих пространство. Две особые молекулы хлорофилла, остатки 1140 и 1239, также показаны сферами и окрашены в зеленый цвет.Эти две молекулы хлорофилла действуют как мост между реакционным центром в середине и множеством молекул в окружающей антенне. Многие антенные кофакторы показаны здесь в виде связей с небольшими сферами для ионов магния в центре каждого хлорофилла.Эта иллюстрация была создана с помощью RasMol. Вы можете создать похожие изображения, щелкнув указанный выше код доступа и выбрав один из вариантов для просмотра в 3D. Номера остатков для цепи переноса электрона составляют 1011-1013 и 1021-1023 для хлорофиллов, 2001-2002 гг. Для филлохинонов и 3001-3003 для кластеров серы железа.
Фотосистема I | Протокол
9.5: Фотосистема I
Обзор
Подобно Фотосистеме II (ФС II), Фотосистема I (ФС I) улавливает фотоны и переносит их через молекулы хлорофилла в реакционный центр. В PS I фотоны повторно возбуждают электроны, которые вошли в PS I из PS II. Из реакционного центра электрон высокой энергии отправляется через цепь переноса электронов и в конечном итоге соединяется с дополнительным электроном и протоном, чтобы восстановить NADP + в NADPH.Таким образом, подобно PS II, который улавливает энергию для генерации АТФ, PS I улавливает энергию для создания NADPH.
Фотосистема I
Пигменты светособирающего комплекса в Фотосистеме I поглощают фотоны и передают энергию реакционному центру (P700). После окисления электрон высокой энергии передается от специализированной пары хлорофилла а к первичному акцептору электронов. Однако на этот раз недостающие электроны из пары хлорофилла а заменяются электронами, движущимися из Фотосистемы II (вместо расщепления воды, как в ФС II).На своем пути от ФС II к ФС I электроны проходят через цепь переноса электронов, состоящую из молекулы-носителя пластохинона, двухбелкового цитохромного комплекса и пластоцианина.
После возбуждения электрона в реакционном центре ФС I он входит во вторую цепь переноса электронов – белковый комплекс ферредоксин. Затем один электрон соединяется с другим электроном и протоном (H + ), которые все принимаются редуктазой NADP + с образованием продукта NADPH.Таким образом, PS II захватывает энергию для создания протонного градиента, который в конечном итоге используется для производства АТФ, а энергия, захваченная в PSI, используется для производства NADPH.
Рекомендуемая литература
Кардона, Танай, Шэнси Шао и Питер Дж. Никсон. «Улучшение фотосинтеза у растений: световые реакции». Очерки биохимии 62, вып. 1 (13 апреля 2018 г.): 85–94. [Источник]
Две фотосистемы генерируют протонный градиент и НАДФН в кислородном фотосинтезе – биохимия
Фотосинтез организмов, выделяющих кислород, зависит от взаимодействия двух фотосистем, связанных общими промежуточными соединениями ().Эти две системы были открыты из-за небольших различий в длинах волн света, на которые они реагируют. Фотосистема I реагирует на свет с длинами волн короче 700 нм, тогда как фотосистема II реагирует на свет с длинами волн короче 680 нм. В нормальных условиях электроны проходят сначала через фотосистему II, затем через цитохром bf , мембраносвязанный комплекс, гомологичный оксидоредуктазе Q-цитохрома c от окислительного фосфорилирования (раздел 18.3.3), а затем через фотосистему I.Электроны происходят из воды: две молекулы H 2 O окисляются с образованием молекулы O 2 на каждые четыре электрона, проходящие через эту электронно-транспортную цепь. Электроны в конечном итоге восстанавливают NADP + до NADPH, универсального реагента для запуска биосинтетических процессов. Эти процессы генерируют градиент протонов через тилакоидную мембрану, который управляет образованием АТФ.
Рисунок 19.11
Две фотосистемы. Поглощение фотонов двумя отдельными фотоситемами (ФС I и ФС II) необходимо для полного потока электронов от воды к НАДФ + .
19.3.1. Фотосистема II переносит электроны из воды в пластохинон и генерирует протонный градиент
Фотосистема II зеленых растений достаточно похожа на бактериальный реакционный центр (). Ядро фотосистемы II образовано D1 и D2, парой подобных субъединиц 32 кДа, которые охватывают тилакоидную мембрану. Эти субъединицы гомологичны L- и M-цепям бактериального реакционного центра. В отличие от бактериальной системы, фотосистема II содержит большое количество дополнительных субъединиц, которые связывают дополнительные хлорофиллы и повышают эффективность поглощения и передачи световой энергии в реакционный центр (Раздел 19.5).
Рисунок 19.12
Структура фотосистемы II. Субъединицы D1 и D2 показаны красным и синим цветом, а структура связанной молекулы цитохрома показана желтым цветом. Молекулы хлорофилла показаны зеленым.
Общая реакция, катализируемая фотосистемой II:
, в которой Q представляет пластохинон, а QH 2 представляет пластохинол. Эта реакция аналогична реакции, катализируемой бактериальной системой, в которой хинон превращается из окисленной в восстановленную форму.Однако вместо того, чтобы получать электроны для этого восстановления из восстановленной молекулы цитохрома c , фотосистема II извлекает электроны из воды, генерируя молекулярный кислород. Эта замечательная реакция происходит в специальном центре, содержащем четыре иона марганца.
Фотохимия фотосистемы II начинается с возбуждения особой пары молекул хлорофилла, которые связаны субъединицами D1 и D2 (). Эта пара молекул аналогична специальной паре в бактериальном реакционном центре, но она поглощает свет с более короткими длинами волн (максимальное поглощение при 680 нм), поскольку состоит из молекул хлорофилла и , а не из бактериохлорофилла.Специальная пара часто называется P680 . При возбуждении P680 быстро передает электрон ближайшему феофитину (хлорофиллу с двумя ионами H + вместо центрального иона Mg 2+ ). Оттуда электрон сначала переносится на прочно связанный пластохинон в сайте Q A , а затем на заменяемый пластохинон в сайте Q B . Этот поток электронов полностью аналогичен потоку в бактериальной системе. С приходом второго электрона и поглощением двух протонов обмениваемый пластохинон восстанавливается до QH 2 .
Рисунок 19.13
Электронный поток через фотосистему II. Поглощение света вызывает перенос электронов от P680 по пути переноса электронов к заменяемому пластохинону. Положительный заряд на P680 нейтрализуется потоком электронов от молекул воды, связанных с (подробнее …)
Основное различие между бактериальной системой и фотосистемой II заключается в источнике электронов, которые используются для нейтрализации положительного заряда, образующегося на специальная пара. P680 + , очень сильный окислитель, извлекает электроны из молекул воды, связанных в марганцевом центре .Структура этого центра, который включает четыре иона марганца, ион кальция, ион хлорида и остаток тирозина, образующий радикал, полностью не установлена, хотя результаты обширных спектроскопических исследований и недавнего рентгеноструктурного исследования при умеренном разрешении предоставили множество ограничений. Марганец был, по-видимому, эволюционно выбран для этой роли из-за его способности существовать в нескольких степенях окисления (Mn 2+ , Mn 3+ , Mn 4+ , Mn 5+ ) и образовывать прочные связи с кислородом. -содержащие виды.Марганцевый центр в его восстановленной форме окисляет две молекулы воды с образованием одной молекулы кислорода. Каждый раз, когда поглощение фотона выбрасывает электрон из P680, положительно заряженная специальная пара извлекает электрон из центра марганца (). Таким образом, для извлечения электронов и восстановления марганцевого центра требуется четыре фотохимических шага (). Четыре электрона, собранные из воды, используются для восстановления двух молекул Q до QH 2 .
Рис. 19.14
Четыре фотона необходимы для образования одной молекулы кислорода.Когда адаптированные к темноте хлоропласты подвергаются кратковременной вспышке света, один электрон проходит через фотосистему II. Мониторинг O 2 , выпускаемого после каждой вспышки, показывает, что требуется четыре вспышки (подробнее …)
Рисунок 19.15
Правдоподобная схема выделения кислорода из марганцевого центра. Показана возможная частичная структура марганцевого центра. Центр окисляется, по одному электрону за раз, пока две связанные молекулы H 2 O не соединятся, образуя молекулу O 2 , которая (больше…)
Фотосистема II охватывает тилакоидную мембрану так, что сайт восстановления хинона находится на стороне стромы, тогда как центр марганца и, следовательно, сайт окисления воды находится в просвете тилакоида. Таким образом, два протона, которые поглощаются при восстановлении каждой молекулы пластохинона, исходят из стромы, а четыре протона, которые высвобождаются в процессе окисления воды, попадают в просвет. Такое распределение протонов создает градиент протонов через тилакоидную мембрану, характеризующийся избытком протонов в просвете тилакоида по сравнению со стромой ().Таким образом, направление протонного градиента противоположно направлению, возникающему при окислительном фосфорилировании, которое истощает митохондриальный матрикс протонов. Как мы увидим, это различие согласуется с обратной ориентацией других мембранных белков, включая АТФ-синтазу.
Рисунок 19.16
Направление протонного градиента. Фотосистема II выпускает протоны в просвет тилакоида и забирает их из стромы. Результатом является градиент pH через тилакоидную мембрану с избытком протонов (низкий pH) внутри.
19.3.2. Цитохром
bf связывает фотосистему II с фотосистемой IПластохинол (QH 2 ), продуцируемый фотосистемой II, передает свои электроны для продолжения электронной цепи, которая заканчивается в фотосистеме I. Эти электроны передаются пластоцианину по одному. (Pc), медный белок в просвете тилакоида.
Два протона пластохинола попадают в просвет тилакоида. Эта реакция напоминает реакцию, катализируемую убихинол цитохромом c оксидоредуктазой при окислительном фосфорилировании.Действительно, большинство компонентов ферментного комплекса, который катализирует реакцию, комплекса цитохрома bf, гомологичны компонентам убихинолцитохрома c оксидоредуктазы. Комплекс цитохрома bf включает четыре субъединицы: цитохром 23 кД с двумя гемами типа b , белок Fe-S типа 20 кДа, цитохром 33 кДа f с c – цитохрома типа и цепи 17 кДа.
Этот комплекс катализирует реакцию через цикл Q (Раздел 18.3.4). В первой половине Q-цикла пластохинол окисляется до пластохинона, по одному электрону за раз. Электроны пластохинола проходят через белок Fe-S, превращая окисленный пластоцианин в его восстановленную форму. Пластоцианин представляет собой небольшой растворимый белок с одним ионом меди, связанным остатком цистеина, двумя остатками гистидина и остатком метионина в искаженном тетраэдрическом расположении (). Эта геометрия облегчает взаимное превращение между состояниями Cu 2+ и Cu + и устанавливает потенциал восстановления на подходящее значение по сравнению с таковым пластохинола.Пластоцианин в окисленной форме имеет ярко-синий цвет, что указывает на его принадлежность к «синему медному белку» или семейству медных белков I типа.
Рисунок 19.17
Структура пластоцианина. Два остатка гистидина, остаток цистеина и остаток метионина координируют ион меди искаженным тетраэдрическим образом в этом белке, который переносит электроны от комплекса цитохрома bf к фотосистеме I.
Окисление пластохинола приводит к высвобождению двух протоны в просвет тилакоида.Во второй половине цикла Q (раздел 18.3.4) цитохром bf восстанавливает вторую молекулу пластохинона из пула Q до пластохинола, захватывая два протона с одной стороны мембраны, а затем повторно окисляет пластохинол, высвобождая их. протоны с другой стороны. Фермент ориентирован так, что протоны высвобождаются в просвет тилакоида и захватываются стромой, внося дополнительный вклад в протонный градиент через тилакоидную мембрану ().
Рисунок 19.18
Цитохром BF Вклад в протонный градиент.Комплекс цитохрома bf окисляет QH 2 до Q через Q-цикл. В каждом цикле в просвет тилакоида выделяются четыре протона.
19.3.3. Фотосистема I использует световую энергию для производства восстановленного ферредоксина, мощного восстановителя
Последняя стадия световых реакций катализируется фотосистемой I (). Ядром этой системы является пара схожих субъединиц psaA (83 кДа) и psaB (82 кДа). Эти субъединицы намного больше основных субъединиц фотосистемы II и бактериального реакционного центра.Тем не менее, они кажутся гомологичными; концевые 40% каждой субъединицы аналогичны соответствующей субъединице фотоситема II. Специальная пара молекул хлорофилла и находится в центре структуры и максимально поглощает свет на длине волны 700 нм. Этот центр, P700 , инициирует фотоиндуцированное разделение зарядов (). Электрон передается по пути через хлорофилл в сайте A 0 и хинон в сайте A 1 к набору кластеров 4Fe-4S. Оттуда электрон переносится на ферредоксин (Fd), растворимый белок, содержащий кластер 2Fe-2S, координированный с четырьмя остатками цистеина ().Положительный заряд P700 + нейтрализуется переносом электрона от восстановленного пластоцианина. Таким образом, вся реакция, катализируемая фотосистемой I, представляет собой простую одноэлектронную реакцию окисления-восстановления.
Рис. 19.19
Структура фотосистемы I. Субъединицы psaA и psaB показаны желтым, а области, аналогичные тем, что находятся в ядре фотоситемы II, показаны красным и синим. Молекулы хлорофилла показаны зеленым цветом и указаны три кластера 4Fe-4S.
Рис. 19.20
Электронный поток через фотосистему I к ферредоксину. Поглощение света вызывает перенос электронов от P700 по пути переноса электронов, который включает молекулу хлорофилла, молекулу хинона и три кластера 4Fe-4S для достижения ферредоксина. Положительный (подробнее …)
Рисунок 19.21
Структура ферредоксина. В растениях ферредоксин содержит кластер 2Fe-2S. Этот белок принимает электроны от фотосистемы I и переносит их на ферредоксин-НАДФ + редуктазу.
Учитывая, что потенциалы восстановления пластоцианина и ферредоксина составляют +0,37 В и -0,45 В соответственно, стандартная свободная энергия для окисления восстановленного пластоцианина окисленным ферредоксином составляет +18,9 ккал моль -1 (+79,1 кДж моль -1 ). Эта восходящая реакция вызвана поглощением фотона с длиной волны 700 нм, который имеет энергию 40,9 ккал · моль -1 (171 кДж · моль -1 ).
Сотрудничество между фотосистемой I и фотосистемой II создает поток электронов от H 2 O к NADP + .Путь потока электронов называется схемой Z фотосинтеза , потому что окислительно-восстановительная диаграмма от P680 до P700 * выглядит как буква Z ().
Рисунок 19.22
Путь электронного потока от H 2 O к NADP + в фотосинтезе. Эта эндергоническая реакция возможна благодаря поглощению света фотосистемой II (P680) и фотосистемой I (P700). Сокращения: Ph – феофитин; Q A и Q B , связывающие пластохинон белки; (более…)
19.3.4. Ферредоксин-НАДФ
+ Редуктаза превращает НАДФ + в НАДФНХотя восстановленный ферредоксин является сильным восстановителем, он не используется для запуска многих реакций, отчасти потому, что ферредоксин несет только один доступный электрон. Напротив, НАДФН, двухэлектронный восстановитель, широко используется в биосинтетических процессах, включая реакции цикла Кальвина (глава 20). Как можно использовать восстановленный ферредоксин для восстановления NADP + до NADPH? Эта реакция катализируется ферредоксин-НАДФ + редуктазой , флавопротеином ().Связанный фрагмент FAD в этом ферменте принимает электроны по одному от двух молекул восстановленного ферредоксина, переходя из его окисленной формы через промежуточное соединение семихинона в его полностью восстановленную форму (). Затем фермент переносит ион гидрида на NADP + с образованием NADPH. Обратите внимание, что эта реакция происходит на стромальной стороне мембраны. Следовательно, захват протона при восстановлении NADP + дополнительно способствует протонному градиенту через тилакоидную мембрану.
Рисунок 19.23
Структура и функция ферредоксин-НАДФ + редуктазы. (А) Структура ферредоксин-НАДФ + редуктазы. Этот фермент принимает электроны по одному от ферредоксина (показано оранжевым). (B) Ферредоксин-НАДФ + редуктаза сначала принимает один электрон от восстановленного (подробнее …)
Набор задач фотосинтеза 1Задача 11 Учебное пособие: Возможности Photosystem IIЧто из следующего НЕ верно для фотосистемы II?
Фотосистема II расположена в тилакоидных мембранах хлоропластов
Фотосистема II – место окисления водыКогда фотосистема II возбуждается поглощением фотона световой энергии и выталкивает электрон в фотосинтетическую цепь переноса электронов, временно создается окисленная форма молекулы хлорофилла в реакционном центре (Chl + ). Этот вид Chl + является очень сильным окислителем и способен принимать электроны от воды. Вода окисляется на внутренней стороне тилакоидной мембраны, отдавая электроны окисленному реакционному центру ФС II.Кислород высвобождается как побочный продукт окисления воды, а высвободившиеся протоны вносят вклад в градиент H + , используемый в качестве источника энергии для синтеза АТФ.Фотосистема II содержит особый окисляемый хлорофилл
Фотосистемы II и I имеют антенные комплексы для светособирающей деятельности
ФС II не участвует в циклическом фотофосфорилированииФотон световой энергии, поглощенный фотосистемой I, приводит к возбужденному состоянию пигмента P700 *, который подвергается окислению до P700 + . Электроны возвращаются из фотосистемы I через фотосинтетическую транспортную цепь обратно в реакционный центр, где P700 + восстанавливается до P700.Электронный транспорт приводит к образованию градиента pH, и вырабатывается АТФ. Никакого снижения NADP + не происходит; Не происходит окисления воды; Для этого нужна только фотосистема I – фотосистема II не нужна. Световая энергия, используемая для установления градиента pH, является источником хемиосмотической энергии для АТФ-синтазы хлоропластов. |
Светозависимые реакции | BioNinja
Понимание:
• Поглощение света фотосистемами генерирует возбужденные электроны
• Передача возбужденных электронов происходит между носителями в тилакоидных мембранах
Светозависимые реакции используют фотосинтетические пигменты (организованные в фотосистемы) для преобразования световой энергии в химическую энергию (в частности, АТФ и НАДФН)
Эти реакции происходят в специализированных мембранных дисках в хлоропласте, называемых тилакоидами , и включают три этапа:
- Возбуждение фотосистем световой энергией
- Производство АТФ через цепь переноса электронов
- Восстановление NADP + и фотолиз воды
Шаг 1: Возбуждение фотосистем световой энергией
- Фотосистемы представляют собой группы фотосинтетических пигментов (включая хлорофилл), встроенных в тилакоидную мембрану
- Фотосистемы классифицируются в соответствии с их максимальной длиной волны поглощения (PS I = 700 нм; PS II = 680 нм)
- Когда фотосистема поглощает световую энергию, делокализованные электроны внутри пигменты становятся энергичными или ‘ возбужденный ‘
- Эти возбужденные электроны передаются молекулам-носителям внутри тилакоидной мембраны
Понимание:
• Возбужденные электроны из Фотосистемы II используются для создания протонного градиента
• АТФ-синтаза в тилакоидах генерирует АТФ с использованием протонного градиента
Шаг 2: Производство АТФ через цепь переноса электронов
- Возбужденные электроны из Фотосистемы II (P680) переносятся в цепь переноса электронов внутри тилакоидной мембраны
- По мере того, как электроны проходят через цепь, они теряют энергию, которая используется для перемещения ионов H + в тилакоид
- Это накопление протонов внутри тилакоида создает электрохимический градиент или движущую силу протона
- Ионы H + возвращаются в строму (вдоль протонный градиент) через трансмембранный фермент АТФ-синтазу ( хемиосмос )
- АТФ-синтаза использует прохождение ионов H + для катализа синтеза АТФ (из АДФ + Pi)
- Этот процесс называется фотофосфорилированием – as свет обеспечил начальный источник энергии для производства АТФ
- Обесточенные электроны из Фотосистемы II забираются n вверх по Photosystem I
Понимание:
• Возбужденные электроны из Фотосистемы I используются для восстановления NADP
• Фотолиз воды генерирует электроны для использования в светозависимых реакциях
Шаг 3: Восстановление NADP + и фотолиз воды
- Возбужденные электроны из Фотосистемы I могут быть переданы молекуле-носителю и использованы для восстановления НАДФ +
- Это образует НАДФН, который необходим (вместе с АТФ) для светонезависимых реакций
- Электроны, потерянные из Фотосистемы I заменяются обесточенными электронами из Фотосистемы II
- Электроны, потерянные из Фотосистемы II, заменяются электронами, высвобождаемыми из воды в результате фотолиза
- Вода расщепляется световой энергией на ионы H + (используемые в хемиосмосе) и кислород (высвобождаемый как побочный продукт)
Обзор светозависимых реакций
- Светозависимые реакции происходят в межмембранном пространстве тилакоидов
- Хлорофилл в фотосистемах I и II поглощает свет, который вызывает высвобождение высокоэнергетических электронов (фотоактивация)
- Возбужден электроны из Фотосистемы II переносятся между молекулами-носителями в цепи переноса электронов
- Цепь переноса электронов перемещает ионы H + из стромы внутрь тилакоида, создавая протонный градиент
- Протоны возвращаются в строму через АТФ-синтазу , который использует их прохождение (через хемиосмос) для синтеза АТФ
- Возбужденные электроны из Фотосистемы I используются для восстановления НАДФ + (образуя НАДФН)
- Электроны, потерянные из Фотосистемы I, заменяются обесточенными электронами из Фотосистемы II.





 Минус — видимость для окружающих. Но современные тенденции моды говорят обратное: чем заметней и ярче, тем молодежнее и модней. Идеальный выбор для детей и подростков.
Минус — видимость для окружающих. Но современные тенденции моды говорят обратное: чем заметней и ярче, тем молодежнее и модней. Идеальный выбор для детей и подростков.
 Выполняются они из монокристаллического сапфира;
Выполняются они из монокристаллического сапфира; Они дают возможность быстро осуществлять замену дуги, а также значительно сокращают сроки выравнивания зубов и коррекции прикуса.
Они дают возможность быстро осуществлять замену дуги, а также значительно сокращают сроки выравнивания зубов и коррекции прикуса.




 Авиамоторная, 2-й Кабельный проезд, д. 1 По предзаказу на 17 июня, после 11:00 В корзину
Авиамоторная, 2-й Кабельный проезд, д. 1 По предзаказу на 17 июня, после 11:00 В корзину Ивантеевская, д. 25А По предзаказу на 17 июня, после 11:00 В корзину
Ивантеевская, д. 25А По предзаказу на 17 июня, после 11:00 В корзину Кантемировская, д. 47 По предзаказу на 17 июня, после 11:00 В корзину
Кантемировская, д. 47 По предзаказу на 17 июня, после 11:00 В корзину 17 По предзаказу на 17 июня, после 11:00 В корзину
17 По предзаказу на 17 июня, после 11:00 В корзину 26с32 По предзаказу на 17 июня, после 11:00 В корзину
26с32 По предзаказу на 17 июня, после 11:00 В корзину 48 корп.1 По предзаказу на 17 июня, после 14:00 В корзину
48 корп.1 По предзаказу на 17 июня, после 14:00 В корзину Свиблово (платформа Северянин), ул. Енисейская, д. 1, стр. 1 По предзаказу на 17 июня, после 11:00 В корзину
Свиблово (платформа Северянин), ул. Енисейская, д. 1, стр. 1 По предзаказу на 17 июня, после 11:00 В корзину Университет, Ломоносовский проспект, д. 5 По предзаказу на 17 июня, после 11:00 В корзину
Университет, Ломоносовский проспект, д. 5 По предзаказу на 17 июня, после 11:00 В корзину Дмитров, пер. Вокзальный, д. 7 По предзаказу на 17 июня, после 11:00 В корзину
Дмитров, пер. Вокзальный, д. 7 По предзаказу на 17 июня, после 11:00 В корзину Звенигород, ул. Московская, д. 24 По предзаказу на 17 июня, после 11:00 В корзину
Звенигород, ул. Московская, д. 24 По предзаказу на 17 июня, после 11:00 В корзину Коломна, ул. Октябрьской революции, д. 368 По предзаказу на 17 июня, после 11:00 В корзину
Коломна, ул. Октябрьской революции, д. 368 По предзаказу на 17 июня, после 11:00 В корзину Люберцы, ул. Инициативная, д. 7с2 По предзаказу на 17 июня, после 11:00 В корзину
Люберцы, ул. Инициативная, д. 7с2 По предзаказу на 17 июня, после 11:00 В корзину 139А По предзаказу на 17 июня, после 11:00 В корзину
139А По предзаказу на 17 июня, после 11:00 В корзину Сергиев Посад, Новоугличское шоссе, д. 58Б По предзаказу на 17 июня, после 11:00 В корзину
Сергиев Посад, Новоугличское шоссе, д. 58Б По предзаказу на 17 июня, после 11:00 В корзину 20 По предзаказу на 17 июня, после 11:00 В корзину
20 По предзаказу на 17 июня, после 11:00 В корзину