Привет, это мы — индикаторы
В статье рассмотрены несколько видов индикаторов: лабораторные и природные. Существуют универсальные индикаторы, которые являются смесью растворов, нанесённые на полоски бумаги, выпускающиеся со специальной рН-шкалой на упаковках. Помимо них есть кислотно-основные, который находятся в лаборатории в виде растворов: лакмус, фенолфталеин, метиловый оранжевый. Следующий вид — природные индикаторы, которые мы можем найти на нашей кухне. Благодаря таким индикаторам также можно определить кислотность или щёлочность растворов в бытовых условиях.
Ключевые слова: опыт Бойля, индикаторы, универсальные индикаторы, природные индикаторы, сок краснокочанной капусты, сок свеклы, моющие средства, pH-среды.
Английский ученый Роберт Бойль впервые обнаружил индикаторы в XVII веке. Однажды, во время проведения эксперимента, садовник принёс ему фиалки, но в связи с тем, что Бойль был занят, их пришлось оставить на столе.
Повторяя эксперимент Роберта Бойля, был проведен опыт на фиалках. Выявлено, что в кислой среде фиалка краснеет, а в щелочной желтеет. Этот опыт характерен для любых видов фиалок. В ходе проведения исследовательской работы было установлено, что отвар цветков декабриста также меняет свой цвет в зависимости от среды раствора. В нейтральной среде — розовый, в кислой — красный, а в щелочной — желтый.
Индикаторы — это вещества, изменяющие свою окраску в зависимости от среды раствора. В переводе с латинского слово «индикатор» означает «указатель». По природе происхождения индикаторы можно поделить на природные и лабораторные. Последние имеют различные классификации.

Помимо лабораторных индикаторов существуют те, которые хранятся у нас дома. Такие индикаторы получили название «природные». Они находятся вокруг нас, только мы обычно не задумываемся об этом. Существует ещё один лёгкий опыт, с которым каждый мог столкнуться в повседневной жизни. Взяв немного сока вишни, смородины, ежевики, малины можно добавить обычной питьевой воды. Тогда сок станет синим. Возьмём полученный раствор сока, если в него капнуть уксусной или лимонной кислоты, то вернётся вновь темно-красная окраска. Если в стакан с крепким чаем мы капаем лимонный сок или же растворяем пару кристалликов лимонной кислоты, то он светлеет. Если в чай добавить раствор соды, то он темнеет. Можно сказать, что пигменты многих растений способы менять свой цвет, в зависимости от клеточного сока.
Одним из природных индикаторов, который был взят на изучение, стала краснокочанная капуста. Веществом, благодаря которому капуста меняет свою окраску является антоциан. Было выявлено, что сок краснокочанной капусты в нейтральной среде фиолетовый, в кислой — красной, а в щелочной — зеленый.
В связи с тем, что краснокочанная капуста хорошо меняет свой цвет в зависимости от кислотности раствора, экспериментально получена шкала pH для краснокочанной капусты (рис. 1).
Рис. 1. Шкала pH для краснокочанной капусты.Индикатором может стать самый обычный борщ, который готовят наши мамы и бабушки. С давних времён было замечено свойство, которое по сей день используют хозяйки на своих кухнях. Для сохранения ярко-красного цвета борща в него добавляют немного уксусной или лимонной кислоты, цвет меняется сразу на глазах. В щёлочи свёкла желтая, а в кислоте — красная. Лабораторный эксперимент это также подтвердил.
Для проведения экспериментов по определению кислотности среды моющих средств, были приготовлены растворы индикаторов (сок краснокочанной капусты и свеклы), также использовался универсальный индикатор. Выявлено, что кондиционер для белья (Vernel, Lenor) имеет pH среду равную 7 (нейтральную). Сок краснокочанная капусты и свёклы подтвердил, что среда нейтральная.
Средства для мытья посуды имеют слабощелочную среду, так как они должны быть щадящими для кожи человека. Были исследованы Fairy, Fairy (нежные руки), Aos, Sorti. С помощью универсального индикатора выявлено, что pH раствора равна 8, природные индикаторы подтвердили, что среда слабощелочная.
Изучена pH среды порошков для стирки. В качестве выбранного объекта был порошок Tide. Установлено, что в Tide pH среды равна 12, т. е. сильнощелочная. Аналогичные природные индикаторы также показали сильнощелочную среду, это объясняется тем, что в порошке содержится много веществ, направленных на удаление загрязнений с одежды.
В гелях для стирки (Ласка для белого белья, Ласка для черного белья, Persil для цветной одежды, Persil для белого белья) pH равны 7 и 8. Это нейтральная и слабощелочная среды, которые появляются из-за большого количества синтетических веществ. Природные индикаторы также подтвердили, что среды нейтральная и слабощелочная.
Исследованы моющие средства для сантехники, раковин и ванн. С помощью универсального индикатора было выявлено, что моющее средство Санокс имеет pН равное 0, т. к. его основное предназначение — это очистка сантехники, у Cillit bang и Пемолюкс pH равно 11 и 12 соответственно, т. к. они созданы для отчистки кафельных поверхностей. Природные индикаторы показывают кислую и щелочную среду.
С помощью универсального индикатора было выявлено, что моющее средство Санокс имеет pН равное 0, т. к. его основное предназначение — это очистка сантехники, у Cillit bang и Пемолюкс pH равно 11 и 12 соответственно, т. к. они созданы для отчистки кафельных поверхностей. Природные индикаторы показывают кислую и щелочную среду.
После проведения эксперимента со средствами для сантехники, была изучена pH-среды средства для мытья пола Mr. Propper. Выяснено, что его pH равно 10, потому что оно предназначен для расщепления грязи. В исследовательской работе было рассмотрено три вида мыла: жидкое, твердое и мыло ручной работы. Было выяснено, что мыло “365 дней» имеет pH равное 6, так как предназначено для удаления слабых загрязнений. Мыло «Сamay» имеет pH равное 8 и может использоваться для удаления органических и жировых загрязнений слабой и средней степени с области рук. Мыло ручной работы с медвежьим жиром имеет pH равное 12 и создано для удаления стойких жировых загрязнений. Выбранные природные также подтвердили pH-среды.
Природные индикаторы работают также, как и лабораторные: лакмус, фенолфталеин, метиловый оранжевый. Они имеют способность определять среду раствора. У растений, способных менять свой цвет, в зависимости от среды раствора, есть природный индикатор — антоциан (вещество отвечает за окраску в овощах и фруктах). Природные индикаторы имеют большой минус — недолговечность. Спустя время они скисают и плесневеют.
Литература:
- Вайткене Л. Д. Химия [Текст] / Л. Д. Вайткене. — М.: Издательство АСТ, 2018. — 160 с.: ил.
- Вайткене Л. Д., Филиппова М. Д. Наглядная химия [Текст] / Л. Д. Вайткене, М. Д. Филиппова. — М.: Издательство АСТ, 2018. — 128 с.: ил.
- Спектор А. А. Химия. — А. А. Спектор– М.: Издательство АСТ, 2017. — 160 с.: ил.
- Габриелян О. С. Химия. 8 класс: учебник [Текст] / О. С. Габриелян. — М.: Дрофа, 2014. — 287 с.: ил.
Основные термины (генерируются автоматически): краснокочанная капуста, индикатор, среда раствора, кислая среда, лимонная кислота, нейтральная среда, универсальный индикатор, белое белье, исследовательская работа, ручная работа.
Химические индикаторы уровня рН
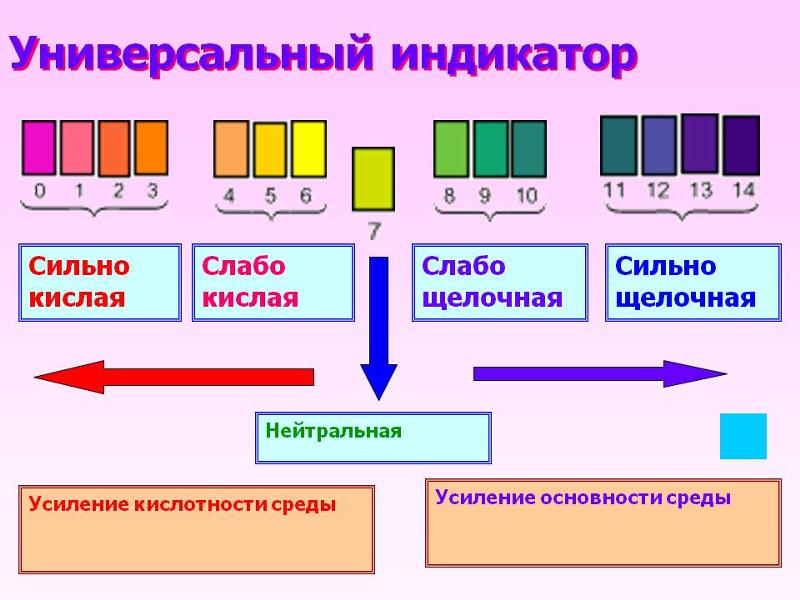
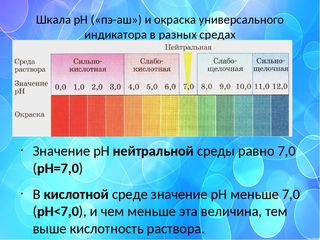
Уровень кислотности среды принято измерять по условной шкале от 0 (очень кислая среда) до 14 (очень щелочная среда). Нейтральным считается показатель, равный 7 — это рН чистой воды.
Величина рН показывает уровень кислотности среды. Введена эта характеристика была в самом начале XIX века для обозначения активности ионов водорода в растворе. Концентрация ионов измеряется в моль²/л² и выражается числами порядка 10-1… 10-14. Для удобства новую характеристику стали представлять через формулу
рН = – lg(H+), т.е. уровень кислотности среды — это степень (без знака) числа, выражающего концентрацию ионов водорода.
Знание уровня кислотности среды требуется во многих областях, в частности:
- рН воды проверяют в бассейнах, аквариумах, при водоподготовке, для приготовления растворов с заданными свойствами (например, красителей для бумаги или ткани, инъекционных препаратов).
- Многие пищевые продукты на предприятиях пищепрома тестируются на уровень кислотности.

- В сельском хозяйстве прежде, чем решить, какие культуры выращивать, проводится анализ кислотности почвы, так как для разных растений оптимально подходит почва с разной кислотностью. рН почвы необходимо регулировать в комнатном цветоводстве и тепличных хозяйствах.
- Уровень рН — важный показатель для косметических продуктов: кремов, лосьонов, шампуней, мыла и т.п. Мы обязательно расскажем об этом подробно в следующей статье.
- Кислотность среды проверяют в аналитической химии, фармацевтике, микробиологии, биохимии, химпроме, производстве удобрений, кормовых добавок, нефтепродуктов, топлив и др.
Методы определения
Для определения уровня кислотности среды существует три основных способа — с помощью:
- химических индикаторов;
- электронных рН-метров;
- аналитических методов.
Каждый из этих способов имеет свои достоинства и недостатки. Аналитический метод самый сложный в исполнении, но зато и самый точный. Для его проведения нужна лаборатория и соответствующее оборудование. Нужно выполнить титрование, а потом вычислить рН на основании известной концентрации исследуемого раствора и объема использованного титранта.
Нужно выполнить титрование, а потом вычислить рН на основании известной концентрации исследуемого раствора и объема использованного титранта.
Электронные рН-метры очень точные, могут применяться в полевых условиях, но относительно дороги и требуют регулярной калибровки. Кроме того, они требуют бережного обращения и точного следования инструкции.
Использование химических индикаторов не требует серьезной профессиональной подготовки; может применяться как в лабораториях, так и на выезде. Однако точность этого способа самая низкая, к тому же зависит от субъективной оценки исследователя. Еще один недостаток: невозможность работы с сильными кислотами и щелочами. Но метод очень прост, дешев и, в большинстве случаев, его точности достаточно. Именно поэтому он — самый популярный как у химиков, так и у специалистов других областей.
На нашем сайте можно купить множество химических индикаторов, «работающих» в разных интервалах кислотности. Вот несколько из них:
| Ксиленоловый оранжевый | Тимоловый синий | Бумага фенолфталеиновая белая |
Химические индикаторы
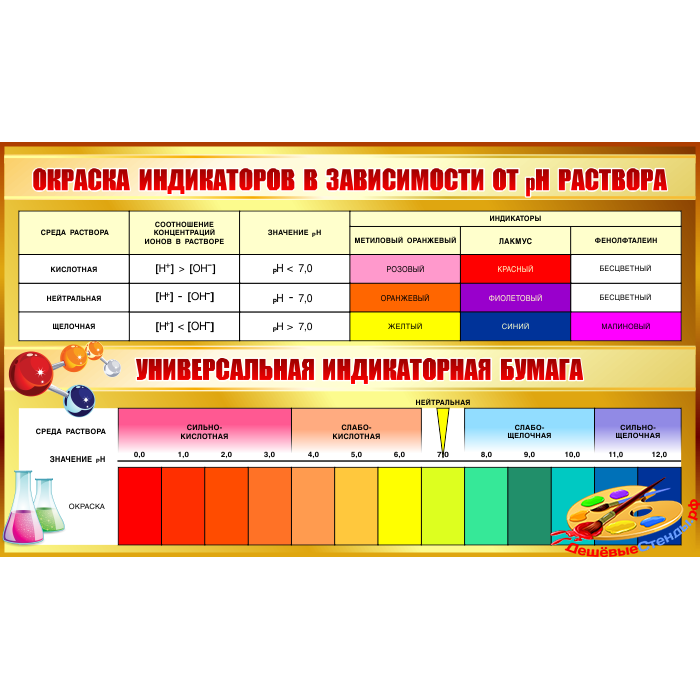
В качестве химических индикаторов уровня рН среды применяются органические вещества, меняющие окраску в зависимости от кислотности. Такие вещества называются кислотно-основными индикаторами. Это могут быть водные или спиртовые растворы; реактивы в виде порошка; полоски бумаги, пропитанные индикатором и высушенные; полоски полимерной пленки с нанесенным на нее индикатором. Проще всего пользоваться индикаторной бумагой. Она выпускается с таблицей (шкалой) эталонных цветов, соответствующих кислотности раствора или с напечатанными значениями уровня рН. Бумага может быть выполнена в виде полосок, рулонов, книжечек и т.п.
Такие вещества называются кислотно-основными индикаторами. Это могут быть водные или спиртовые растворы; реактивы в виде порошка; полоски бумаги, пропитанные индикатором и высушенные; полоски полимерной пленки с нанесенным на нее индикатором. Проще всего пользоваться индикаторной бумагой. Она выпускается с таблицей (шкалой) эталонных цветов, соответствующих кислотности раствора или с напечатанными значениями уровня рН. Бумага может быть выполнена в виде полосок, рулонов, книжечек и т.п.
Большинство индикаторов имеют одну-две, иногда три точки перехода цвета и применяются в относительно узком диапазоне значений кислотности. Для измерений в широком интервале используются полоски, пропитанные смесью индикаторов. Например, выпускается «универсальный индикатор», определяющий рН от 0 до 10.
Самым известным индикатором является лакмус и лакмусовая бумага. Этому индикатору несколько сотен лет, в кислой среде он окрашивает раствор в разные оттенки красного; в щелочной — в оттенки синего разной интенсивности. В нейтральной среде раствор фиолетовый.
В нейтральной среде раствор фиолетовый.
Пользоваться химическими индикаторами просто. В исследуемый раствор добавляется несколько капель индикатора или в растворе смачивается тест-полоска. Сравнивая полученный цвет с эталонной цветовой схемой, судят об уровне кислотности среды.
Универсальный индикатор
- Дом
- Буферы и вода
- Буферы
- Универсальный индикатор
Продукт#: HM-I013
22,88 доллара США
Размер
– Пожалуйста, выберите вариант. -100мл500мл
Наличие:
Доставка через 4-6 недель
Поделись этим:
- Описание
- Отзывы (0)
- Руководство
- MSDS
*СРОК ДОСТАВКИ 4-6 НЕДЕЛЬ
Универсальный индикатор
Кат. I013_100 мл, I013_500 мл
Использование по назначению:
Универсальный индикатор используется в качестве индикатора рН в широком диапазоне от 4 до 14. С его помощью определяют рН различных растворов, веществ.
С его помощью определяют рН различных растворов, веществ.
Ингредиенты
| Тимоловый синий | 0,026 г |
| Метиловый красный | 0,060 г |
| Бромтимоловый синий | 0,30 г |
| Фенолфталеин | 0,50 г |
| Этанол | 500 мл |
Примечание: добавляйте разбавленный NaOH до тех пор, пока раствор не станет зеленым (нейтральный pH).
Используйте 0,2 мл индикатора на каждые 10 мл исследуемой жидкости.
Универсальный индикатор представляет собой смесь красителей, постепенно меняющих цвет в диапазоне рН от 4 до 14. Цвет используется для прямого указания pH (1). Основными компонентами универсального индикатора в виде раствора являются тимоловый синий, метиловый красный, бромтимоловый синий и фенолфталеин. Эта смесь важна, потому что каждый компонент теряет или приобретает электроны в зависимости от кислотности или щелочности тестируемого раствора. Этот тип универсального индикатора выгодно использовать в бесцветном растворе. Это повысит точность индикации (2). Индикатор используется для определения кислотности или щелочности различных веществ, таких как почва, сточные воды, шлам, продукты питания и т. д. Растворы и жидкости, такие как вода, сточные воды и т. д. Универсальный индикатор используется больше, чем другие индикаторы, потому что он имеет широкий диапазон Результаты.
Цвет используется для прямого указания pH (1). Основными компонентами универсального индикатора в виде раствора являются тимоловый синий, метиловый красный, бромтимоловый синий и фенолфталеин. Эта смесь важна, потому что каждый компонент теряет или приобретает электроны в зависимости от кислотности или щелочности тестируемого раствора. Этот тип универсального индикатора выгодно использовать в бесцветном растворе. Это повысит точность индикации (2). Индикатор используется для определения кислотности или щелочности различных веществ, таких как почва, сточные воды, шлам, продукты питания и т. д. Растворы и жидкости, такие как вода, сточные воды и т. д. Универсальный индикатор используется больше, чем другие индикаторы, потому что он имеет широкий диапазон Результаты.
Только для диагностики in vitro . Прочтите этикетку, прежде чем открывать контейнер. Носите защитные перчатки/защитную одежду/защиту глаз/защиту лица.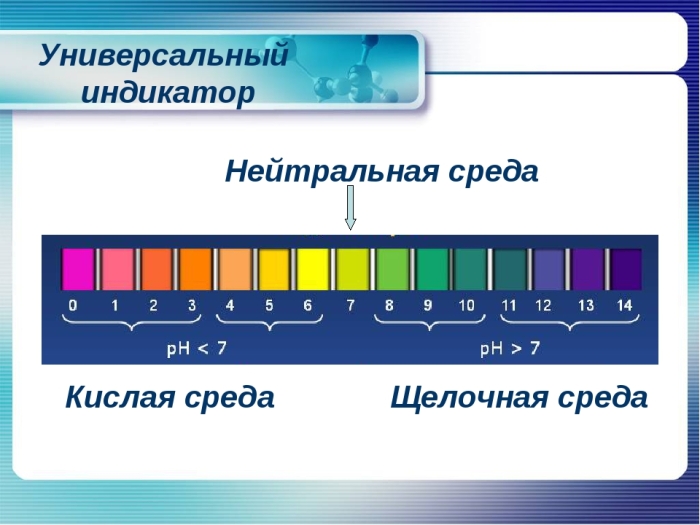 При работе с образцами и посевами соблюдайте правила микробиологической лаборатории. При работе с клиническими образцами следует соблюдать стандартные меры предосторожности в соответствии с установленными рекомендациями. Рекомендации по безопасности могут быть указаны в отдельных паспортах безопасности.
При работе с образцами и посевами соблюдайте правила микробиологической лаборатории. При работе с клиническими образцами следует соблюдать стандартные меры предосторожности в соответствии с установленными рекомендациями. Рекомендации по безопасности могут быть указаны в отдельных паспортах безопасности.
Характеристики продукта ожидаются при использовании в соответствии с указаниями на этикетке в течение срока годности при хранении при рекомендованной температуре
Контроль качества Внешний видРаствор зеленовато-коричневого цвета.
Ясность
Прозрачный, без каких-либо частиц.
Тест
Добавьте 0,2 мл индикатора в 10 мл жидкости с другим диапазоном pH и наблюдайте за изменением цвета в соответствии со стандартной таблицей.
Результаты
При различных уровнях pH видны разные цвета, которые сравниваются со стандартной индикаторной диаграммой.
Хранить при температуре от 10 до 30°C в плотно закрытой таре и вдали от яркого света. Использовать до истечения срока годности, указанного на этикетке. После вскрытия продукт следует правильно хранить в сухом проветриваемом помещении, защищенном от экстремальных температур и источников воспламенения. Плотно закройте контейнер после использования.
Пользователь должен обеспечить безопасную утилизацию путем автоклавирования и/или сжигания использованных или непригодных препаратов этого продукта. Следуйте установленным лабораторным процедурам при утилизации инфекционных материалов, а материал, который вступает в контакт с клиническим образцом, должен быть обеззаражен и утилизирован в соответствии с действующими лабораторными методами (3,4).
1. Яп. Пат. 99 664, 21 февраля 1933 г.
2. Реагенты и ресурсы Химия Инфолаб; Приготовление индикаторов титрования; Дханал Де Ллойд, химический отдел утилизации
3. Изенберг, Х.Д. Справочник по процедурам клинической микробиологии. 2-е издание.
Изенберг, Х.Д. Справочник по процедурам клинической микробиологии. 2-е издание.
4. Йоргенсен Дж.Х., Пфаллер М.А., Кэрролл К.С., Функе Г., Ландри М.Л., Рихтер С.С. и Варнок Д.В. (2015) Руководство
Удовлетворение
Предмет
Что такое универсальный индикатор?
Кислоты представляют собой соединения, которые при растворении в воде образуют свободные ионы водорода (ионы Н+). Когда основания растворяются в воде, они образуют гидроксильные ионы (ОН-ионы). Ионов водорода много в кислых растворах и мало в щелочных растворах. Шкала рН используется для определения кислотности или щелочности кислоты или основания. Шкала рН колеблется от 0 до 14 по шкале. Индикатор pH, состоящий из нескольких химических соединений, известен как универсальный индикатор.
Когда основания растворяются в воде, они образуют гидроксильные ионы (ОН-ионы). Ионов водорода много в кислых растворах и мало в щелочных растворах. Шкала рН используется для определения кислотности или щелочности кислоты или основания. Шкала рН колеблется от 0 до 14 по шкале. Индикатор pH, состоящий из нескольких химических соединений, известен как универсальный индикатор.
pH для кислот
pH кислот или кислых растворов меньше 7. Раствор с pH меньше 7 считается кислым. Например, pH 4 указывает на то, что раствор кислый. Следует помнить, что чем ниже рН раствора, тем он более кислый. Например, раствор с рН 1 значительно более кислый, чем раствор с рН 4. Другими словами, раствор с pH 1 является значительно более сильной кислотой, чем раствор с pH 4. Сильные кислоты часто определяют как растворы с рН 0, 1, 2 или 3. Растворы слабых кислот имеют рН 4, 5 или 6. Очевидно, что кислотность вещества пропорциональна его рН. pH сильнокислотных химикатов довольно низок. На самом деле, чем сильнее кислота, тем ниже pH.
Поскольку все растворы с рН менее 7 являются кислыми по своей природе, лакмус окрашивается в красный цвет. Кроме того, они вызывают окрашивание индикатора метилового оранжевого в красный цвет.
pH для оснований
pH оснований или щелочных растворов больше 7. Когда раствор имеет pH больше 7, он называется щелочным раствором. Раствор с pH 12, например, будет основным по своей природе или основанием. Следует помнить, что чем выше рН раствора, тем он более щелочной. Раствор с pH 14, например, значительно более щелочной, чем раствор с pH 11. Другими словами, раствор с pH 14 будет гораздо более сильным основанием, чем кислота с pH 11. Сильные основания часто определяются как растворы с pH 11, 12, 13 или 14. Слабые основания определяются как растворы со значениями pH 8, 9., и 10. pH очень основных соединений чрезвычайно высок. На самом деле, чем сильнее основание, тем выше рН.
Поскольку все растворы с рН выше 7 являются щелочными по своей природе, лакмус окрашивается в красный цвет в синий цвет.
Кроме того, они окрашивают индикатор фенолфталеина в розовый цвет.
pH для нейтральных веществ
pH нейтральных веществ ровно 7. Чистая вода не является ни кислой, ни щелочной; это нейтральное вещество. В результате чистая вода имеет pH 7. Раствор сахара и раствор хлорида оба нейтральны, с pH 7. В результате любой раствор с pH 7 считается нейтральным. Лакмусовая бумага, а также другие распространенные индикаторы, такие как метиловый оранжевый и фенолфталеин, не окажут влияния на материал с рН 7.
Универсальный индикатор
Лакмус — это обычный индикатор для определения того, является ли химическое вещество кислотой или основанием. Они не могут определить, является ли химическое вещество сильной кислотой, слабой кислотой, сильным основанием или слабым основанием. Другими словами, типичные индикаторы не могут сказать нам, насколько сильными являются кислоты или основания. Лакмус, например, может определить, что и серная кислота, и уксус являются кислыми, но он не может определить, является ли серная кислота более сильной кислотой или более кислой, чем раствор уксуса. Однако мы можем использовать особую форму индикатора, называемую «универсальным индикатором», которая работает путем определения pH раствора, чтобы определить силу кислотного или щелочного раствора.
Однако мы можем использовать особую форму индикатора, называемую «универсальным индикатором», которая работает путем определения pH раствора, чтобы определить силу кислотного или щелочного раствора.
Универсальный индикатор – распространенный метод измерения pH раствора в школьной лаборатории. Универсальный индикатор представляет собой смесь нескольких различных индикаторов или красителей, дающих различные цвета при различных уровнях рН по шкале рН.
Можно также отметить, что универсальный индикатор показывает разные цвета при различной концентрации ионов водорода в растворе, так как рН раствора зависит от концентрации ионов водорода. Универсальный индикатор приобретает новый цвет, когда на него наносят кислотный или щелочной раствор. Сравнивая цвет универсального индикатора с цветами на цветовой диаграмме pH, можно определить значение pH раствора кислоты или основания. Мы можем сказать, является ли раствор сильной кислотой, слабой кислотой, сильным основанием или слабым основанием, глядя на значение pH.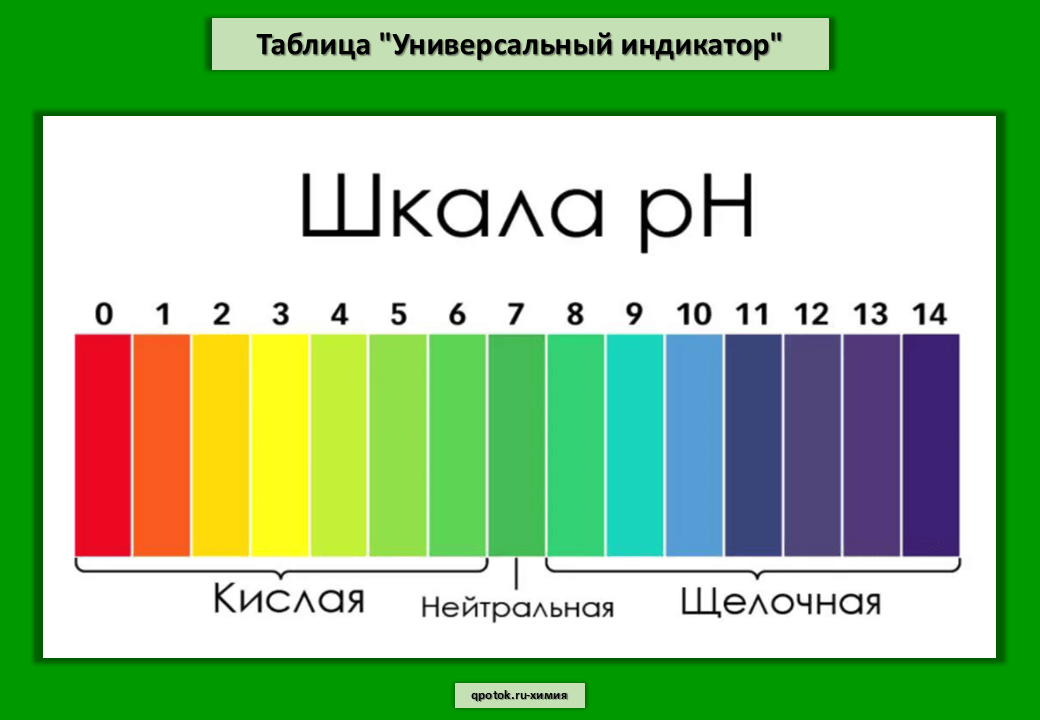 Цвета, которые дает универсальный индикатор при различных уровнях pH, показаны ниже.
Цвета, которые дает универсальный индикатор при различных уровнях pH, показаны ниже.
| pH | Цвет |
| 0 | Темно-красный 90 069 |
| 1 | Красный |
| 2 | Красный |
| 3 | Оранжево-красный |
| 4 | Оранжевый |
| 5 | Оранжево-желтый |
| 6 | Зеленовато-желтый |
| 7 | Зеленый |
| 8 | 900 68 Зеленовато-синий|
| 9 | Синий |
| 10 | Темно-синий |
| 11 | Фиолетовый |
| 12 | Темно-фиолетовый |
| 9004 0 13 | Фиолетовый |
| 14 | Фиолетовый |
Производители универсальных индикаторов предоставляют цветовую диаграмму рН, которую можно использовать для сравнения цвета индикаторной бумаги или раствора индикатора после добавления раствора кислоты или основания для определения значения рН. Универсальный индикатор, как и лакмус, может применяться в виде раствора или в виде универсальной индикаторной бумаги.
Универсальный индикатор, как и лакмус, может применяться в виде раствора или в виде универсальной индикаторной бумаги.
Как универсальная индикаторная бумага используется для измерения значения pH раствора?
На полоску универсальной индикаторной бумаги наносят каплю испытуемого раствора. Цвет индикаторной бумаги изменится в месте нанесения раствора. Затем цвет на индикаторной бумаге сравнивают с цветом на стандартной цветовой диаграмме рН. Значение pH, соответствующее этому цвету, можно найти на цветовой диаграмме pH. Мы можем сказать, является ли раствор сильной кислотой, слабой кислотой, сильным основанием или слабым основанием, исходя из его значения pH.
Если каплю раствора нанести на универсальную индикаторную бумагу, и бумага станет темно-красной, pH раствора близок к нулю, что указывает на то, что это сильная кислота. Однако, если образуется оранжевый цвет, pH будет около 4, а кислота будет слабой. Различные цвета также могут быть созданы с использованием другого базового раствора.
Слабоосновные растворы окрашены в синий цвет, а чрезвычайно основные — в фиолетовый с универсальным индикатором. Если раствор окрашивается в зеленый цвет универсального индикатора, это нейтральный раствор, который не является ни кислотным, ни щелочным. В результате вода приобретет зеленый цвет при проверке универсальным индикатором.
Примеры вопросов
Вопрос 1: Синий лакмус окрашивается раствором в красный цвет. Каким будет рН раствора?
Ответ:
Раствор, изменяющий цвет лакмуса синего цвета на красный, является кислым. Кислые растворы – это те, у которых pH меньше 7. В результате pH раствора будет меньше 7.
Вопрос 2: pH парного молока равен 6. Каков pH молока при его переработке? в творог?
Ответ:
Когда молоко превращается в творог, оно становится кислым, и его рН падает ниже 6. раствор представляет собой сильную или слабую кислоту?
Ответ:
pH 1 означает очень кислый раствор.

 Кроме того, они окрашивают индикатор фенолфталеина в розовый цвет.
Кроме того, они окрашивают индикатор фенолфталеина в розовый цвет. Слабоосновные растворы окрашены в синий цвет, а чрезвычайно основные — в фиолетовый с универсальным индикатором. Если раствор окрашивается в зеленый цвет универсального индикатора, это нейтральный раствор, который не является ни кислотным, ни щелочным. В результате вода приобретет зеленый цвет при проверке универсальным индикатором.
Слабоосновные растворы окрашены в синий цвет, а чрезвычайно основные — в фиолетовый с универсальным индикатором. Если раствор окрашивается в зеленый цвет универсального индикатора, это нейтральный раствор, который не является ни кислотным, ни щелочным. В результате вода приобретет зеленый цвет при проверке универсальным индикатором.