Паспорт ВМ127 Станок специализированный фрезерный консольный (Воткинск)
Наименование издания: Руководство по эксплуатации (ВМ127.00.00.000РЭ)
Выпуск издания: Воткинский машиностроительный завод
Год выпуска издания: 1985
Кол-во книг (папок): 1
Кол-во страниц: 85
Стоимость: Договорная
Описание: Полный комплект документации
Содержание:
Руководство по эксплуатации (ВМ127.00.00.000РЭ)
Общие сведения о станке
– Внешний вид станка
Основные технические данные и характеристики
– Эскиз Т-образных пазов
– Эскиз направляющих станины
– Эскиз конца шпинделя
Сведения о содержании драгоценных металлов
Комплект поставки
Указание мер безопасности
Состав станка
– Ограждение фрез
– Расположение составных частей станка
Устройство, работа станка и его основных частей
– Кинематическая схема
– График чисел оборотов шпинделя в минуту
– График продольной и поперечной подач
– Насос смазки коробки скоростей
– Разрез поворотной головки без механизма зажима инструмента
– Разрез по осям коробки переключения скоростей
– Механизм рукоятки переключения скоростей
– Разрез по выходному валу коробки подач
– Коробка подач
– Механизм переключения подач
– Консоль (развёртка)
– Консоль (разрез по винту подъёма)
– Разрез по механизму включения электромагнита
– Разрез включения вертикальной и поперечной подач
– Насос смазки консоли
– Золотниковый распределитель
– Разрез по ходовому винту
– Регулировка зазора в ходовом винте
– Регулирование клиньев
– Разрез по рукоятке включения продольной подачи
– Общий вид салазок
– Механизм запирания муфты
Электрооборудование
– Принципиальная электросхема станка
– Диаграмма переключателя и командоаппаратов
– Электросхема соединений
– Электросхема соединений на дверке левой ниши
– Электросхема соединений в левой ниши
– Схема расположения электрооборудования на станке
Система смазки
– Схема смазки станка
Порядок установки
– Схема транспортировки станка
– Установка станка
Порядок работы
– Настройка станка на автоматические циклы
– Схема расположения подшипников качения
Характерные неисправности и методы их устранения
Особенности сборки и разборки при ремонте
Материалы по запасным частям**********
Свидетельство о приёмке
Свидетельство о консервации
Свидетельство об упаковке
Указание по эксплуатации
Гарантийные обязательства
Перечень нормативно-технических документов
Описание станка:
Весьма распространённой потребностью в направлении промышленного производства по нашим наблюдениям является паспорт станка вм127. Так как именно вот этот фрезерный станок применяется в производственных реалиях весьма и весьма широко, то потребность в наличии наиболее полной документации будет являться действительно актуальным моментом в вопросах эксплуатации, обслуживания и даже в условиях некоторого ремонта станочной единицы для фрезерования. Производился данный станок таким известным в среде поставщиков металлообрабатывающего оборудования заводом под названием Воткинский машиностроительный завод. Этот момент конечно же является примечательным, ведь именно в этой производственной среде получалось реализовывать наиболее интересные и надёжные модели станочного оборудования. В частности, фрезерные станки, оснастку и запчасти к ним, что поставлялись всё тем же заводом. Эта документация произведена ещё в одна тысяча девятьсот восемьдесят пятом году, и обладает вполне хорошим объёмом информации. Всего в техническом издании представлено не менее восьмидесяти пяти страниц, распространённого формата А4 в читаемом качестве, что позволит ознакомиться с теоретической, а вместе с этим и практической информацией о станке.
Так как именно вот этот фрезерный станок применяется в производственных реалиях весьма и весьма широко, то потребность в наличии наиболее полной документации будет являться действительно актуальным моментом в вопросах эксплуатации, обслуживания и даже в условиях некоторого ремонта станочной единицы для фрезерования. Производился данный станок таким известным в среде поставщиков металлообрабатывающего оборудования заводом под названием Воткинский машиностроительный завод. Этот момент конечно же является примечательным, ведь именно в этой производственной среде получалось реализовывать наиболее интересные и надёжные модели станочного оборудования. В частности, фрезерные станки, оснастку и запчасти к ним, что поставлялись всё тем же заводом. Эта документация произведена ещё в одна тысяча девятьсот восемьдесят пятом году, и обладает вполне хорошим объёмом информации. Всего в техническом издании представлено не менее восьмидесяти пяти страниц, распространённого формата А4 в читаемом качестве, что позволит ознакомиться с теоретической, а вместе с этим и практической информацией о станке.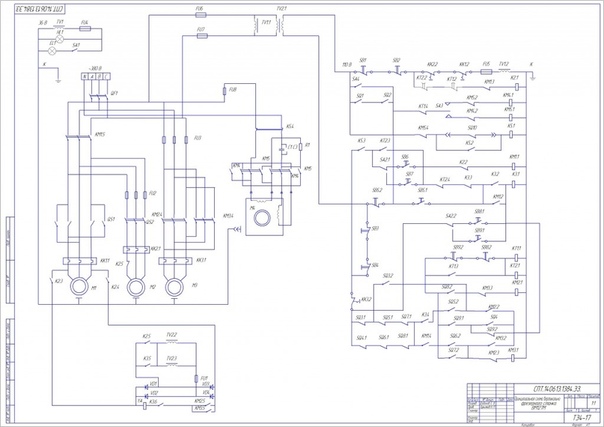
Дело в том, что фрезерный станок вм127 паспорт которого находится в нашем архиве и переведён в электронный формат. Может быть поставлен оперативно и в весьма короткие сроки в электронный адрес заказчика согласно перечню, приведенному выше. После оплаты и поступления платежа на наш расчётный счёт мы направляем документацию для работы со станком и обслуживанием его важнейших узлов, а так же элементов. Само по себе издание обозначается согласно канону как руководство по эксплуатации. Но именно в руководстве присутствует вполне себе объёмное описание, граничащее с теоретической частью станка. Ну и конечно приведены практические материалы в виде чертежей направленных всё больше на работу с механикой фрезерного станка. Опять же, кроме возможностей механической части, здесь есть и полноценный раздел, направленный на работу с электрикой. Всё так же, как и в первом случае присутствует детальное описание электрики станка или ещё его можно назвать теоретической частью. Но вместе с этим, имеется довольно развёрнутая подача всех необходимых электросхем, что конечно же важно в вопросах работы с любым типом оборудования.
ВМ-127 вертикально-фрезерный станок характеристики, паспорт, электрическая схема
Процесс фрезеровки учитывает механическое снятие металла с поверхности. Для проведения аналогичной операции требуется станок для фрезеровальных работ, который может снабжаться разными насадками. Довольно больше распространение обрела вертикально-фрезерная модель ВМ127. Она предназначен для изготовления маленьких и средних изделий. Станок для фрезеровальных работ ВМ127 используется для обработки самых разных плоскостей, углов, пазов и прочих изделий. Подобиями можно назвать 6Р14 и 6Т13. Рассмотрим характерности такой конструкции детальнее.
Устройство оборудования
Вертикально станок для фрезеровальных работ ВМ127 обрел большое распространение благодаря эффектной конструкции. Ее характерностями можно назвать такие моменты:
- Ставится мощный привод, который обеспечивает условия для плавной регулировки скорости подачи при самых разных условиях резания.

- В качестве привода применяется сервоконтролерный механизм. При этом ВМ127М имеет обратную связь.
- Устройство отличается наличием полуавтоматической системы смазки, которая обеспечивает большую надежность работы фрезерного оборудования.
- Ставится и система подачи СОЖ в территорию резания. Она значительно расширяет область использования устройства.
- На стойке размещены разные детали управления, представленные рычагами и рукоятками.
Модель может снабжаться разными фрезами. Ключевыми узлами можно назвать приведенные ниже детали:
- Станина. Она делается при использовании чугуна. Массивное основание обеспечивает большую стойкость устройства на момент работы. Высокая жесткость станины определяет точное позиционирование всех компонентов, а еще отсутствие вибрации на момент работы.
- Вертикальное расположение инструмента для резки на данное время стало широко распространено.
 Для этого есть стойка, на которой расположена шпиндельная бабка. В середине данного компонента находится коробка скоростей, представленная комбинированием зубчатых колес. Во время изготовления стойки и шпиндельной бабки применяется сталь, благодаря чему обеспечивается высокая защитная степень и маленький вес конструкции. Поверхность стали покрывается краской чтобы исключить допустимости возникновения коррозии при долгой эксплуатации в трудных условиях.
Для этого есть стойка, на которой расположена шпиндельная бабка. В середине данного компонента находится коробка скоростей, представленная комбинированием зубчатых колес. Во время изготовления стойки и шпиндельной бабки применяется сталь, благодаря чему обеспечивается высокая защитная степень и маленький вес конструкции. Поверхность стали покрывается краской чтобы исключить допустимости возникновения коррозии при долгой эксплуатации в трудных условиях. - Шпиндель предназначается для закрепления фрез и прочих инструментов. Она может вертется вокруг оси и передвигаться в вертикальном направлении. Над бабкой есть электро двигатель, в сторону отводится пульт управления, который крепится гибко. В территорию резания подается СОЖ, благодаря чему можно обрабатывать заготовки на более большой скорости.
- Снизу размещены салазки и стол для закрепления заготовки. Для управления положением рабочего узла существует несколько рукояток. Рассчитано наличие быстрой подачи для движения стола на холостом ходу.
 Стол передвигается по стойке в вертикальном направлении для обеспечения подачи заготовки.
Стол передвигается по стойке в вертикальном направлении для обеспечения подачи заготовки.
В общем необходимо заявить, что расположение станка для фрезеровочных работ традиционная, благодаря чему становится шире его область использования. Принципиальная электросхема позволяет всегда выключить устройство.
Технические свойства и использование
При подборе модели уделяют внимание ключевым техническим свойствам. В набор поставки включается паспорт.
Скачать паспорт (инструкцию по эксплуатированию) станка для фрезеровочных работ ВМ127
Важными параметрами можно назвать приведенные ниже моменты:
- Размер поверхности для работы станка для фрезеровочных работ определяет то, какие заготовки могут обрабатываться. В рассматриваемом случае размер 1600 на 40 мм.
- Самая большая нагрузка на стол составляет 800 килограмм.
- На фрезерном станке ставится несколько электромоторов. Ключевой имеет мощность 11 кВт, также есть дополнительные с мощностью 2,1 кВт и 0,12 кВт.
 Они предназначаются для управления столом и перекачивания охлаждающей жидкости в территорию резания.
Они предназначаются для управления столом и перекачивания охлаждающей жидкости в территорию резания. - Класс точности оборудования составляет Н. Необходимо учесть данный показатель при изготовлении самых всевозможных изделий.
- Масса станка для фрезеровочных работ составляет 4200 килограмм. Данный момент определяет то, что оборудование должно ставиться на специальном основании.
- Технология обработки учитывает установку наиболее оптимальной скорости вращения инструмента. Оператор может показать одну из 18 частот вращения шпинделя.
- Стол может перемещаться в нескольких направлениях с разной скоростью.
Фрезеровка станком фрезерный ВМ127 дает возможность получать изделия очень точно. Модель монтируется в случае наладки мелкосерийного или штучного производства, за счёт установки сегодняшней фрезы имеется возможность расширить критерий продуктивности. Характеристики оборудования установили его большое распространение в машиностроении.
При соответствующем оборудовании мастерской дома можно выполнить установку рассматриваемого станка для фрезеровочных работ. Необходимо учесть, что больший коэффициент потребления электроэнергии предъявляет большие требования к электросети. По мимо этого, как основание должна использоваться массивная плита.
Необходимо учесть, что больший коэффициент потребления электроэнергии предъявляет большие требования к электросети. По мимо этого, как основание должна использоваться массивная плита.
Если вы нашли погрешность, пожалуйста, выдилите фрагмент текста и нажмите Ctrl+Enter.
Похожие статьи
| Schaublin-13 (поздняя версия), станок фрезерный инст… | |
| правила эксплуатации,зап части, электро схема ( полный паспорт) | |
|
|
| Обновлен: 16 Jun 2009 | |
| Набор чертежей небольшого китайского фрезера | |
Возможно для кого-то будет интересен набор чертежей небольшого
фрез. .. .. |
|
|
|
| Обновлен: 08 Jun 2009 | |
| паспорт фрезера OPTI BF 30 Vario | |
| паспорт фрезера OPTI BF 30 Vario | |
|
|
| Обновлен: 16 Jun 2010 | |
| Ф-2А, станок фрезерный часовой | |
| Паспорт на часовой фрезерный станок Ф-2А, любезно предоставленный A… | |
|
|
| Обновлен: 14 Apr 2010 | |
| 6Н81, фото и некоторые сканы из паспорта | |
| Фото и чертеж редуктора (коробки реверса) | |
|
|
| Обновлен: 13 Apr 2009 | |
| Электрическая схема FU315/400 (реле) | |
| Электрическая схема FU315/400 (реле) | |
|
|
| Обновлен: 07 Apr 2009 | |
6Т82, 6Т83, 6Т12, 6Т13 (Г-1, -1, Ш-1) –
электрообору. .. .. |
|
| Инструкция по электрооборудованию – по ссылке “Скачать” Ска… | |
|
|
| Обновлен: 09 Apr 2010 | |
| ВМ127, станок вертикально-фрезерный, электросхема | |
| Электросхема фрезерного станка ВМ127 | |
|
|
| Обновлен: 02 Nov 2010 | |
| ВМ127М, станок вертикально-фрезерный, Воткинск, элек… | |
| Электросхема фрезерного станка ВМ127М | |
|
|
| Обновлен: 26 Feb 2009 | |
| Эскизы и фотографии серьги для 675п | |
Огромный сенкс Igor78 за создание эскизы и фотки.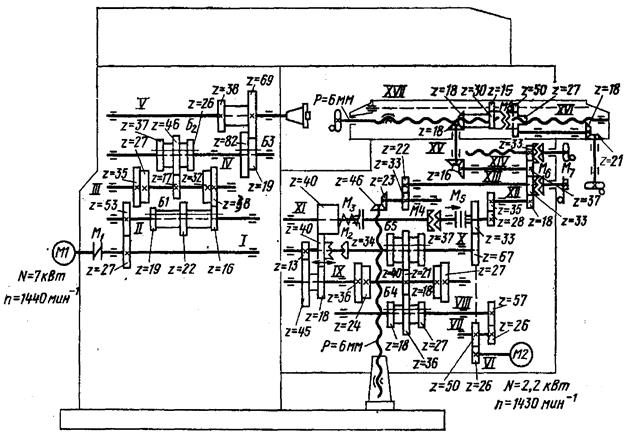 |
|
|
|
| Обновлен: 08 Aug 2009 | |
| 6н13п_электросхема | |
| Электрическая принципиальная схема станка 6н13п (или 6Ь13П, опечатк… | |
|
|
| Обновлен: 16 Jun 2010 | |
| FNK-25А, станок фрезерный универсальный, Чехословакия | |
| Паспорт и инструкция по эксплуатации. Качество оригинала – очень ср… | |
|
|
| Обновлен: 16 Feb 2009 | |
Вертикальные консольно-фрезерные станки
6Р82,6Р83,6Р. .. .. |
|
| Руководство по эксплуатации электрооборудования, электросхемы…. с… | |
|
|
| Обновлен: 12 Feb 2009 | |
| FSS400_shema_EFE700 | |
| Схема станка с контроллером EFE700 | |
|
|
| Обновлен: 08 Feb 2009 | |
| FSS400 | |
| паспорт отдельные страницы | |
|
|
| Обновлен: 20 Oct 2011 | |
Консольно-фрезерные вертикальные станки
6Р12,6Р12Б,6. .. .. |
|
| Здесь можно найти ВСЁ: кинематика, устройство и работа станков, гра… | |
|
|
| Обновлен: 02 Nov 2011 | |
| С-169, станок универсальный фрезерный, РЭ, Москва | |
| С-169, станок универсально-фрезерный, паспорт, чертежи некоторых де… | |
|
|
| Обновлен: 03 Feb 2012 | |
| Гидросхема 6740ВФ20 tiff | |
| схема и описание | |
|
|
| Обновлен: 20 Jan 2009 | |
| FU 400 часть 2 | |
| паспорт | |
|
|
| Обновлен: 20 Jan 2009 | |
| FU 400 часть 1 |
Пробить номер машины онлайн на портале Автокод
Через сервис «Автокод» можно узнать историю любого автомобиля, зарегистрированного на территории РФ. Для этого достаточно указать госномер транспортного средства. В течение 5 минут система сформирует отчет с подробной информацией об автомобиле. Этот отчет призван помочь в первую очередь покупателям автомобилей с пробегом. Он покажет, какие юридические и технические проблемы есть у машины.
Для этого достаточно указать госномер транспортного средства. В течение 5 минут система сформирует отчет с подробной информацией об автомобиле. Этот отчет призван помочь в первую очередь покупателям автомобилей с пробегом. Он покажет, какие юридические и технические проблемы есть у машины.
Как узнать госномер автомобиля
Государственный номер транспортного средства (госномер) является комбинацией цифр, а также букв, нанесенных на специальную пластмассовую или же металлическую пластину с передней, а также задней стороны транспортного средства. Государственным номером должно обладать любое транспортное средство. Основным предназначением государственного номера является осуществление учета транспортных средств.
Производство государственных номерных знаков для транспортных средств в Российской Федерации с 1993 года осуществляется по единому образцу. Такие номера содержат в себе три буквы и три цифры. Первая буква обозначает серию государственного номера транспортного средства. Три цифры обозначают регистрационный номер транспортного средства, который присваивается ГИБДД. Следующие три буквы также обозначают серию государственного номера транспортного средства.
Три цифры обозначают регистрационный номер транспортного средства, который присваивается ГИБДД. Следующие три буквы также обозначают серию государственного номера транспортного средства.
С правой стороны все государственные номера транспортных средств имеют дополнительные пометки, которые свидетельствуют о том, что ТС зарегистрировано на территории Российской Федерации. К таковым относятся изображение государственного герба, флага, аббревиатура Российской Федерации, а также код региона, в котором транспортное средство зарегистрировано.
Госномер автомобиля можно увидеть на фотографиях в объявлении о продаже авто. Если на фото номер машины скрыт, позвоните продавцу. Обычно добросовестные продавцы не скрывают номер автомобиля. Если продавец не желает сообщать госномер до тех пор, пока вы не приедете на осмотр, скорее всего, вы разговариваете с представителем серого автосалона.
О чем расскажет проверка истории автомобиля
Чем может быть полезна проверка авто по гос номеру?
Проверка через Автокод покажет историю эксплуатации автомобиля. Отчет будет содержать следующие данные:
- ограничения ГИБДД;
- таможенная история;
- история пробегов;
- залоги;
- использование в такси:
- история ДТП;
- расчеты страховых ремонтных работ и многое другое.
Пробить машину по госномеру!
Главное преимущество онлайн-сервиса «Автокод» перед другими сайтами проверки истории авто состоит в том, что вам не нужно знать номер водительского удостоверения, VIN, номер СТС или другую информацию. Достаточно указать государственный номер транспортного средства. По госномеру можно проверить даже японские праворульные автомобили.
Также к преимуществам проверки истории владения и эксплуатации транспортного средства на сайте «Автокод» можно отнести следующее:
- не нужно проходить длительную процедуру регистрации;
- имеется гарантия возмещения ущерба;
- автоиндекс для быстрого сравнения авто;
- техническая поддержка 8-800-500-74-26.

Проверьте автомобиль прямо сейчас и будьте уверены в своей будущей машине!
OID 1.3.6.1.4.1.562.2.4.1.127 справочная информация gsmCs
OID 1.3.6.1.4.1.562.2.4.1.127 справочная информация gsmCs- родитель
- 1.3.6.1.4.1.562.2.4.1 (компоненты)
- код узла
- 127
- имя узла
- gsmCs
- точка oid
- 1.3.6.1.4.1.562.2.4.1.127
- тип
- ИДЕНТИФИКАТОР ОБЪЕКТА
- asn1 oid
- {iso (1) идентифицированная организация (3) dod (6) интернет (1) частное лицо (4) предприятие (1) nortel (562) magellan (2) паспорт (4) компоненты (1) gsmCs (127)}
- {iso (1) идентифицированная организация (3) dod (6) интернет (1) частное лицо (4) предприятие (1) северный телеком (562) magellan (2) паспорт (4) компоненты (1) GSMCs (127)}
- …пропущен …
- {iso (1) org (3) dod (6) internet (1) частное (4) предприятие (1) северный телеком (562) magellan (2) паспорт (4) компоненты (1) gsmCs (127)}
- {iso (1) org (3) dod (6) internet (1) частное (4) предприятие (1) nt (562) magellan (2) паспорт (4) компоненты (1) gsmCs (127)}
- {iso (1) org (3) dod (6) internet (1) частные (4) предприятия (1) nortel (562) magellan (2) паспорт (4) компоненты (1) gsmCs (127)}
- {iso (1) org (3) dod (6) internet (1) частные (4) предприятия (1) севертелеком (562) magellan (2) паспорт (4) компоненты (1) gsmCs (127)}
- .
 ..пропущен …
..пропущен …- {iso (1) iso-identify-organization (3) dod (6) internet (1) частные (4) предприятия (1) северный телеком (562) magellan (2) паспорт (4) компоненты (1) gsmCs (127) }
- {iso (1) iso-identify-organization (3) dod (6) internet (1) частные (4) предприятия (1) nt (562) magellan (2) паспорт (4) компоненты (1) gsmCs (127) }
- iri oid
- / iso / identify-organization / dod / internet / private / enterprise / nortel / magellan / паспорт / компоненты / gsmCs
- / iso / defined-organization / dod / internet / private / enterprise / северный телеком / magellan / паспорт / компоненты / gsmCs
- …пропущен …
- / iso / org / dod / internet / private / enterprise / северный телеком / magellan / паспорт / компоненты / gsmCs
- / iso / org / dod / internet / private / enterprise / nt / magellan / паспорт / компоненты / gsmCs
- / iso / org / dod / internet / private / enterprises / nortel / magellan / паспорт / компоненты / gsmCs
- / iso / org / dod / internet / private / enterprises / северный телеком / magellan / паспорт / компоненты / gsmCs
- .
 .. пропущено …
.. пропущено …- / iso / iso-identify-organization / dod / internet / private / enterprises / северный телеком / magellan / паспорт / компоненты / gsmCs
- / iso / iso-identify-organization / dod / internet / private / enterprises / nt / magellan / паспорт / компоненты / gsmCs
- iri от oid_info
- / ISO / Identified-Organization / 6/1/4/1/562/2/4/1/127
Информация от oid_info
Производитель: Northern Telecom, Ltd.
Модуль: Nortel-Magellan-Passport-GsmIwfMIB
[извлечено автоматически с oidview.com]
Информация предоставлена mibdepot
gsmCs ИДЕНТИФИКАТОР ОБЪЕКТА :: = {компоненты 127}
Информация от цирка
gsmCs ИДЕНТИФИКАТОР ОБЪЕКТА :: = {компоненты 127}
Первый орган регистрации (восстановлен родительским 1.3.6.1.4.1.562)
Шарон Чисхолм
Текущий орган регистрации (восстановлено родителем 1.
 3.6.1.4.1.562)
3.6.1.4.1.562)Майк Боббитт
Дети (11)
Братья (66)
Поддержка Microsoft Passport (Win10) for Work добавлена в Intune
Microsoft добавила поддержку Microsoft Passport for Work в качестве альтернативного метода входа для пользователей Windows 10.
Если пользователи устройства с Windows 10 используют Active Directory или Azure Active Directory для аутентификации пароля, смарт-карту или виртуальную смарт-карту можно заменить паролем Microsoft.Как администратор Intune вы можете настроить поведение Microsoft Passport. Давайте посмотрим!
При включении функции в разделе «Администратор»> «Управление мобильными устройствами»> «Windows»> «Паспорт Windows».
Настройки Microsoft Passport
Для Microsoft Password for Work можно настроить следующие параметры:
| Настройка | Настройка | Описание |
| Используйте доверенный платформенный модуль (TPM) | Предпочтительно или Обязательно | Чип TMP обеспечивает дополнительный уровень защиты данных |
| Требуется минимальная длина PIN-кода | 4-127 | Минимальная длина PIN-кода |
| Требуется максимальная длина PIN-кода: | 4-127 | Максимальная длина PIN-кода |
| Требовать строчные буквы в ПИН-коде: | Разрешено, запрещено, Обязательно | Настроить сложность ПИН-кода и разрешить, запретить или требовать ПИН-код со строчными буквами. |
| Требовать прописные буквы в PIN-коде: | Разрешено, запрещено, Обязательно | Настроить сложность PIN-кода и разрешить, запретить или требовать PIN-код с прописными буквами. |
| Требовать специальные символы в ПИН-коде: | Разрешено, запрещено, Обязательно | Настроить сложность PIN-кода и разрешить, запретить или требовать PIN-код со специальными символами. |
| Срок действия PIN-кода (дней): | Числовое значение (41) | Срок действия PIN-кодаистечет через X дней |
| Запомнить историю PIN: | Числовое значение (5) | PIN-код будет запомнен на X изменений. |
| Разрешить биометрическую аутентификацию: | Нет / Да | Разрешить биометрическую аутентификацию, такую как распознавание лиц Windows Hellos или сканирование радужной оболочки глаза. |
| Использовать улучшенную защиту от спуфинга, если таковая имеется | Нет / Да / Не настроен | Если не настроено, пользователи могут выбрать использование расширенного антиспуфинга на поддерживаемых устройствах или нет. |
| Использовать удаленный паспорт: | Нет / Да | Используйте Remote Passport в качестве портативного устройства-компаньона для аутентификации на рабочем столе.Требуется Azure AD. |
После включения поддержки Microsoft Passport пользователь вынужден создать PIN-код в соответствии с настройками организации, как показано ниже.
Создание ПИН-кода принудительное
Первым шагом является проверка учетной записи / личности с помощью MFA, например SMS, телефонного звонка или приложения для ответа на запрос из Azure AD.
Укажите номер телефона для подтверждения личности
После того, как все будет проверено, можно установить ПИН-код в соответствии с настройками, настроенными в Microsoft Intune.
Настройте ПИН-код в соответствии с настройками в Intune
Не все клиенты еще были обновлены, насколько мне известно, Европа 01 и Северная Америка 01 обновлены, а текущий номер версии Intune можно найти здесь.
Комментарии
Интеграция Windows Hello для бизнеса с Microsoft Intune – Microsoft Intune
- 5 минут на чтение
Оцените свой опыт
да Нет
Любой дополнительный отзыв?
Отзыв будет отправлен в Microsoft: при нажатии кнопки «Отправить» ваш отзыв будет использован для улучшения продуктов и услуг Microsoft.Политика конфиденциальности.
Представлять на рассмотрение
Спасибо.
В этой статье
Вы можете интегрировать Windows Hello для бизнеса с Microsoft Intune во время регистрации устройства.
Hello for Business – это альтернативный метод входа, который использует Active Directory или учетную запись Azure Active Directory для замены пароля, смарт-карты или виртуальной смарт-карты.Он позволяет использовать для входа пользовательский жест вместо пароля. Жестом пользователя может быть PIN-код, биометрическая проверка подлинности, например Windows Hello, или внешнее устройство, например считыватель отпечатков пальцев.
Intune интегрируется с Hello for Business двумя способами:
- Для всего клиента ( в этой статье) : политику Intune можно создать в разделе Регистрация устройства . Эта политика нацелена на всю организацию (на уровне клиента). Он поддерживает готовый к работе (OOBE) Windows AutopPilot и применяется при регистрации устройства.
- Дискретные группы : для устройств, которые ранее были зарегистрированы в Intune, используйте профиль конфигурации Identity Protection для настройки устройств для Windows Hello для бизнеса.
 Профили защиты личности могут быть нацелены на назначенных пользователей или устройства и применяться во время регистрации.
Профили защиты личности могут быть нацелены на назначенных пользователей или устройства и применяться во время регистрации.
Кроме того, Intune поддерживает следующие типы политик для управления некоторыми параметрами Windows Hello для бизнеса:
Остальная часть статьи посвящена созданию политики Windows Hello для бизнеса по умолчанию, которая нацелена на всю организацию.
Важно
До Anniversary Update вы могли установить два разных PINS, которые можно было использовать для аутентификации на ресурсах:
- PIN-код устройства можно использовать для разблокировки устройства и подключения к облачным ресурсам.
- Рабочий PIN-код использовался для доступа к ресурсам Azure AD на личных устройствах пользователя (BYOD).
В юбилейном обновлении эти два PINS были объединены в один PIN-код устройства.
Все политики конфигурации Intune, которые вы установили для управления ПИН-кодом устройства, а также любые настроенные вами политики Windows Hello для бизнеса теперь устанавливают это новое значение ПИН. Если вы установили оба типа политики для управления ПИН-кодом, применяется политика Windows Hello для бизнеса.
Чтобы обеспечить разрешение конфликтов политик и правильное применение политики ПИН, обновите политику Windows Hello для бизнеса, чтобы она соответствовала параметрам в политике конфигурации, и попросите пользователей синхронизировать свои устройства в приложении корпоративного портала.
Если вы установили оба типа политики для управления ПИН-кодом, применяется политика Windows Hello для бизнеса.
Чтобы обеспечить разрешение конфликтов политик и правильное применение политики ПИН, обновите политику Windows Hello для бизнеса, чтобы она соответствовала параметрам в политике конфигурации, и попросите пользователей синхронизировать свои устройства в приложении корпоративного портала.
Создание политики Windows Hello для бизнеса
Войдите в центр администрирования Microsoft Endpoint Manager.
Перейти к Устройства > Регистрация > Регистрация устройств > Регистрация в Windows > Windows Hello для бизнеса .Откроется панель Windows Hello для бизнеса.
Выберите один из следующих параметров для Настроить Windows Hello для бизнеса :
Включено . Выберите этот параметр, если вы хотите настроить параметры Windows Hello для бизнеса.
 Когда вы выбираете Включено , дополнительные параметры для Windows Hello становятся видимыми и могут быть настроены для устройств.
Когда вы выбираете Включено , дополнительные параметры для Windows Hello становятся видимыми и могут быть настроены для устройств.Отключено . Если вы не хотите включать Windows Hello для бизнеса во время регистрации устройства, выберите этот вариант.Если этот параметр отключен, пользователи не могут подготовить Windows Hello для бизнеса. Если установлено значение Отключено , вы все равно можете настроить последующие параметры для Windows Hello для бизнеса, даже если эта политика не будет включать Windows Hello для бизнеса.
Не настроено . Выберите этот параметр, если вы не хотите использовать Intune для управления параметрами Windows Hello для бизнеса. Любые существующие настройки Windows Hello для бизнеса на устройствах 10/11 не изменяются. Все остальные настройки на панели недоступны.
Если вы выбрали Включено на предыдущем шаге, настройте необходимые параметры, которые применяются ко всем зарегистрированным устройствам Windows 10/11.
 После настройки этих параметров выберите Сохранить .
После настройки этих параметров выберите Сохранить .Используйте доверенный платформенный модуль (TPM) :
Микросхема TPM обеспечивает дополнительный уровень безопасности данных. Выберите одно из следующих значений:
- Обязательно (по умолчанию). Только устройства с доступным TPM могут подготавливать Windows Hello для бизнеса.
- Предпочтительно . Устройства сначала пытаются использовать TPM. Если этот параметр недоступен, они могут использовать программное шифрование.
Минимальная длина PIN-кода и Максимальная длина PIN-кода :
Настраивает устройства на использование минимальной и максимальной длины PIN-кода, указанной вами для обеспечения безопасного входа. Длина ПИН-кода по умолчанию составляет шесть символов, но вы можете установить минимальную длину в четыре символа. Максимальная длина ПИН-кода составляет 127 символов.

Строчные буквы в ПИН , Прописные буквы в ПИН и Специальные символы в ПИН .
Вы можете применить более строгий ПИН-код, потребовав использовать в ПИН-коде прописные, строчные буквы и специальные символы. Для каждого выберите из:
Разрешено . Пользователи могут использовать тип символа в своем ПИН-коде, но это не обязательно.
Обязательно . Пользователи должны включать в свой ПИН хотя бы один из типов символов._ `{| } ~
Срок действия ПИН-кода (дней) :
Рекомендуется указать срок действия ПИН-кода, по истечении которого пользователи должны его изменить. По умолчанию 41 день.
Запомнить историю PIN-кодов :
Ограничивает повторное использование ранее использованных PIN-кодов. По умолчанию последние 5 PIN-кодов не могут быть использованы повторно.

Разрешить биометрическую аутентификацию :
Включает биометрическую аутентификацию, такую как распознавание лица или отпечаток пальца, в качестве альтернативы ПИН-кода для Windows Hello для бизнеса.Пользователи все равно должны настроить рабочий PIN-код на случай сбоя биометрической аутентификации. Выбирать из:
- Да . Windows Hello для бизнеса поддерживает биометрическую аутентификацию.
- № . Windows Hello для бизнеса предотвращает биометрическую аутентификацию (для всех типов учетных записей).
Использовать улучшенную защиту от спуфинга, если таковая имеется :
Определяет, используются ли функции защиты от спуфинга Windows Hello на устройствах, которые ее поддерживают.Например, обнаружение фотографии лица вместо реального лица.
Если установлено значение Да , Windows требует, чтобы все пользователи использовали анти-спуфинг для функций лица, если это поддерживается.

Разрешить вход по телефону :
Если для этого параметра установлено значение Да , пользователи могут использовать удаленный паспорт в качестве портативного устройства-компаньона для аутентификации настольного компьютера. Настольный компьютер должен быть присоединен к Azure Active Directory, а на сопутствующем устройстве должен быть настроен PIN-код Windows Hello для бизнеса.
Использовать электронные ключи для входа :
Если установлено значение Включить , этот параметр обеспечивает возможность удаленного включения / выключения ключей безопасности Windows Hello для всех компьютеров в организации клиента.
Поддержка Windows Holographic для бизнеса
Windows Holographic для бизнеса поддерживает следующие параметры Windows Hello для бизнеса:
- Используйте доверенный платформенный модуль (TPM)
- Минимальная длина PIN-кода
- Максимальная длина ПИН-кода
- Строчные буквы в PIN-коде
- Заглавные буквы в PIN-коде
- Специальные символы в PIN-коде
- Срок действия PIN-кода (дней)
- Запомнить историю PIN-кодов
Следующие шаги
Дополнительные сведения о Windows Hello для бизнеса см. В руководстве в документации Windows.
В руководстве в документации Windows.
Call-центр позволит выздоровевшим после Covid позвонить для получения сертификата
Обновлено 6 июля 2021 года, 21:50.
Полностью вакцинированные ЛЮДИ начнут получать свои электронные пропуска ЕС против COVID-19 со следующего понедельника, 12 июля.
Люди получат свои сертификаты либо по электронной почте, либо по почте, а служба Revenue поможет в их рассылке по почте.
Digital Covid Cert позволит людям путешествовать в пределах ЕС.Это будет означать, что те, у кого есть пропуск Covid, смогут вернуться в Ирландию без ограничения своих перемещений или карантина.
Те, кто был полностью вакцинирован, кто приобрел естественный иммунитет в результате заражения Covid-19 за последние шесть месяцев или у кого недавно был отрицательный тест ПЦР, будут иметь право на прохождение Covid.
Правительство намерено создать центр обработки вызовов Digital Covid Cert, который позволит людям звонить и запрашивать сертификат, если они имеют на это право в силу естественного иммунитета.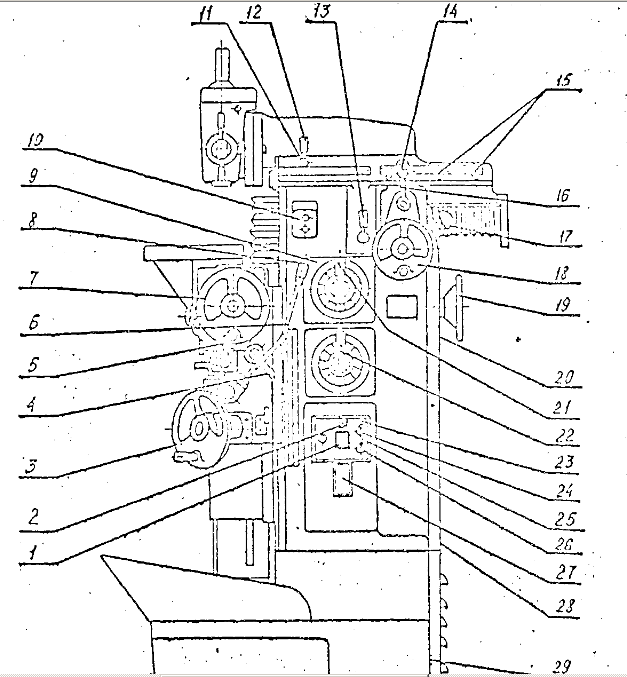
Этот колл-центр также будет обрабатывать запросы от людей, которые полностью вакцинированы, но еще не получили сертификат Digital Covid Cert. Дата начала работы этого call-центра еще не назначена.
По оценкам HSE, в нем зарегистрировано около 170 000 человек, которые прошли положительный тест за последние шесть месяцев и поэтому имеют право на получение сертификата Digital Covid Cert по этой причине.
Эти люди не получат сертификат Digital Covid Cert автоматически и должны будут позвонить, чтобы получить его.
Представитель правительства заявил сегодня вечером, что люди, у которых, возможно, не было положительного результата теста в рамках HSE, могут получить сертификат Digital Covid Cert, если они будут зарегистрированы в системе тестирования и отслеживания как имеющие Covid-19.
Люди также могут получить сертификат Digital Covid Cert, если они недавно получили отрицательный результат ПЦР.
Правительство подтвердило, что люди, которым требуется отрицательный результат теста для получения сертификата Digital Covid Cert, не смогут использовать для этого бесплатную службу тестирования HSE.
Вместо этого люди будут обязаны обращаться к частному поставщику медицинских услуг, и представитель говорит, что речь идет о «не смешивании системы общественного здравоохранения с тем, что есть для людей, путешествующих».
Законы ЕС
Выступая сегодня на канале RTÉ News at One сегодня, Танист Лео Варадкар сказал, что Ирландия разрешит въезд в Ирландию людям с цифровым пропуском, если у них будет отрицательный результат теста ПЦР, но у которых нет естественного иммунитета или иммунитета, основанного на вакцинах. законы ЕС требуют.
Но он сказал, что общественное здравоохранение Ирландии советует людям, которые не вакцинированы или у которых нет естественного иммунитета, не выезжать за границу.
Варадкар сказал, что некоторые люди получат пропуск по электронной почте, а другие – по почте.
«Будут проблемы с прорезыванием зубов», – предупредил Варадкар. «Я уверен, что найдутся люди, которые не получат свои сертификаты вовремя, поэтому у нас будет колл-центр, чтобы помочь людям… и вполне возможно, что поначалу будут задержки в аэропортах. ”
”
Он посоветовал людям, которые действительно планировали вылететь за границу, дать достаточно времени для задержек и знать о двух разных наборах правил Covid-19 – один для страны, из которой они уезжают, а другой для страны, в которую они будут. вход.
Столовая в помещении
Выступая сегодня перед журналистами, министр транспорта Имон Райан сказал, что со следующей недели люди начнут получать свои цифровые сертификаты по электронной или обычной почте.
Он добавил, что ближайшим приоритетом является то, что цифровые сертификаты будут использоваться для путешествий, прежде чем они будут рассматриваться как форма вакцины для гостеприимства.
«Во-первых, я думаю, что на данный момент мы должны разделить эти две вещи. Сертификат Covid для путешествий – это конкретная программа ЕС, механизм ЕС, и, хотя мы должны каким-то образом решить проблему гостеприимства, обо всем по порядку. туристический сертификат », – сказал он.
Варадкар также сказал, что он не может с уверенностью сказать, что ресторан в помещении будет работать с 19 июля, и что были «трудности» с обеспечением безопасности.
Предложения о том, как может работать крытая столовая, должны быть внесены в Кабинет министров в следующий вторник, и Варадкар сказал, что они взаимодействуют с представителями отрасли по этому поводу.
Когда его спросили, можно ли использовать тестирование для повторного открытия ресторана в помещении, Варадкар сказал, что это «смешано», но все еще есть проблемы: «У нас не было бы возможности провести тысячи или сотни тысяч тестов ПЦР, чтобы люди могли сходить в ресторан или паб… и нет теста лучше вакцины ».
Он сказал, что была создана группа по внедрению быстрого тестирования, чтобы изучить этот вопрос, чтобы посмотреть, стоит ли расширять тестирование на антигены, но добавил, что если они это сделают, это будет «выходить за рамки» официального совета NPHET.
Министра туризма и туризма Кэтрин Мартин сегодня спросили, можно ли потенциально использовать паспорта вакцины в рамках крупномасштабных тестовых мероприятий или в более широком секторе искусства.
«Я думаю, что в этом есть потенциал, но ближайшим приоритетом, я полагаю, является открытие гостеприимства, повторного открытия закрытых помещений», – сказал Мартин.
Но я вижу в этом потенциал того, что все, что мы делаем для внутреннего гостеприимства, может иметь потенциал для применения в искусстве, музыке и развлечениях.
Она добавила: «Все варианты на столе, поэтому отрасль возвращается, чтобы обдумать все варианты безопасного повторного открытия, а затем они вернутся к нам в четверг. Я говорю о том, что вижу потенциал того, как это можно использовать в искусстве. Мы еще не обсуждаем этот разговор, но сейчас мы сосредоточены на том, как мы можем снова открыть гостиничный бизнес в помещениях ».
Экспресс-тестирование
Кабинет министров одобрил создание новой экспертной группы по экспресс-тестированию на Covid-19.
# Открытая журналистика Нет новостей – плохие новости Поддержите журнал
Ваши взноса помогут нам продолжить рассказывать истории, которые важны для вас
Поддержите нас сейчас Мэри Хорган, профессор инфекционных заболеваний и консультант Университетского колледжа Корка (UCC), должна возглавить группу, которая будет консультировать правительство по государственным департаментам по использованию экспресс-тестов в их секторах.
В своем заявлении министр здравоохранения Стивен Доннелли заявил, что «твердо уверен, что быстрые тесты могут сыграть большую роль в нашей борьбе с Covid».
Профессор Мэри Хорган сказала, что «поскольку COVID-19 будет с нами в течение некоторого времени, мы должны использовать все доступные нам инструменты, чтобы жить в безопасности».
«Наши меры общественного здравоохранения обеспечивают уровни защиты от вируса, который продолжает нас удивлять», – сказала она.
«Экспресс-тестирование следует рассматривать как дополнительный уровень к существующим мерам защиты, таким как вакцинация, ПЦР-тестирование, маски для лица, отслеживание контактов и социальное дистанцирование.”
Другие члены группы включают Джеффа Коннелла из Национальной справочной лаборатории по вирусам, Рэйчел Кенна, старшего медсестры Министерства здравоохранения.
Пит Ланн из ESRI, Ниам О’Бейрн из HSE, профессора Пэдди Мэллон, Кингстон Миллс и Пэт О’Махони, а также доктора Анна-Роуз Прайор и доктор Бреда Смит также войдут в группу.
– С сообщениями Грайн Ни Аодха и Лорен Боланд
Паспорт вирусного онколиза через ингибирование PKR
Биомарк Рак.2016; 8: 101–110.
Джанаина Фернандес
1 NUMPEX-BIO, Campus Xerém, Федеральный университет Рио-де-Жанейро, Дуке-де-Кашиас, Рио-де-Жанейро, Бразилия.
2 Институт трансляционных исследований в области здравоохранения и окружающей среды в регионе Амазонки – INPeTAm, Федеральный университет Рио-де-Жанейро, Рио-де-Жанейро, Бразилия.
1 NUMPEX-BIO, Campus Xerém, Федеральный университет Рио-де-Жанейро, Дуке де Кашиас, Рио-де-Жанейро, Бразилия.
2 Институт трансляционных исследований в области здравоохранения и окружающей среды в регионе Амазонки – INPeTAm, Федеральный университет Рио-де-Жанейро, Рио-де-Жанейро, Бразилия.
Поступило 26 февраля 2016 г .; Пересмотрено 28 июня 2016 г .; Принято 7 июля 2016 г.
Автор (ы), издатель и лицензиат, 2016 г. , Libertas Academica Ltd. Эта статья цитируется в других статьях в PMC.
, Libertas Academica Ltd. Эта статья цитируется в других статьях в PMC.Abstract
Трансформирующие свойства онкогенов проистекают из мутаций, связанных с усилением функции, сдвигающих передачу клеточных сигналов от строго регулируемого гомеостатического к неконтролируемому онкогенному состоянию, с вкладом инактивирующих мутаций в генах-супрессорах опухолей P53 и RB, приводящих к опухоли. устойчивость к традиционной и целевой терапии.С другой стороны, этот сценарий выполняет два требования для онколитической вирусной инфекции в опухолевых клетках: инактивация опухолевых супрессоров и присутствие онкопротеинов, а также требования для выявления злокачественных новообразований. Некоторые из этих онкогенов оказывают негативное влияние на основную противовирусную защиту интерферона, двухцепочечную РНК-активируемую протеинкиназу (PKR), которая помогает вирусам спонтанно нацеливаться на опухолевые клетки вместо нормальных клеток. Этот обзор сосредоточен на отрицательном влиянии избыточной экспрессии онкогенов на традиционную и таргетную терапию и их положительном влиянии на вирусный онколиз из-за их способности ингибировать блокировку трансляции, вызванную PKR, что способствует высвобождению вирионов и гибели клеток.
Ключевые слова: онкогены, вирусный онколиз, интерферон, PKR, клиническое испытание
Введение
Онкогены были впервые идентифицированы в ретровирусах и первоначально считались ретровирусными, но дальнейшие исследования подтвердили, что эти гены были захвачены ретровирусов от млекопитающих-хозяев, что приводит к экспрессии измененных версий генов млекопитающих. 1 Трансформирующие свойства онкогенов проистекают из мутаций с усилением функции, переходящих от строго регулируемой гомеостатической передачи сигналов к неконтролируемому онкогенному состоянию. 2 Наиболее хорошо охарактеризованными онкогенами, измененными в опухолях, являются рецепторная тирозинкиназа, рецептор эпидермального фактора роста (EGFR), 3 RAS, 4 фосфоинозитид-3-киназа (PI3K) / AKT, 5 и MEK / ERK . 6
Поскольку онкогены являются частью сигнальных путей пролиферации и выживания, их сверхэкспрессия широко связана с образованием опухолей, прогрессированием и устойчивостью к традиционной химиотерапии. 7 Соответственно, фармакологическое ингибирование этих молекул увеличивает эффективность химиотерапии и лучевой терапии, 8 , 9 указывая на них для таргетной терапии. 10 , 11 Однако успех направленной на мишень терапии подвергается сомнению из-за высокой частоты мутаций, которые изменяют цель, что приводит к разработке последовательных поколений лекарств для одной и той же мишени. 12
7 Соответственно, фармакологическое ингибирование этих молекул увеличивает эффективность химиотерапии и лучевой терапии, 8 , 9 указывая на них для таргетной терапии. 10 , 11 Однако успех направленной на мишень терапии подвергается сомнению из-за высокой частоты мутаций, которые изменяют цель, что приводит к разработке последовательных поколений лекарств для одной и той же мишени. 12
Кроме того, инактивирующие мутации генов-супрессоров опухолей (p53, pRB) 13 , 14 и подавление белков, участвующих в путях смерти 15 , также способствуют устойчивости к опухоли.Этот сценарий, однако, чрезвычайно подходит для вирусного онколиза, лизиса опухолевой клетки, опосредованного вирусами, которые инфицируют и размножаются внутри них. 16 , 17
Вирусный онколиз
Онколиз может быть достигнут с помощью встречающихся в природе онколитических вирусов, чья вирусная селективность по отношению к опухолевым клеткам регулируется отсутствием факторов, нарушающих вирусную пролиферацию в клетке-хозяине (как INF ответ типа I), 18 отсутствие функциональных белков-супрессоров опухоли (p53 или pRb), 19 и сверхэкспрессия факторов прогрессии опухоли, которые приводят к активации передачи сигналов выживания. 20
20
С другой стороны, лизис нормальных клеток природными онколитическими вирусами не является успешным, поскольку сохраняются защитный ответ хозяина, супрессор опухоли и передача сигналов физиологического выживания. Кроме того, сами эти вирусы не обладают белками, которые нейтрализуют защиту нормальных клеток хозяина. Таким образом, при доставке в систему они спонтанно нацелены на опухоль, а не на нормальные клетки. 21
Немногие встречающиеся в природе онколитические вирусы доступны для лечения рака.Вирусы, которые инфицируют нормальные клетки человека и вызывают заболевание, могут быть изменены и стать пригодными для вирусного онколиза. Стратегия включает удаление факторов вирулентности и других генов, которые не являются критическими для инфицирования опухолевых клеток, но жизненно важны для репликации вируса в нормальных клетках, искусственно создавая селективность против опухоли. 22
Благодаря этой селективности по отношению к опухолевым клеткам онколитические вирусы обладают способностью вызывать регрессию рака, не затрагивая нормальные ткани, что положило начало ранним исследованиям онколитических вирусов. 23 , 24 Вирусы являются обязательными внутриклеточными паразитами, размножение которых зависит от клеток-хозяев; таким образом, несколько видов вирусов эволюционировали не только для того, чтобы использовать аппарат клетки-хозяина, но также для модуляции основных клеточных путей для достижения максимальной эффективности с развитием рака в результате некоторых вирусных инфекций. 25
23 , 24 Вирусы являются обязательными внутриклеточными паразитами, размножение которых зависит от клеток-хозяев; таким образом, несколько видов вирусов эволюционировали не только для того, чтобы использовать аппарат клетки-хозяина, но также для модуляции основных клеточных путей для достижения максимальной эффективности с развитием рака в результате некоторых вирусных инфекций. 25
Несмотря на то, что рецепторы клеточной поверхности являются основным признаком, позволяющим этим вирусам инфицировать клетку-мишень, 26 способ взаимодействия внутриклеточных путей с вирусным геномом и вирусными белками, который считается жизненно важным для пролиферации вирусов, также является важным. важный.Опухоль-специфический естественный или генно-инженерный тропизм в значительной степени основан на дефекте интерферонового ответа типа I (IFN) многих опухолевых клеток. 18 , 27 В нормальных тканях активация IFN приводит к ингибированию репликации вируса. 28
28
Вирусный онколиз, зависящий от инактивации PKR
Система противовирусной защиты начинает действовать через распознавание вирусных нуклеиновых кислот семейством внутриклеточных Toll-подобных рецепторов (TLR).В то время как оцРНК связывает TLR-7, дцРНК связывает TLR-3. TLR находятся в тех же сайтах, где вирус проникает в клетку. 29 TLR затем индуцируют внутриклеточную передачу сигналов, которая приводит к активации регуляторных факторов IFN (IRF) -3, IRF-7 и ядерного фактора-каппа-бета (NFκB) и последующей транскрипционной активации IFNα и IFNβ. Высвобождаемые IFN связываются с его рецепторами, что приводит через STAT3 к транскрипции генов-мишеней, в том числе PKR, двухцепочечной РНК-активируемой протеинкиназы. 30
PKR содержит дцРНК-связывающий домен, который связывается с дуплексными областями, присутствующими в вирусных РНК, что приводит к димеризации, активации киназ и аутофосфорилированию PKR. 31 Активированные PKR катализируют фосфорилирование eIF2a, фактора инициации трансляции-2 (elF2), блокируя его способность рециркулировать гуанозин-5′-трифосфат (GTP). Без рециклинга elF2 становится недоступным для образования комплекса с Met-тРНК, нарушая инициацию трансляции. Таким образом, PKR является ключевым медиатором индуцированного IFN типа I противовирусного ответа, действуя как цитозольный сенсор вирусной дцРНК.В нормальных клетках этот сценарий приводит к ингибированию репликации вирусного генома и лизиса клеток, опосредованных высвобождением вириона. 32 Кроме того, активация PKR также вызывает апоптоз через FADD-опосредованные 33 и митохондриальные пути (). 34
Без рециклинга elF2 становится недоступным для образования комплекса с Met-тРНК, нарушая инициацию трансляции. Таким образом, PKR является ключевым медиатором индуцированного IFN типа I противовирусного ответа, действуя как цитозольный сенсор вирусной дцРНК.В нормальных клетках этот сценарий приводит к ингибированию репликации вирусного генома и лизиса клеток, опосредованных высвобождением вириона. 32 Кроме того, активация PKR также вызывает апоптоз через FADD-опосредованные 33 и митохондриальные пути (). 34
Вирусный онколиз зависит от инактивации РНК-активированной протеинкиназы (PKR) . В нормальных клетках ( A ) присутствие онколитических вирусов активирует путь интерферона I типа, что приводит к экспрессии и активации PKR.Активированный PKR фосфорилирует elF2α, нарушая рециклинг GTP и блокируя трансляцию клеток. Присутствие PKR может вызвать апоптоз инфицированной клетки. В опухолевых клетках ( B ), где нарушена реакция на интерферон I типа, онколитические вирусы не индуцируют экспрессию PKR, что позволяет рециклировать GTP в elF2α и трансляцию вирусного белка..jpg)
Большинство вирусов эволюционировали, чтобы преодолеть этот барьер. Некоторые из них несут в своих геномах белки, которые ингибируют активацию PKR посредством прямого взаимодействия, такие как E3L и K3L из вируса осповакцины, 35 прямое связывание с PKR без активации киназного домена, 36 и ингибирование димеризации PKR вирусом гепатита С. 37 Кроме того, клеточные белки также могут быть задействованы вирусами для ингибирования функции PKR 38 и рекрутирования клеточных фосфатаз, действующих непосредственно на статус фосфорилирования elF2, 39 , минуя эффекты активации PKR. С другой стороны, в опухолевых клетках связь между INF и PKR может быть нарушена либо внутренними изменениями в генетике опухоли, такими как делеция и / или потеря гетерозиготности в 9p21, где INF-α, INF-β и другие INF-связанные расположены гены, , 40, и сверхэкспрессия онкогенов, таких как RAS (). 41
Роль онкогенов в блокаде трансляции, индуцированной PKR . При сверхэкспрессии онкогенов, таких как РАС и его нижестоящие эффекторы, реакция на интерферон I типа нарушается в нескольких точках. Точечные мутации, которые делают эти мишени устойчивыми к терапии, сохраняют свою активность, что влияет на транскрипцию PKR и ее активацию. Наряду с ингибированием PKR сверхэкспрессия PI3K / Akt / mTor приводит к репрессии репрессора трансляции 4E-BP1, высвобождая elF4E с образованием комплекса инициации трансляции, способствуя трансляции вирусного белка.
При сверхэкспрессии онкогенов, таких как РАС и его нижестоящие эффекторы, реакция на интерферон I типа нарушается в нескольких точках. Точечные мутации, которые делают эти мишени устойчивыми к терапии, сохраняют свою активность, что влияет на транскрипцию PKR и ее активацию. Наряду с ингибированием PKR сверхэкспрессия PI3K / Akt / mTor приводит к репрессии репрессора трансляции 4E-BP1, высвобождая elF4E с образованием комплекса инициации трансляции, способствуя трансляции вирусного белка.
Онкоген-зависимый онколиз (естественный тропизм и / или генетическая трансформация)
Конвергенция как онкогенов, так и некоторых молекул, кодируемых вирусами, к PKR связана с основным условием опухолевой пролиферации и вирусной инфекции: поддержанием или усилением синтеза белка темп. 42 Онколитические вирусы с естественным тропизмом обнаруживают, что PKR инактивирована в опухолях из-за сверхэкспрессии онкогена или конститутивной активации. Реовирус, повсеместно распространенный, необолочечный двухцепочечный РНК-вирус, был первым естественным вирусом человека, который, как сообщается, использует передачу сигналов онкогена в клетке-хозяине для индукции лизиса клеток. 43 , 44 Понимание того, что онкогены могут спонтанно ингибировать PKR, открыло возможность манипулировать другими вирусами, которые обычно не вызывают заболевания у людей из-за активации PKR, для инфицирования устойчивых опухолей. Другая стратегия включает удаление ингибиторов PKR, переносимых самими вирусами, и других факторов вирулентности из вирусов человека, 45 позволяя им размножаться в опухолях, но не в неопухолевых клетках. Кроме того, эти вирусы также можно использовать в качестве векторов, несущих гены, экспрессия которых снижена в опухолях. 46
43 , 44 Понимание того, что онкогены могут спонтанно ингибировать PKR, открыло возможность манипулировать другими вирусами, которые обычно не вызывают заболевания у людей из-за активации PKR, для инфицирования устойчивых опухолей. Другая стратегия включает удаление ингибиторов PKR, переносимых самими вирусами, и других факторов вирулентности из вирусов человека, 45 позволяя им размножаться в опухолях, но не в неопухолевых клетках. Кроме того, эти вирусы также можно использовать в качестве векторов, несущих гены, экспрессия которых снижена в опухолях. 46
Характеристика взаимодействия онкогенов с PKR показала, что онкогены играют несколько ролей в онколизе опухолей, а иногда их роль перекрывается, причем некоторые из них присутствуют в одном и том же сигнальном каскаде. 47 Либо с врожденным тропизмом, либо с помощью генной инженерии, несколько онколитических путей сходятся к RAS, PI3K и его нижележащим эффекторам, делая онкогены, такие как RAS, RAF, MEK, ERK и AKT, «золотыми билетами» для вирусных инфекций. онколиз, чтобы добиться успеха.
онколиз, чтобы добиться успеха.
RAS
Физиологически Kras, гомолог вируса саркомы мышей Кирстен, 48 и его изоформы соединяют активированные рецепторы клеточной поверхности со своими внутриклеточными эффекторными путями. При связывании с GTP и гуанозиндифосфатом (GDP) RAS чередуется между активной и неактивной формами соответственно. Активирующие мутации в белках RAS приводят к поддержанию GTP-связанного состояния и независимой от рецептора конститутивной передачи сигналов. После активации Ras рекрутирует и активирует Raf, который фосфорилирует и активирует MEK, единственным известным субстратом которого являются киназы ERK.Активная ERK перемещается в ядро и индуцирует фосфорилирование нескольких мишеней и транскрипцию генов, участвующих в прогрессировании рака и подавлении противовирусного ответа. 4 Эта модульная структура делает RAS основным драйвером, а его нижестоящие эффекторы могут контролировать активность PKR либо через активацию своих эффекторов вниз по каскаду, либо действуя дополнительными путями, чтобы разрешить вирусный онколиз.
Ras может регулировать активность PKR несколькими способами, включая модуляцию индуцированной INF транскрипции, что снижает экспрессию PKR. 49 Экспрессия IRF-1 модулируется с помощью MEK-подавляющих IFN-индуцируемых генов, которые, в свою очередь, могут отрицательно регулироваться RAS / MEK, что делает возможной вирусный онколиз. 50 Ras важен для удаления оболочки и инфекционности реовируса. 51 В модифицированном вирусе простого герпеса типа 1 (HSV-1) передача сигналов Ras также диктует пермиссивность клеток-хозяев. 52 Эти и другие исследования в основном основаны на фармакологических ингибиторах пути передачи сигналов Ras и трансформации клеток с помощью RAS, но нет доказательств физического взаимодействия между RAS и PKR.Более того, существует несколько прямых демонстраций того, как нижестоящие эффекторы регулируют активность PKR.
RAF
Raf, гомолог вирусного онкогена мышиной саркомы v-Raf, семейство протеинкиназ (A-RAF, B-RAF и C-RAF, также известное как RAF-1), действует как центральное звено между Ras и нижележащими киназами MEK и ERK. 53 , 54 Активирующие мутации в членах семейства Raf могут сделать независимость от активации Ras 55 и резистентность к таргетной терапии. 56 Одна из наиболее изученных мутаций Raf (B-RAF V600E ) также участвует в пермиссивности вирусного онколиза. 57
53 , 54 Активирующие мутации в членах семейства Raf могут сделать независимость от активации Ras 55 и резистентность к таргетной терапии. 56 Одна из наиболее изученных мутаций Raf (B-RAF V600E ) также участвует в пермиссивности вирусного онколиза. 57
Было показано решающее участие Raf-1 в качестве промежуточного звена каскада Ras, позволяющего подавлять путь JAK / STAT, поскольку нокдаун Raf-1 ингибирует репликацию вируса гепатита С. 58 Raf-1 важен не только как часть каскада митоген-активируемых протеинкиназ (MAPK), но и непосредственно способствует успешной репликации вируса.При парвовирусном онколизе фосфорилирование белков VP (вирусного капсида) киназой Raf-1 по Ser-2, -6 и -10 на N-концевом домене VP2 важно для ядерной транслокации и образования капсида промежуточных продуктов сборки MVM. . 59
MEK / ERK
MEK является ключевой регуляторной киназой, активируемой киназами RAF. Активирующие мутации в вышестоящих членах каскада приводят к конститутивной активации MEK и ее субстратов, ERK1 и ERK2, в большом проценте опухолей, указывая на MEK и ERK1 / 2 как на фармакологические мишени в терапии рака. 60
Активирующие мутации в вышестоящих членах каскада приводят к конститутивной активации MEK и ее субстратов, ERK1 и ERK2, в большом проценте опухолей, указывая на MEK и ERK1 / 2 как на фармакологические мишени в терапии рака. 60
Устойчивость к ингибитору MEK связана в основном с активирующей мутацией MEK Q60P , что делает ее независимой от активации RAS, 61 и активации альтернативной активации PI3K / AKT, что приводит к комбинированным стратегиям, путем ингибирования обоих МЕК и АКТ. 62 Когда ERK фосфорилируется с помощью MEK, гены, участвующие в продукции IFN, такие как IRF-1 и STAT2, подавляются. 20 , 50 Таким образом, опухоли, устойчивые к ингибиторам MEK, будут поддерживать подавление PKR, что делает возможным вирусный онколиз.
Кроме того, с его ролью в инактивации PKR через ее нижестоящие эффекторы также была показана важность самой MEK для онколиза опухоли. Smith et al. 63 показали, что активированная MEK подавляет активацию PKR в мутантном HSV, и они пришли к выводу, что MEK может прямо или косвенно ингибировать активность PKR. Это предположение было подтверждено исследованиями гиперплазии интимы сосудов с использованием HSV-1. 64
Это предположение было подтверждено исследованиями гиперплазии интимы сосудов с использованием HSV-1. 64
MAPKAPKs
При активации сигнального модуля MAPK есть дополнительные нижестоящие проигрыватели, которые также могут деактивировать ответ PKR.Среди мишеней MAPKs – активируемые MAPK протеинкиназы (MAPKAPK), которые включают MK2 и MK3. Активация трех основных каскадов модуля MAPK, ERK, p38 и JNK, сходится к MK2 и MK3 с ERK и p38 в качестве их основных активаторов. 65 MK2 и MK3 играют важную роль в воспалении, 66 регуляции клеточного цикла, 67 и миграции клеток. 68 В опухолевых клетках, где его вышестоящие регуляторы (такие как RAS и RAF) каскада сверхэкспрессированы, активные MK2 и MK3 могут взаимодействовать с комплексом, содержащим репрессор ингибитора PKR (p88r IPK ), ингибитор PKR p58 IPK и сам PKR, что приводит к подавлению активности PKR и последующему сохранению функции elF2. 69 Интересно, что сверхэкспрессия ингибитора PKR p58 IPK может вызывать злокачественную трансформацию. 70
69 Интересно, что сверхэкспрессия ингибитора PKR p58 IPK может вызывать злокачественную трансформацию. 70
Дополнительные результаты этого исследования показали, что киназы MK2 и MK3 фосфорилируются и активируются в клеточной линии рака легких при инфицировании вирусом гриппа; что размножение вируса гриппа A сильно снижено в мышиных фибробластах, дефицитных либо по MK2, либо по MK3; и что активация МК снижает активность PKR. 69
PI3K / Akt / mTOR
AKT представляет собой серин / треонин киназу, является одной из нижестоящих мишеней, активируемых фосфоинозитид-3-киназой (PI3K), и, как и другие онкогены, AKT был назван в честь гомолога вирусного онкогена. (v-Akt) присутствует в ретровирусе мышиного лейкоза AKT8. 71 Akt является ключевым регулятором важных клеточных функций, включая выживание клеток, пролиферацию, метаболизм глюкозы и синтез белка. 72 В большинстве раковых клеток человека путь Akt либо мутирован, либо конститутивно активирован, что приводит к прогрессированию рака за счет неконтролируемой пролиферации клеток и ингибирования апоптоза.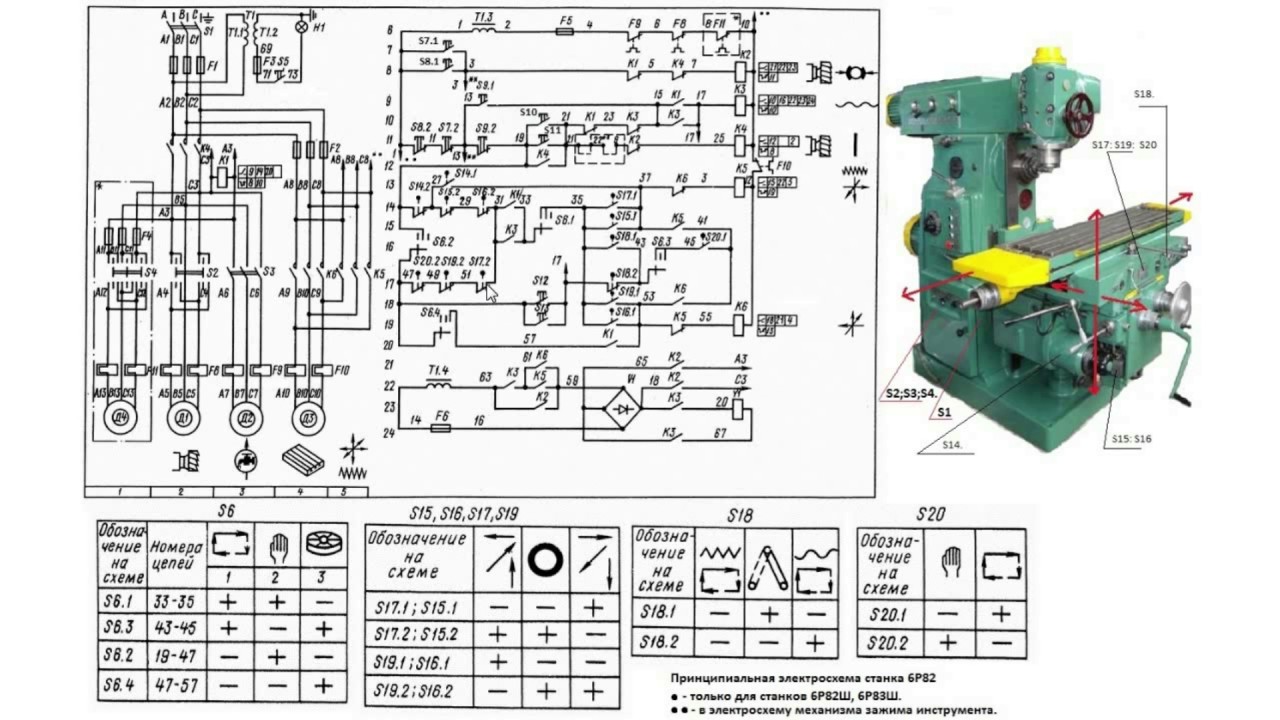 73
73
Важность AKT для вирусного онколиза была продемонстрирована для репликации вируса миксомы в клетках рака легких человека, где требуется киназная активность Akt, 74 , в то время как клетки без фосфорилированного Akt не были инфицированы.То же самое наблюдалось при метастатическом раке яичников, на который также напрямую влияет AKT. 75 Влияние mTOR на синтез белка зависит от регуляции факторов инициации трансляции 4E-связывающих белков (4E-BP), способствующих инициации трансляции. 76 Путь может кооперативно модулироваться нижестоящими эффекторами как RAS, так и AKT. 77 Sarinella et al. 78 обнаружили, что онколиз опухоли поджелудочной железы HSV-1 зависит не от активации RAS, а от PI3K в предполагаемом механизме, который включает модуляцию elF2B посредством ингибирования GSK-3, что приводит к независимости PKR. положение дел.
Статус белка-супрессора опухоли и PKR
Инактивирующие мутации, обнаруженные в супрессорах опухоли Rb и p53, связанные со сверхэкспрессией RAS, могут приводить к онкогенезу, 79 прогрессированию опухоли и устойчивости к лекарствам. Среди функций, выполняемых p53, – контроль клеточного цикла и активация транскрипции проапоптотических белков, а также p53 взаимодействует с промотором PKR, что приводит к его экспрессии. 80 Центральная роль p53 в индукции клеточной гибели побудила несколько видов вирусов разработать стратегии ингибирования активности p53 и Rb в нормальных клетках. 81 В опухолевых клетках вирусный тропизм усиливается там, где эти белки не функционируют. 19
Среди функций, выполняемых p53, – контроль клеточного цикла и активация транскрипции проапоптотических белков, а также p53 взаимодействует с промотором PKR, что приводит к его экспрессии. 80 Центральная роль p53 в индукции клеточной гибели побудила несколько видов вирусов разработать стратегии ингибирования активности p53 и Rb в нормальных клетках. 81 В опухолевых клетках вирусный тропизм усиливается там, где эти белки не функционируют. 19
Белок Rb (белок 1 восприимчивости ретинобластомы) ингибирует прогрессирование клеточного цикла от G1 к S-фазе. При фосфорилировании циклином D, циклин-зависимой киназой 4 (CDK4) и CDK6 Rb становился неактивным, что позволяло пролиферацию. Сверхактивация вышестоящих регуляторов, мутация или делеция Rb способствует пролиферации опухоли. 82
Недавно Kline et al. 83 показали, что активация фактора транскрипции 4 (ATF4) в ответ на небольшую молекулу требует активности PKR с последующим фосфорилированием eIF2α. Этот путь также индуцировал дефосфорилирование белка ретинобластомы (Rb), что приводило к ингибированию прогрессирования клеточного цикла. Это один из примеров того, как при фармакологической активации PKR и Rb способствуют гибели опухолевых клеток.
Этот путь также индуцировал дефосфорилирование белка ретинобластомы (Rb), что приводило к ингибированию прогрессирования клеточного цикла. Это один из примеров того, как при фармакологической активации PKR и Rb способствуют гибели опухолевых клеток.
Дисфункциональные или удаленные p53, ATM и Rb придавали повышенную восприимчивость к инфекционности, репликации и цитолизу вирусов реовируса и миксомы в опухолевых клетках по сравнению с клетками, в которых эти молекулярные активности сохранены. 17 Были выполнены модификации аденовируса для нацеливания на Rb-дефектные клетки. 84 Отсутствие активности p53 и присутствие активированного RAS сильно снижает экспрессию и активность PKR, наряду с инактивацией Rb, что создает благоприятную среду для репликации онколитических вирусов.
Клинические испытания
Нацеливание на несколько онколитических вирусов при клинических испытаниях может быть спонтанным, поскольку эти вирусы распознают опухолевые клетки, которые сверхэкспрессируют поверхностные молекулы, такие как сиаловая кислота, CD46 и нектины, среди прочих, что определяет тропизм к этим клеткам. 85 Вирусы также могут быть сконструированы для распознавания рецепторов клеточной поверхности определенных типов опухолей, таких как аденовирус Ad5 / 3-Δ24, который был модифицирован для связывания с интегринами поверхности клеток рака яичников. 86 Взаимодействие между избыточной экспрессией онкогена, статусом гена-супрессора опухоли и ответом IFN-1 было изучено в клинических испытаниях с использованием вирусов, которые используют преимущества молекулярных изменений опухоли.
85 Вирусы также могут быть сконструированы для распознавания рецепторов клеточной поверхности определенных типов опухолей, таких как аденовирус Ad5 / 3-Δ24, который был модифицирован для связывания с интегринами поверхности клеток рака яичников. 86 Взаимодействие между избыточной экспрессией онкогена, статусом гена-супрессора опухоли и ответом IFN-1 было изучено в клинических испытаниях с использованием вирусов, которые используют преимущества молекулярных изменений опухоли.
Неспособность задействовать передачу сигналов IFN типа I обеспечивает репликативное преимущество для спонтанных онколитических вирусов, таких как вирус болезни Ньюкасла (NDV), парамиксовирус, который является низкопатогенным для человека, но очень заразным для видов птиц.NDV очень чувствителен к IFN-ответу типа I, который этот вирус вызывает в нормальных клетках, что придает его специфичность для раковых клеток. 87 Аттенуированный NDV был протестирован на пациентах с меланомой, глиобластомой, головой и шеей, распространенным колоректальным раком и другими злокачественными новообразованиями. 88 Использовался как живой вирус 89 или онколизаты NDV. 90 Другими вирусами этой группы, онколитический потенциал которых уже был протестирован клинически, являются вирус Сендай, 91 вирус кори, 92 и вирус эпидемического паротита. 93 У пациентов обычно развивались гриппоподобные симптомы, и летальных исходов, связанных с вирусной инфекцией, не было.
88 Использовался как живой вирус 89 или онколизаты NDV. 90 Другими вирусами этой группы, онколитический потенциал которых уже был протестирован клинически, являются вирус Сендай, 91 вирус кори, 92 и вирус эпидемического паротита. 93 У пациентов обычно развивались гриппоподобные симптомы, и летальных исходов, связанных с вирусной инфекцией, не было.
Производство вирусных РНК реовирусом, одним из наиболее хорошо изученных спонтанных онколитических вирусов, приводит к активации PKR в нормальных клетках. С другой стороны, сверхэкспрессия RAS нарушает путь PKR, что приводит к преимущественному инфицированию опухолевых клеток реовирусом. 44 Реолизин ® – штамм, вызывающий реовирус серотипа-3, Oncolytics Biotech Inc., очищенный живой реовирус, способный к репликации, индуцирует цитолиз в опухолевых клетках с активированным путем ras из-за ингибирования PKR. Введение реолизина было безопасным и хорошо переносимым, показало частичный ответ и / или стабильное заболевание у пациентов с раком груди, глиомами, меланомой и раком яичников, колоректальным раком 94 , метастатической аденокарциномой поджелудочной железы и раком легких, 95 меланомой и саркома головы и шеи. 96 С другой стороны, Реолизин не показал объективных ответов у пациентов с рецидивирующей и рефрактерной множественной миеломой. 97
96 С другой стороны, Реолизин не показал объективных ответов у пациентов с рецидивирующей и рефрактерной множественной миеломой. 97
Важность белков-супрессоров опухолей для вирусного онколиза также изучалась в клинических испытаниях. E1B – это белок, который взаимодействует с p53, позволяя инфицировать нормальные клетки аденовирусом дикого типа. 98 ONYX-015 / h201 (OncorineR) представляет собой аденовирус с делецией гена E1B-55 кДа, созданный для селективной репликации и лизиса раковых клеток с дефицитом р53. 99 ONYX-015 был впервые протестирован на людях в исследованиях фазы I и II с внутриопухолевой и перитуморальной инъекцией в 2000 г., 100 , 101 , что привело к многообещающим результатам в целом на p53-дефицитных раковых клетках как изначально задумано.
В дополнение к этой модификации вирус ONYX-015 «вооружен» генами, которые усиливают иммунологический ответ на опухоль, такими как гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). 22 Эту конструкцию также использовали в комбинации с адъювантной химиотерапией митомицином С, доксорубицином и цисплатином. 102 Наиболее частыми побочными эффектами были симптомы гриппа. Смертельные случаи не были связаны с вирусной инфекцией, и предельная доза не определялась. 88
22 Эту конструкцию также использовали в комбинации с адъювантной химиотерапией митомицином С, доксорубицином и цисплатином. 102 Наиболее частыми побочными эффектами были симптомы гриппа. Смертельные случаи не были связаны с вирусной инфекцией, и предельная доза не определялась. 88
Способность HSV-1 вызывать заболевание у людей зависит от белков, которые способны влиять на передачу сигналов INF-1, активность PKR и белки-супрессоры опухоли.Поэтому были выполнены важные модификации, чтобы сделать этот вирус безопасным для клинического использования: (а) делеция тимидинкиназы (ТК), белка, участвующего в синтезе и репарации ДНК, 103 , где экспрессия его клеточного гомолога коррелирует со злокачественными новообразованиями. ; 104 (b) делеция гена ICP 34.5, который кодирует фосфатазу, дефосфорилирующую PKR, обеспечивая синтез белка; и (c) делеция ICP47, которая блокирует презентацию антигена в инфицированных клетках путем ингибирования транспортеров TAP1 и TAP2. Эти изменения были объединены в штамме HSV JS1 (JS1 / 34.5- / 47-), 105 , и его клиническое использование было оценено для лечения опухолей головы и шеи и показало высокие показатели полного ответа, отсутствие рецидивов и длительное выживаемость без прогрессирования заболевания наблюдалась у двух третей пациентов, что решительно поддерживает дальнейшие клинические исследования. 106 Не менее впечатляющие результаты были достигнуты и при неоперабельной метастатической меланоме. 107
Эти изменения были объединены в штамме HSV JS1 (JS1 / 34.5- / 47-), 105 , и его клиническое использование было оценено для лечения опухолей головы и шеи и показало высокие показатели полного ответа, отсутствие рецидивов и длительное выживаемость без прогрессирования заболевания наблюдалась у двух третей пациентов, что решительно поддерживает дальнейшие клинические исследования. 106 Не менее впечатляющие результаты были достигнуты и при неоперабельной метастатической меланоме. 107
JX-594 (Pexa-Vec) представляет собой онколитическую вакцину, созданную на основе вакцинного штамма Wyeth.Он нарушает как ген TK, так и экспрессию человеческого GM-CSF, что индуцирует опухолеспецифический иммунитет. 108 JX-594 был протестирован на гепатоцеллюлярной карциноме с использованием системной доставки, и результаты показали сильное влияние на снижение массы опухоли и выживаемость пациентов. 109 JX-594 также был протестирован на пациентах с нейробластомой и саркомой Юинга с ограниченными преимуществами. 110
110
В совокупности клинические испытания как с аттенуированными, так и с генетически модифицированными вирусами показали, в основном, что успех виротерапии зависит от нескольких факторов, таких как способ введения, при этом внутриопухолевые инъекции показывают лучшие результаты по сравнению с инфузией из-за выработки нейтрализующих антител против несколько штаммов, 111 , 112 , если вирус используется в качестве монотерапии или в комбинации с другими лекарствами или иммуномодулирующими стратегиями. 108 Преимущества включают различную степень ремиссии опухоли, повышение уровня свободной выживаемости и качество жизни пациентов. 113 Сама по себе виротерапия хорошо переносилась и не вызывала смерти пациента, а наиболее частыми побочными эффектами были симптомы гриппа, такие как усталость и лихорадка. 100
Устойчивость к вирусному онколизу
Даже с его высокой эффективностью в устранении опухолей, при которых химиотерапия не удалась, вирусный онколиз также сталкивается с устойчивостью. Если некоторые из онкогенов, которые делают возможным вирусный онколиз, являются факторами резистентности как в традиционной, так и в целевой терапии, как возникает резистентность при вирусном онколизе? Поддержание ответов INF типа I способствует устойчивости к вирусному онколизу. 114 Несмотря на важность конститутивной передачи сигналов RAS для вирусного онколиза, стойкая инфекция реовирусом привела к устойчивости клеток фибросаркомы к онколизу, при этом PKR конститутивно активировалась даже в присутствии высокой активности Ras. 115
Если некоторые из онкогенов, которые делают возможным вирусный онколиз, являются факторами резистентности как в традиционной, так и в целевой терапии, как возникает резистентность при вирусном онколизе? Поддержание ответов INF типа I способствует устойчивости к вирусному онколизу. 114 Несмотря на важность конститутивной передачи сигналов RAS для вирусного онколиза, стойкая инфекция реовирусом привела к устойчивости клеток фибросаркомы к онколизу, при этом PKR конститутивно активировалась даже в присутствии высокой активности Ras. 115
Избыточная экспрессия онкогена CUG2 активирует STAT1, что приводит к устойчивости опухоли к вирусу везикулярного стоматита за счет поддержания активности PKR. 116 В дополнение к активности PKR через персистентность ответа INF типа I, резистентность к онколизу может возникать в результате системного удаления вируса иммунной системой хозяина; 117 снижение вирусных рецепторов на клетках-мишенях 118 стало важным барьером для вирусного онколиза, поскольку поверхностный рецептор является основным признаком, используемым вирусами для заражения клеток-хозяев. Стабилизация сурвивина может привести к устойчивости субпопуляций раковых клеток к NDV 119 ; и устойчивость к вирусному онколизу может быть приобретена во время злокачественного прогрессирования. 120
Стабилизация сурвивина может привести к устойчивости субпопуляций раковых клеток к NDV 119 ; и устойчивость к вирусному онколизу может быть приобретена во время злокачественного прогрессирования. 120
Солидные опухоли менее организованы по своей структуре и сосудистости из-за дефектов краев опухоли и аберрантного ангиогенеза. 121 Кроме того, внеклеточный матрикс влияет на онколиз солидных опухолей, что приводит к снижению распространения вируса. 122 , 123 Эти проблемы привели к появлению методов лечения, сочетающих онколитическую виротерапию посредством внутриопухолевых инъекций с традиционными противоопухолевыми препаратами 124 или таргетными препаратами, 125 с многообещающими результатами.
Модуляция иммунного ответа
Модуляция иммунного ответа также является важным фактором устойчивости к онколизу. Существующие ранее или индуцированные вирусом антитела против онколитического штамма могут присутствовать в результате предыдущей вакцинации, перекрестной реакции и ответа на онколиз, нарушая системное распространение вируса. Интересным примером является перекрестная реакция между клинически протестированным онколитическим вирусом Сендай (возбудитель грызунов) и вирусом парагриппа человека типа 1 (hPIV-1). 91 Таким образом, история вакцинации пациента оказывает важное влияние на результат терапии.Кроме того, в нескольких исследованиях, в которых в качестве пути введения использовалась инфузия, эффективность онколиза была снижена в целом для метастатических опухолей по сравнению с внутриопухолевой инъекцией. 126
Интересным примером является перекрестная реакция между клинически протестированным онколитическим вирусом Сендай (возбудитель грызунов) и вирусом парагриппа человека типа 1 (hPIV-1). 91 Таким образом, история вакцинации пациента оказывает важное влияние на результат терапии.Кроме того, в нескольких исследованиях, в которых в качестве пути введения использовалась инфузия, эффективность онколиза была снижена в целом для метастатических опухолей по сравнению с внутриопухолевой инъекцией. 126
Одной из важных особенностей вирусного онколиза является то, что, убивая инфицированные опухолевые клетки, вирусы обеспечивают опухолевые антигены, которые позволяют иммунной системе распознавать и убивать больше опухолевых клеток, 127 подход, который особенно важен для лечения метастатические поражения. 128 Однако микросреда опухоли может снижать эффективность иммунного ответа, что приводит к другому важному источнику устойчивости к вирусному онколизу: задействованию иммунной контрольной точки , что является следствием активации определенного набора путей, которые снижают иммунологическую эффективность. против опухолей. 129
против опухолей. 129
Белок запрограммированной гибели клеток 1 (PD1) и его лиганд (PDL-1) могут экспрессироваться как опухолевыми клетками, так и макрофагами в микроокружении опухоли, отключая Т-клетки.Экспрессия PDL-1 может также происходить как следствие транслокаций, хромосомных аберраций и активации EGFR, 130 , что приводит к уклонению от опухоли. Цитотоксический Т-лимфоцитарный антиген 4 (CTLA-4) подавляет Т-клетки в лимфоидном компартменте, ограничивая пролиферацию Т-клеток, предотвращая распространение противоопухолевых Т-клеточных ответов у онкологических больных. 131 Блокада иммунных контрольных точек включает прямое использование антител для нейтрализации путей иммунных контрольных точек (анти-PD-L1 и анти-CTLA-4), 132 также, онколитические аттенуированные вирусы (такие как вирус кори) могут использоваться в качестве векторов кодировать антитела против CTLA-4 и PD-L1, тем самым повышая эффективность вирусного онколиза. 133
133
Биомаркеры устойчивости к вирусному онколизу
Существует довольно много предложенных маркеров устойчивости к вирусному онколизу, одним из них является YAP-1 (да-ассоциированный белок) при раке головы и шеи. Его экспрессия коррелировала с устойчивостью к реовирусу, тогда как низкая экспрессия YAP-1 коррелировала с чувствительностью к реовирусной инфекции. 134 YAP-1 – кандидатный онкоген человека, сверхэкспрессируемый в опухолях легких, толстой кишки, яичников и молочной железы. 135 Этот белок является ядерным эффектором пути Hippo, который является ключевым регулятором размера органа.Однако это исследование находится в зачаточном состоянии, и необходимы дальнейшие исследования.
Заключительные замечания
Считалось, что проблема обычного химиотерапевтического ухудшения из-за сверхэкспрессии онкогена будет решена, когда была введена таргетная терапия. 136 Опять же, при таргетной терапии мишень мутировала, что привело к последовательным поколениям лекарств для преодоления устойчивости. 137 Несмотря на то, что виротерапия рака обсуждалась и тестировалась в течение последних 60 лет, 138 , 139 мы, наконец, движемся к тому, что может быть золотым веком виротерапии, с модифицированными вирусами с естественным тропизмом к опухолям в настоящее время проходит клинические испытания в качестве терапевтического средства против рака. 94 , 140
137 Несмотря на то, что виротерапия рака обсуждалась и тестировалась в течение последних 60 лет, 138 , 139 мы, наконец, движемся к тому, что может быть золотым веком виротерапии, с модифицированными вирусами с естественным тропизмом к опухолям в настоящее время проходит клинические испытания в качестве терапевтического средства против рака. 94 , 140
Использование молекулярного профиля опухолей для достижения успеха в вирусном онколизе подчеркивает важность мультидисциплинарного подхода, который сделал эту терапевтическую альтернативу доступной. Урок, извлеченный из in vitro и клинического опыта в отношении виротерапии, заключается в том, что ни один из ранее установленных подходов к клиническому лечению рака не является незаменимым. Многофакторный характер устойчивости необходимо уравновешивать несколькими стратегиями вместо монотерапии.
Использование нескольких стратегий с нулевой смертностью, включающих использование онколитических вирусов в клинических испытаниях, делает этот подход эффективным и безопасным.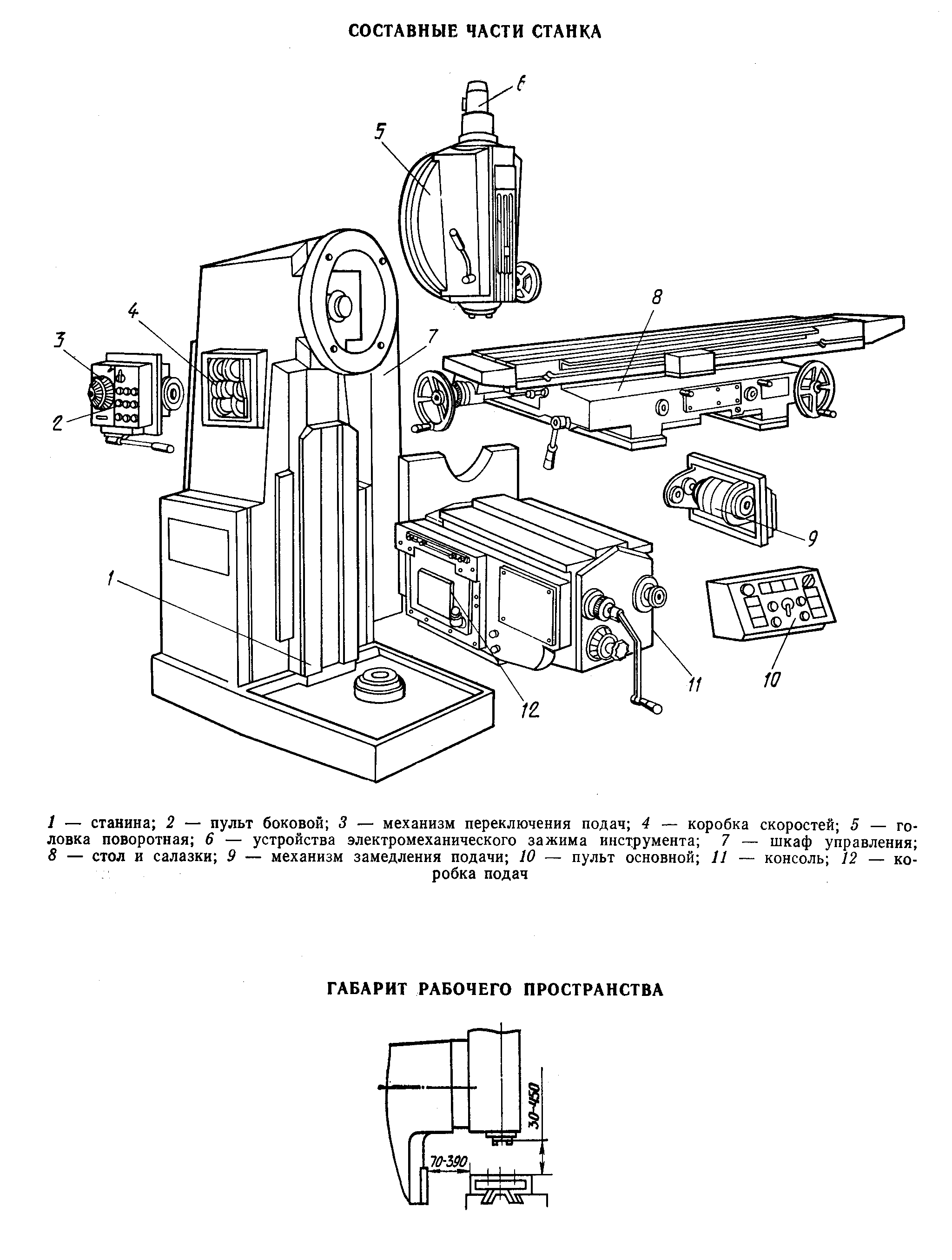 Хотя это еще не лечебное средство, оно, безусловно, увеличивает качество и продолжительность жизни пациента. 109 В отличие от других терапевтических стратегий лечения рефрактерных опухолей, при вирусном онколизе сверхэкспрессия онкогенов в основном решает, а не проблему, частично из-за ответа INF-1 и ингибирования PKR.
Хотя это еще не лечебное средство, оно, безусловно, увеличивает качество и продолжительность жизни пациента. 109 В отличие от других терапевтических стратегий лечения рефрактерных опухолей, при вирусном онколизе сверхэкспрессия онкогенов в основном решает, а не проблему, частично из-за ответа INF-1 и ингибирования PKR.
Сноски
АКАДЕМИЧЕСКИЙ РЕДАКТОР: Барбара Гуинн, главный редактор
РЕЦЕНЗИЯ: Четыре рецензента внесли свой вклад в отчет о коллегиальной проверке. В отчетах рецензентов было 641 слово, без каких-либо конфиденциальных комментариев академическому редактору.
ФИНАНСИРОВАНИЕ: Автор благодарит CNPq / INCT – Институт трансляционных исследований в области здравоохранения и окружающей среды в регионе Амазонки – INPeTAm за финансовую поддержку. Авторы подтверждают, что спонсор не имел никакого влияния на дизайн исследования, содержание статьи или выбор этого журнала.
КОНКУРЕНТНЫЕ ИНТЕРЕСЫ: Автор не сообщает о потенциальных конфликтах интересов.
Работа, прошедшая одностороннее слепое рецензирование независимым экспертом. Все редакционные решения принимаются независимым академическим редактором. При подаче рукопись была подвергнута антиплагиатной проверке. Перед публикацией все авторы подписали подтверждение согласия на публикацию статьи и соблюдение всех применимых этических и юридических требований, включая точность информации об авторе и соавторах, раскрытие конкурирующих интересов и источников финансирования, соблюдение этических требований, касающихся человека и животных. участников исследования, а также соблюдение любых требований об авторских правах третьих лиц.Этот журнал является членом Комитета по этике публикаций (COPE).
Вклад авторов
Задумал и спроектировал эксперименты: JF. Проанализированы данные: JF. Написал первый черновик рукописи: JF. Участвовал в написании рукописи: JF. Согласен с результатами и выводами рукописи: JF. Совместно разработал структуру и аргументы для статьи: JF. Внесены критические исправления и утверждена финальная версия: JF. Автор рассмотрел и одобрил окончательную рукопись.
Внесены критические исправления и утверждена финальная версия: JF. Автор рассмотрел и одобрил окончательную рукопись.
СПИСОК ЛИТЕРАТУРЫ
2. Огаки Х., Клейхуес П. Генетические изменения и пути передачи сигналов в эволюции глиом. Cancer Sci. 2009. 100 (12): 2235–2241. [PubMed] [Google Scholar] 3. Giaccone G, Wang Y. Стратегии преодоления устойчивости к ингибиторам тирозинкиназы семейства EGFR. Cancer Treat Rev.2011; 37 (6): 456–464. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Миллер Т.В., Рексер Б.Н., Гарретт Дж. Т., Артеага CL. Мутации в пути фосфатидилинозитол-3-киназы: роль в прогрессировании опухоли и терапевтическое значение при раке молочной железы.Рак молочной железы Res. 2011; 13 (6): 224. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Montagut C, Settleman J. Нацеливание на путь RAF-MEK-ERK в терапии рака. Cancer Lett. 2009. 283 (2): 125–134. [PubMed] [Google Scholar] 7. Чжан Л.Л., Чжан Дж., Шэнь Л., Сюй XM, Ю. Х. Сверхэкспрессия AKT снижает химиочувствительность клеток рака желудка к цисплатину in vitro и in vivo. Мол Мед Реп. 2013; 7 (5): 1387–1390. [PubMed] [Google Scholar] 8. Сунага Н., Шамес Д.С., Жирар Л. и др. Нокдаун онкогенных KRAS при немелкоклеточном раке легких подавляет рост опухоли и повышает чувствительность опухолевых клеток к таргетной терапии.Mol Cancer Ther. 2011; 10 (2): 336–346. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Ким И.А., Бэ С.С., Фернандес А. и др. Селективное ингибирование Ras, фосфоинозитид-3 киназы и изоформ akt увеличивает радиочувствительность клеточных линий карциномы человека. Cancer Res. 2005. 65 (17): 7902–7910. [PubMed] [Google Scholar] 10. Ахмед З.А., Моаттер Т., Сиддики А., Первез С. Распространение мутаций EGFR, обычно наблюдаемых при первичных аденокарциномах легких в Пакистане, в качестве предикторов таргетной терапии. Азиатский Pac J Cancer Prev.2014. 15 (17): 7125–7128. [PubMed] [Google Scholar] 11. Ван Х, Сюй Т., Цзян И и др. Проблемы и перспективы молекулярной таргетной терапии злокачественных глиом. Неоплазия. 2015; 17 (3): 239–255. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Фернандес Дж. Изучение гомологии между генами прогрессирования опухоли и членами retroviridae как инструмент для прогнозирования неэффективности целенаправленной терапии. Front Pharmacol. 2015; 6: 92. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Vousden KH, Lu X. Живи или дай умереть: реакция клетки на p53.Нат Рев Рак. 2002. 2 (8): 594–604. [PubMed] [Google Scholar] 15. Пели Дж., Шротер М., Рудаз С. и др. Онкогенный Ras ингибирует апоптоз, опосредованный лигандом Fas, путем подавления экспрессии Fas. EMBO J. 1999; 18 (7): 1824–1831. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Cascalló M, Capellà G, Mazo A, Alemany R. Ras-зависимый онколиз с мутантом аденовируса VAI. Cancer Res. 2003. 63 (17): 5544–5550. [PubMed] [Google Scholar] 17. Ким М., Уильямсон СТ, Прюдом Дж. И др. Вирусный тропизм двух различных онколитических вирусов, реовируса и вируса миксомы, модулируется статусом гена-супрессора клеточной опухоли.Онкоген. 2010. 29 (27): 3990–3996. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Замарин Д., Палезе П. Вирус онколитической болезни Ньюкасла для лечения рака: старые проблемы и новые направления. Future Microbiol. 2012. 7 (3): 347–367. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Фасулло М., Бурч А.Д., Бриттон А. Гипоксия усиливает репликацию онколитического вируса простого герпеса в клетках рака молочной железы p53 – . Клеточный цикл. 2009. 8 (14): 2194–2197. [PubMed] [Google Scholar] 20. Christian SL, Collier TW, Zu D, Licursi M, Hough CM, Hirasawa K.Активированный Ras / MEK подавляет противовирусный ответ альфа-интерферона за счет снижения уровня STAT2. J Virol. 2009. 83 (13): 6717–6726. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Hemminki O, Parviainen S, Juhila J, et al. Иммунологические данные от раковых пациентов, получавших Ad5 / 3-E2F-Δ24-GMCSF, предполагают полезность для иммунотерапии опухолей. Oncotarget. 2015; 6 (6): 4467–4481. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Мур А.Э. Вирусы с онколитическими свойствами и их адаптация к опухолям. Ann N Y Acad Sci.1952; 54: 945–952. [PubMed] [Google Scholar] 24. Любовь R, Sharpless GR. Исследования перевиваемой куриной опухоли, лимфомы RPL-12. II. Механизм регресса после заражения онколитическим вирусом. Cancer Res. 1954. 14 (9): 640–647. [PubMed] [Google Scholar] 25. Hu D, Zhou J, Wang F, Shi H, Li Y, Li B. HPV-16 E6 / E7 способствует миграции клеток и инвазии при раке шейки матки посредством регулирования переключения кадгерина in vitro и in vivo. Arch Gynecol Obstet. 2015; 292 (6): 1345–1354. [PubMed] [Google Scholar] 26. Navaratnarajah CK, Miest TS, Carfi A, Cattaneo R.Целенаправленное проникновение вирусов в оболочке: вируса кори и простого герпеса I. Curr Opin Virol. 2012; 2 (1): 43–49. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Парикмахер Г.Н. Вирус везикулярного стоматита как онколитический переносчик. Viral Immunol. 2004. 17 (4): 516–527. [PubMed] [Google Scholar] 29. Дженсен С., Томсен АР. Зондирование РНК-вирусов: обзор рецепторов врожденного иммунитета, участвующих в распознавании инвазии РНК-вируса. J Virol. 2012. 86 (6): 2900–2910. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Каваи Т., Акира С.Роль рецепторов распознавания образов в врожденном иммунитете: обновленная информация о Toll-подобных рецепторах. Nat Immunol. 2010. 11 (5): 373–384. [PubMed] [Google Scholar] 31. Хусейн Б., Хеслер С., Коул Дж. Л. Регуляция PKR с помощью РНК: образование активных и неактивных димеров. Биохимия. 2015; 54 (44): 6663–6672. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Гарсия М.А., Мерс Э.Ф., Эстебан М. Протеинкиназа дцРНК PKR: вирус и клеточный контроль. Биохимия. 2007. 89 (6–7): 799–811. [PubMed] [Google Scholar] 33. Balachandran S, Kim CN, Yeh WC, Mak TW, Bhalla K, Barber GN.Активация dsRNA-зависимой протеинкиназы, PKR, индуцирует апоптоз посредством передачи сигналов смерти, опосредованной FADD. EMBO J. 1998; 17 (23): 6888–6902. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Гил Дж, Гарсия М.А., Эстебан М. Активация каспазы 9 дцРНК-зависимой протеинкиназой, PKR: молекулярный механизм и актуальность. FEBS Lett. 2002. 529 (2–3): 249–255. [PubMed] [Google Scholar] 35. Дэвис М.В., Чанг Х.В., Джейкобс Б.Л., Кауфман Р.Дж. Продукты генов вируса осповакцины E3L и K3L стимулируют трансляцию посредством ингибирования двухцепочечной РНК-зависимой протеинкиназы с помощью различных механизмов.J Virol. 1993. 67 (3): 1688–1692. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Лэнгланд Дж.О., Кэмерон Дж.М., Хек М.С., Янкович Дж.К., Джейкобс Б.Л. Ингибирование PKR вирусами РНК и ДНК. Virus Res. 2006. 119 (1): 100–110. [PubMed] [Google Scholar] 37. Гейл М. младший, Блейкли С.М., Квечишевский Б. и др. Контроль протеинкиназы PKR с помощью неструктурного белка 5A вируса гепатита С: молекулярные механизмы регуляции киназы. Mol Cell Biol. 1998. 18 (9): 5208–5218. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Шарма К., Трипати С., Ранджан П. и др.Нуклеопротеин вируса гриппа A использует Hsp40 для подавления активации PKR. PLoS One. 2011; 6 (6): e20215. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Каземи С., Пападопулу С., Ли С. и др. Контроль альфа-субъединицы фосфорилирования эукариотического фактора инициации трансляции 2 (eIF2-альфа) онкобелком E6 вируса папилломы человека типа 18: влияние на экспрессию eIF2-альфа-зависимого гена и гибель клеток. Mol Cell Biol. 2004. 24 (8): 3415–3429. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Haus O.Гены интерферонов и факторов, связанных с интерфероном: локализация и взаимосвязь с хромосомными аберрациями при раке. Arch Immunol Ther Exp (Warsz) 2000; 48 (2): 95–100. [PubMed] [Google Scholar] 41. Гонг Дж, Мита ММ. Активированные сигнальные пути ras и онколиз реовируса: обновленная информация о механизме преимущественной репликации реовируса в раковых клетках. Фасад Онкол. 2014; 4: 167. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Первин С., Тран А.Х., Зекавати С., Фукуто Дж. М., Сингх Р., Чаудхури Г. Повышенная восприимчивость клеток рака груди к опосредованному стрессом ингибированию синтеза белка.Cancer Res. 2008. 68 (12): 4862–4874. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Сильный Дж. Э., Коффи МС, Тан Д., Сабинин П., Ли П. У. Молекулярная основа вирусного онколиза: узурпация сигнального пути Ras реовирусом. EMBO J. 1998; 17 (12): 3351–3362. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Маркато П., Шмулевиц М., Ли П.В. Связь реовирусного онколиза и передачи сигналов Ras. Клеточный цикл. 2005. 4 (4): 556–559. [PubMed] [Google Scholar] 45. Muik A, Stubbert LJ, Jahedi RZ, et al. Реинжиниринг вируса везикулярного стоматита для устранения нейротоксичности, обхода гуморального иммунитета и повышения онколитической активности.Cancer Res. 2014. 74 (13): 3567–3578. [PubMed] [Google Scholar] 46. Пател М.Р., Якобсон Б.А., Джи Й. и др. Вирус везикулярного стоматита, экспрессирующий интерферон-β, является онколитическим и способствует противоопухолевым иммунным ответам в сингенной мышиной модели немелкоклеточного рака легкого. Oncotarget. 2015; 6 (32): 33165–33177. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Тулани М., Минджи М., Саки М. и др. ERK2-зависимая реактивация Akt опосредует ограниченный ответ опухолевых клеток с конститутивной активностью K-RAS на ингибирование PI3K.Cancer Biol Ther. 2014. 15 (3): 317–328. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Ааронсон С.А., Уивер CA. Характеристика трансформации клеток мыши и человека вирусом саркомы мыши (Кирстен). J Gen Virol. 1971. 13 (2): 245–252. [PubMed] [Google Scholar] 49. Кристиан С.Л., Зу Д., Ликурси М. и др. Подавление IFN-индуцированной транскрипции лежит в основе дефектов IFN, генерируемых активированным Ras / MEK в раковых клетках человека. PLoS One. 2012; 7 (9): e44267. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Komatsu Y, Christian SL, Ho N, Pongnopparat T, Licursi M, Hirasawa K.Онкогенный Ras ингибирует IRF1, способствуя вирусному онколизу. Онкоген. 2015; 34 (30): 3985–3993. [PubMed] [Google Scholar] 51. Маркато П., Шмулевиц М., Пан Д., Штольц Д., Ли П. В.. Трансформация Ras опосредует онколиз реовируса, усиливая расплетение вируса, инфекционность частиц и апоптоз-зависимое высвобождение. Mol Ther. 2007. 15 (8): 1522–1530. [PubMed] [Google Scholar] 52. Фарассати Ф., Ян А.Д., Ли П.В. Онкогены в сигнальном пути Ras диктуют пермиссивность клетки-хозяина к вирусу простого герпеса 1. Nat Cell Biol.2001. 3 (8): 745–750. [PubMed] [Google Scholar] 53. Wellbrock C, Karasarides M, Marais R. Белки RAF занимают центральное место. Nat Rev Mol Cell Biol. 2004. 5 (11): 875–885. [PubMed] [Google Scholar] 55. Дэвис Х., Бигнелл Г.Р., Кокс С. и др. Мутации гена BRAF при раке человека. Природа. 2002; 417 (6892): 949–954. [PubMed] [Google Scholar] 56. Зиверт А.Дж., Ланг С.С., Буше К.Л. и др. Парадоксальная активация и резистентность к ингибиторам RAF слияний протеинкиназ BRAF, характерных для детских астроцитом. Proc Natl Acad Sci U S A.2013. 110 (15): 5957–5962. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Wollmann G, Davis JN, Bosenberg MW, van den Pol AN. Варианты вируса везикулярного стоматита избирательно инфицируют и убивают меланомы человека, но не нормальные меланоциты. J Virol. 2013. 87 (12): 6644–6659. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Чжан К., Гонг Р., Цюй Дж. И др. Активация пути Ras / Raf / MEK способствует репликации вируса гепатита С за счет ослабления пути интерферон-JAK-STAT. J Virol. 2012. 86 (3): 1544–1554.[Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Риолобос Л., Валле Н., Эрнандо Э., Марото Б., Канн М., Альмендраль Дж. М.. Вирусный онколиз, нацеленный на контроль передачи сигналов Raf-1 ядерного транспорта. J Virol. 2010. 84 (4): 2090–2099. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Wagle N, Van Allen EM, Treacy DJ и др. Изменения пути киназы MAP у пациентов с мутантной меланомой по BRAF с приобретенной устойчивостью к комбинированному ингибированию RAF / MEK. Рак Discov. 2014. 4 (1): 61–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62.Park KS, Oh B, Lee MH и др. Ингибитор HSP90, NVP-AUY922, сенсибилизирует KRAS-мутантный немелкоклеточный рак легкого с внутренней устойчивостью к ингибитору MEK, траметинибу. Cancer Lett. 2016; 372 (1): 75–81. [PubMed] [Google Scholar] 63. Смит К.Д., Межир Дж. Дж., Бикенбах К. и др. Активированная MEK подавляет активацию PKR и обеспечивает эффективную репликацию и онколиз in vivo с помощью Delta-gamma (1) 34,5 мутантов вируса простого герпеса 1. J Virol. 2006. 80 (3): 1110–1120. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64.Skelly CL, He Q, Spiguel L, McCormick S, Weichselbaum R. Для модуляции гиперплазии интимы сосудов с помощью мутанта HSV-1 требуется активированный MEK. Gene Ther. 2013. 20 (2): 215–224. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Roux PP, Blenis J. ERK и p38 MAPK-активированные протеинкиназы: семейство протеинкиназ с различными биологическими функциями. Microbiol Mol Biol Rev.2004; 68 (2): 320–344. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Моенс У., Костенко С., Свейнбьорнссон Б. Роль митоген-активированных протеинкиназ-активированных протеинкиназ (MAPKAPK) в воспалении.Гены (Базель) 2013; 4 (2): 101–133. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Prickaerts P, Niessen HE, Dahlmans VE, et al. Модуляция MK3 влияет на BMI1-зависимые и независимые контрольные точки клеточного цикла. PLoS One. 2015; 10 (4): e0118840. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Gamell C, Susperregui AG, Bernard O, Rosa JL, Ventura F. Путь p38 / MK2 / Hsp25 необходим для миграции клеток, индуцированной BMP-2. PLoS One. 2011; 6 (1): e16477. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Луиг С., Кетер К., Дудек С.Е. и др.Активированные MAP-киназой протеинкиназы 2 и 3 необходимы для размножения вируса гриппа A и действуют посредством ингибирования PKR. FASEB J. 2010; 24 (10): 4068–4077. [PubMed] [Google Scholar] 70. Барбер Г. Н., Томпсон С., Ли Т. Г. и др. 58-килодальтонный ингибитор интерферон-индуцированной двухцепочечной РНК-активируемой протеинкиназы представляет собой тетратрикопептидный повторяющийся белок с онкогенными свойствами. Proc Natl Acad Sci U S. A. 1994; 91 (10): 4278–4282. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Staal SP. Молекулярное клонирование онкогена akt и его человеческих гомологов AKTI и AKT2: амплификация AKTI в первичной аденокарциноме желудка человека.Proc Natl Acad Sci U S. A. 1987; 84 (14): 5034–5037. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Мартелли AM, Tazzari PL, Evangelisti C и др. Нацеливание на фосфатидилинозитол-3-киназа / Akt / млекопитающее, мишень рапамицинового модуля для терапии острого миелогенного лейкоза: от кабинета до постели больного. Curr Med Chem. 2007. 14 (19): 2009–2023. [PubMed] [Google Scholar] 73. Брогнард Дж., Кларк А.С., Ни И., Деннис П.А. Akt / протеинкиназа B конститутивно активна в клетках немелкоклеточного рака легкого и способствует выживанию клеток и устойчивости к химиотерапии и радиации.Cancer Res. 2001. 61 (10): 3986–3997. [PubMed] [Google Scholar] 74. Werden SJ, McFadden G. Фармакологические манипуляции с сигнальным путем akt регулируют репликацию вируса миксомы и тропизм в раковых клетках человека. J Virol. 2010. 84 (7): 3287–3302. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Корреа Р.Дж., Комар М., Тонг Дж. Г. и др. Опосредованный вирусом миксомы онколиз вызванных асцитом клеток рака яичников человека и сфероидов зависит от дифференциальной активности AKT. Gynecol Oncol. 2012; 125 (2): 441–450.[Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Gingras AC, Kennedy SG, O’Leary MA, Sonenberg N, Hay N. 4E-BP1, репрессор трансляции мРНК, фосфорилируется и инактивируется сигнальным путем Akt (PKB). Genes Dev. 1998. 12 (4): 502–513. [Бесплатная статья PMC] [PubMed] [Google Scholar] 77. She QB, Halilovic E, Ye Q, et al. 4E-BP1 является ключевым эффектором онкогенной активации сигнальных путей AKT и ERK, которые интегрируют их функцию в опухолях. Раковая клетка. 2010. 18 (1): 39–51. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78.Sarinella F, Calistri A, Sette P, Palù G, Parolin C. Онколиз опухолевых клеток поджелудочной железы HSV-1 с делецией гамма-34,5 зависит не от активации Ras, а от пути PI 3-киназы. Gene Ther. 2006. 13 (14): 1080–1087. [PubMed] [Google Scholar] 79. Кендалл С.Д., Линардич С.М., Адам С.Дж., Счетчик СМ. Сеть генетических событий, достаточная для преобразования нормальных человеческих клеток в онкогенное состояние. Cancer Res. 2005. 65 (21): 9824–9828. [PubMed] [Google Scholar] 80. Юн СН, Ли Э.С., Лим Д.С., Пэ Ю.С. PKR, ген-мишень p53, играет решающую роль в супрессорной функции опухоли p53.Proc Natl Acad Sci U S. A. 2009; 106 (19): 7852–7857. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Ruttkay-Nedecky B., Jimenez Jimenez AM, Nejdl L, et al. Актуальность инфекции вирусом папилломы человека: роль белка-супрессора опухоли p53 и белков цинковых пальцев E6 / E7 (обзор) Int J Oncol. 2013. 43 (6): 1754–1762. [PubMed] [Google Scholar] 82. Рутка Дж. Т., Акияма Ю., Ли С. П., Иванчук С., Цугу А., Хамель П. А.. Изменения путей p53 и pRB в астроцитоме человека. Патология опухоли головного мозга. 2000. 17 (2): 65–70.[PubMed] [Google Scholar] 83. Клайн К.Л., Ван ден Хеувел А.П., Аллен Дж. Э., Прабху В. В., Дикер Д. Т., Эль-Дейри В. С.. ONC201 убивает солидные опухолевые клетки, вызывая интегрированный стрессовый ответ, зависящий от активации ATF4 специфическими киназами eIF2α. Sci Signal. 2016; 9 (415): ра18. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Якубчак Дж. Л., Райан П., Горцилья М. и др. Онколитический аденовирус, селективный для опухолей, дефектных по пути белка-супрессора ретинобластомы: зависимость от E1A, промотора E2F-1 и вирусной репликации для селективности и эффективности.Cancer Res. 2003. 63 (7): 1490–1499. [PubMed] [Google Scholar] 85. Нойс RS, Ричардсон CD. Нектин 4 является рецептором эпителиальных клеток вируса кори. Trends Microbiol. 2012. 20 (9): 429–439. [PubMed] [Google Scholar] 86. Канерва А, Михеева Г.В., Красных В и др. Нацеливание аденовируса на рецептор серотипа 3 увеличивает эффективность переноса гена в раковые клетки яичников. Clin Cancer Res. 2002. 8 (1): 275–280. [PubMed] [Google Scholar] 87. Парк М.С., Шоу М.Л., Муньос-Джордан Дж. И др. Анализ на основе вируса болезни Ньюкасла (NDV) демонстрирует антагонистическую активность интерферона в отношении белка V NDV и белков V, W и C вируса Нипах.J Virol. 2003. 77 (2): 1501–1511. [Бесплатная статья PMC] [PubMed] [Google Scholar] 88. Матвеева О.В., Го З.С., Сенин В.М., Сенина А.В., Шабалина С.А., Чумаков П.М. Онколиз парамиксовирусами: доклинические и клинические исследования. Мол тер онколитики. 2015; 2: ii: 150017. [Бесплатная статья PMC] [PubMed] [Google Scholar] 89. Csatary LK, Gosztonyi G, Szeberenyi J, et al. Лечение онколитического вируса MTH-68 / H в глиомах высокой степени злокачественности у человека. J Neurooncol. 2004. 67 (1–2): 83–93. [PubMed] [Google Scholar] 90. Batliwalla FM, Bateman BA, Serrano D, et al.15-летнее наблюдение за пациентами со злокачественной меланомой III стадии AJCC, послеоперационно пролеченных онколизатом вируса болезни Ньюкасла (NDV), и определение изменений в репертуаре Т-лимфоцитов CD8. Mol Med. 1998. 4 (12): 783–794. [Бесплатная статья PMC] [PubMed] [Google Scholar] 91. Слобод К.С., Шенеп Ю.Л., Лухан-Зильберманн Дж. И др. Безопасность и иммуногенность интраназального вируса парагриппа мышей типа 1 (вирус Сендай) у здоровых взрослых людей. Вакцина. 2004. 22 (23–24): 3182–3186. [PubMed] [Google Scholar] 92.Галанис Э., Хартманн Л.С., Клиби В.А. и др. Фаза I испытания внутрибрюшинного введения штамма онколитического вируса кори, сконструированного для экспрессии карциноэмбрионального антигена рецидивирующего рака яичников. Cancer Res. 2010. 70 (3): 875–882. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Асада Т. Лечение рака человека вирусом паротита. Рак. 1974; 34 (6): 1907–1928. [PubMed] [Google Scholar] 94. Голламуди Р., Галиб М.Х., Десаи К.К. и др. Внутривенное введение реолизина, живого репликационно-способного РНК-вируса, безопасно для пациентов с развитыми солидными опухолями.Инвестируйте в новые лекарства. 2010. 28 (5): 641–649. [Бесплатная статья PMC] [PubMed] [Google Scholar] 95. Вильялона-Калеро М.А., Лам Э., Оттерсон Г.А. и др. Онколитический реовирус в сочетании с химиотерапией у пациентов с метастатическим или рецидивирующим немелкоклеточным раком легкого с опухолями, активированными KRAS. Рак. 2016; 122 (6): 875–883. [Бесплатная статья PMC] [PubMed] [Google Scholar] 96. Моррис Д.Г., Фен X, ДиФранческо Л.М. и др. REO-001: Фаза I испытания чрескожного внутриочагового введения реовируса 3 типа (Реолизин ® ) у пациентов с развитыми солидными опухолями.Инвестируйте в новые лекарства. 2013. 31 (3): 696–706. [PubMed] [Google Scholar] 97. Сборов Д.В., Нуово Г.Дж., Штифф А. и др. Фаза I испытания монотерапии реолизином у пациентов с рецидивирующей множественной миеломой. Clin Cancer Res. 2014. 20 (23): 5946–5955. [Бесплатная статья PMC] [PubMed] [Google Scholar] 98. Рот Дж., Доббельштейн М. Взаимодействие р53 с белком аденовируса E1B-55 кДа. Методы Мол биол. 2003. 234: 135–149. [PubMed] [Google Scholar] 99. Маккормик Ф. Взаимодействие между белками аденовируса и путем p53: разработка ONYX-015.Semin Cancer Biol. 2000. 10 (6): 453–459. [PubMed] [Google Scholar] 100. Ganly I, Kirn D, Eckhardt G, et al. Фаза I исследования Onyx-015, аттенуированного аденовируса E1B, вводимого внутриопухолево пациентам с рецидивирующим раком головы и шеи. Clin Cancer Res. 2000. 6 (3): 798–806. [PubMed] [Google Scholar] 101. Nemunaitis J, Ganly I., Khuri F, et al. Селективная репликация и онколиз в мутантных опухолях p53 с ONYX-015, аденовирусом с удаленным геном E1B-55kD, у пациентов с распространенным раком головы и шеи: испытание фазы II.Cancer Res. 2000. 60 (22): 6359–6366. [PubMed] [Google Scholar] 102. Opyrchal M, Aderca I, Galanis E. Фаза I клинических испытаний локального введения онколитического аденовируса ONYX-015 в сочетании с химиотерапией митомицином-C, доксорубицином и цисплатином у пациентов с запущенными саркомами. Методы Мол биол. 2009; 542: 705–717. [Бесплатная статья PMC] [PubMed] [Google Scholar] 103. Hengstschläger M, Pfeilstöcker M, Wawra E. Экспрессия тимидинкиназы. Маркер злокачественных клеток. Adv Exp Med Biol.1998. 431: 455–460. [PubMed] [Google Scholar] 104. Алегре М.М., Робисон Р.А., О’Нил К.Л. Повышенная регуляция тимидинкиназы 1 является ранним событием в образовании опухоли молочной железы. J Oncol. 2012; 2012: 575647. [Бесплатная статья PMC] [PubMed] [Google Scholar] 105. Лю Б.Л., Робинсон М., Хан З.К. и др. ICP34.5 удалил вирус простого герпеса с усиленными онколитическими, иммуностимулирующими и противоопухолевыми свойствами. Gene Ther. 2003. 10 (4): 292–303. [PubMed] [Google Scholar] 106. Харрингтон К.Дж., Хингорани М., Танай М.А. и др. Исследование фазы I / II онколитического ВПГ GM-CSF в сочетании с лучевой терапией и цисплатином при нелеченом плоскоклеточном раке III / IV стадии головы и шеи.Clin Cancer Res. 2010. 16 (15): 4005–4015. [PubMed] [Google Scholar] 107. Зенцер Н.Н., Кауфман Х.Л., Аматруда Т. и др. Фаза II клинических испытаний онколитического герпесвируса второго поколения, кодирующего гранулоцитарно-макрофагальный колониестимулирующий фактор, у пациентов с неоперабельной метастатической меланомой. J Clin Oncol. 2009. 27 (34): 5763–5771. [PubMed] [Google Scholar] 108. Мастранджело М.Дж., Магуайр Х.С., младший, Эйзенлор Л.С. и др. Внутриопухолевый рекомбинантный вирус, кодирующий GM-CSF, как генная терапия у пациентов с меланомой кожи.Cancer Gene Ther. 1999. 6 (5): 409–422. [PubMed] [Google Scholar] 109. Хео Дж., Рид Т., Руо Л. и др. Рандомизированное клиническое испытание по подбору доз онколитического иммунотерапевтического средства вакцины JX-594 при раке печени. Nat Med. 2013. 19 (3): 329–336. [Бесплатная статья PMC] [PubMed] [Google Scholar] 110. Cripe TP, Ngo MC, Geller JI и др. Исследование фазы 1 внутриопухолевого Pexa-Vec (JX-594), онколитического и иммунотерапевтического вируса осповакцины, у онкологических больных детей. Mol Ther. 2015; 23 (3): 602–608. [Бесплатная статья PMC] [PubMed] [Google Scholar] 111.Мист Т.С., Яйв К.С., Френцке М. и др. Нацеленный на проникновение в оболочку химерный вирус кори избегает нейтрализации и достигает онколиза. Mol Ther. 2011; 19 (10): 1813–1820. [Бесплатная статья PMC] [PubMed] [Google Scholar] 112. Дженнингс В.А., Илетт Э.Дж., Скотт К.Дж. и др. Активированный лимфокинами переносчик киллеров и дендритных клеток усиливает онколитическую реовирусную терапию рака яичников, преодолевая нейтрализацию антител при асците. Int J Cancer. 2014. 134 (5): 1091–1101. [Бесплатная статья PMC] [PubMed] [Google Scholar] 113.Гонг Дж., Сачдев Э., Мита А.С., Мита ММ. Клиническая разработка реовируса для лечения рака: онколитический вирус с иммуноопосредованной противоопухолевой активностью. World J Methodol. 2016; 6 (1): 25–42. [Бесплатная статья PMC] [PubMed] [Google Scholar] 114. Мурдык-Шаувекер М., Шах Н.Р., Мерфи А.М., Хасти Э., Мукерджи П., Грдзелишвили В.З. Устойчивость раковых клеток поджелудочной железы к вирусу онколитического везикулярного стоматита: роль передачи сигналов интерферона I типа. Вирусология. 2013. 436 (1): 221–234. [Бесплатная статья PMC] [PubMed] [Google Scholar] 115.Ким М., Иган С., Ален Т. и др. Приобретена устойчивость к реовирусному онколизу в Ras-трансформированных клетках фибросаркомы. Онкоген. 2007. 26 (28): 4124–4134. [PubMed] [Google Scholar] 116. Малилас В., Кох С.С., Срисутти Р. и др. Ген 2, активизированный раком, новый онкоген, придает устойчивость к вирусу онколитического везикулярного стоматита посредством передачи сигналов STAT1-OASL2. Cancer Gene Ther. 2013. 20 (2): 125–132. [PubMed] [Google Scholar] 117. Томас М.А., Спенсер Дж. Ф., Тот К., Сагарц Дж. Э., Филлипс Нью-Джерси, Уолд WS. Иммуносупрессия увеличивает репликацию онколитического аденовируса и противоопухолевую эффективность на модели сирийского хомяка.Mol Ther. 2008. 16 (10): 1665–1673. [Бесплатная статья PMC] [PubMed] [Google Scholar] 118. Штраус Р., Сова П., Лю Й. и др. Фенотип эпителия придает устойчивость раковых клеток яичников к онколитическим аденовирусам. Cancer Res. 2009. 69 (12): 5115–5125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 119. Jamal MH, Ch’ng WC, Yusoff K, Shafee N. Уменьшение индуцированного вирусом болезни Ньюкасла онколиза в субпопуляции устойчивых к цисплатину клеток MCF7 связано со стабилизацией сурвивина. Cancer Cell Int. 2012; 12 (1): 35.[Бесплатная статья PMC] [PubMed] [Google Scholar] 120. Ю Н, Пакетт С., Антиноцци П.А., Крамер С.Д., Лайлс Д.С. Изменение предрасположенности к вирусу онколитического везикулярного стоматита при прогрессировании рака простаты. J Virol. 2015. 89 (10): 5250–5263. [Бесплатная статья PMC] [PubMed] [Google Scholar] 121. Чой И.К., Штраус Р., Рихтер М., Юн СО, Либер А. Стратегии увеличения проникновения лекарств в солидные опухоли. Фасад Онкол. 2013; 3: 193. [Бесплатная статья PMC] [PubMed] [Google Scholar] 122. Смит Э., Брезник Дж., Личти Б.Д. Стратегии увеличения проникновения вирусов в солидные опухоли.Hum Gene Ther. 2011. 22 (9): 1053–1060. [PubMed] [Google Scholar] 123. Яаков Б., Лазар И., Тайеб С. и др. Компоненты внеклеточного матрикса препятствуют распространению вируса болезни Ньюкасла в твердых тканях и снижают его потенциальную онколитическую активность. J Gen Virol. 2012; 93 (ч. 8): 1664–1672. [PubMed] [Google Scholar] 124. Гомес-Гутьеррес Дж. Г., Нитц Дж., Шарма Р. и др. Комбинированная терапия онколитическим аденовирусом и темозоломидом усиливает виротерапию рака легкого in vitro и in vivo. Вирусология. 2016; 487: 249–259.[Бесплатная статья PMC] [PubMed] [Google Scholar] 125. Марчини А., Скотт Э.М., Роммелер Дж. Преодоление барьеров в онколитической виротерапии с помощью ингибиторов HDAC и блокады иммунных контрольных точек. Вирусы. 2016; 8 (1): ii: E9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 126. Ким Й.И., Ан BC, Рональд Дж. А. и др. Сравнение внутриопухолевой и внутривенной генной терапии с использованием вирусного вектора, нацеленного на транскрипцию, в модели ортотопической гепатоцеллюлярной карциномы на крысах. J Vasc Interv Radiol. 2012. 23 (5): 704–711. [Бесплатная статья PMC] [PubMed] [Google Scholar] 127.Тонг А.В., Сензер Н., Церулло В., Темплтон Н.С., Хемминки А., Немунайтис Дж. Онколитические вирусы для индукции противоопухолевого иммунитета. Curr Pharm Biotechnol. 2012. 13 (9): 1750–1760. [PubMed] [Google Scholar] 128. Hwang TH, Moon A, Burke J и др. Клиническое испытание с механической проверкой концепции JX-594, таргетного мультимеханического онколитического поксвируса, у пациентов с метастатической меланомой. Mol Ther. 2011; 19 (10): 1913–1922. [Бесплатная статья PMC] [PubMed] [Google Scholar] 129. Минн AJ, Уэрри EJ. Комбинированная терапия рака с блокадой иммунных контрольных точек: конвергенция передачи сигналов интерферона.Клетка. 2016; 165 (2): 272–275. [PubMed] [Google Scholar] 130. Rech AJ, Vonderheide RH. Динамическое взаимодействие онкогенов и Т-клеток индуцирует PD-L1 в микроокружении опухоли. Рак Discov. 2013. 3 (12): 1330–1332. [Бесплатная статья PMC] [PubMed] [Google Scholar] 131. Leach DR, Krummel MF, Allison JP. Повышение противоопухолевого иммунитета за счет блокады CTLA-4. Наука. 1996. 271 (5256): 1734–1736. [PubMed] [Google Scholar] 132. Топалян С.Л., Таубе Дж.М., Андерс Р.А., Пардолл Д.М. Биомаркеры, управляемые механизмами, для определения блокады иммунных контрольных точек при лечении рака.Нат Рев Рак. 2016; 16 (5): 275–287. [Бесплатная статья PMC] [PubMed] [Google Scholar] 133. Engeland CE, Grossardt C, Veinalde R, et al. Блокада контрольных точек CTLA-4 и PD-L1 усиливает терапию онколитическим вирусом кори. Mol Ther. 2014; 22 (11): 1949–1959. [Бесплатная статья PMC] [PubMed] [Google Scholar] 134. Болтон Г.К., Симпсон Г.Р., Коффи М. и др. Устойчивость к онколитическому реовирусу связана с высокой экспрессией да-ассоциированного белка-1 (YAP-1) при раке головы и шеи. Hum Gene Ther. 2014; 25 (12): А12. [Google Scholar] 135.Стейнхардт А.А., Гайед М.Ф., Кляйн А.П. и др. Экспрессия да-ассоциированного белка в обычных солидных опухолях. Hum Pathol. 2008. 39 (11): 1582–1589. [Бесплатная статья PMC] [PubMed] [Google Scholar] 136. Нил Дж. У., Сани Г. В.. Десятилетие обзорно-целевой терапии: успехи, токсичность и проблемы при солидных опухолях. Нат Рев Клин Онкол. 2014. 11 (11): 627–628. [PubMed] [Google Scholar] 137. Эберлейн С.А., Стетсон Д., Марковец А.А. и др. Приобретенная устойчивость к мутант-селективному ингибитору EGFR AZD9291 связана с повышенной зависимостью от передачи сигналов RAS в доклинических моделях.Cancer Res. 2015; 75 (12): 2489–2500. [Бесплатная статья PMC] [PubMed] [Google Scholar] 138. Саутэм CM, Бэбкок VI. Исследования вирусного онколиза с метастатической опухолью человека у цыплят. Cancer Res. 1958. 18 (9): 1070–1074. [PubMed] [Google Scholar] 140. Галанис Э., Маркович С.Н., Суман В.Дж. и др. Испытание фазы II внутривенного введения Реолизина ( ® ) (штамм, вызывающий реовирус серотипа 3) пациентам с метастатической меланомой. Mol Ther. 2012; 20 (10): 1998–2003. [Бесплатная статья PMC] [PubMed] [Google Scholar] Код безопасности лекарств– PGx Passport
The “PGx Passport” содержит рекомендации по фармакогеномной дозировке для управления лекарственным лечением на основе фармакогеномных фенотипов человека.Дополнительную информацию о его происхождении, используемых правилах, лицензировании, отказе от ответственности и условиях использования см. В разделе «Отказ от ответственности и дополнительная информация» внизу этой страницы.
АМИТРИПТИЛИН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм приводит к увеличению метаболической емкости CYP2D6, что может вызвать снижение плазменных концентраций амитриптилина и его активного метаболита нортриптилина и повышение плазменных концентраций активных метаболитов E-10-OH-амитриптилина и E-10-OH- нортриптилин.
Рекомендация:
- По возможности выберите альтернативу
Антидепрессанты, которые не метаболизируются через CYP2D6 – или в меньшей степени – включают, например, циталопрам и сертралин. - Если альтернативный вариант невозможен: увеличьте дозу в 1,25 раза по сравнению со стандартной дозой, контролируйте концентрации в плазме и будьте внимательны к потенциальной неудаче терапии из-за снижения концентраций амитриптилина плюс нортриптилина в плазме и повышения концентрации в плазме потенциально кардиотоксичных веществ. активные гидроксиметаболиты.
Механизм:
Амитриптилин в основном превращается посредством CYP2C19-опосредованного N-деметилирования в активный метаболит нортриптилин. И амитриптилин, и нортриптилин метаболизируются CYP2D6 до 10-гидроксиметаболитов, преимущественно E-10-гидроксиметаболитов. Амитриптилин примерно в три раза сильнее, чем E-10-OH-амитриптилин. Нортриптилин примерно в два раза сильнее, чем E-10-OH-нортриптилин.
Также имеет место N-окисление и N-глюкуронирование амитриптилина.
Нортриптилин превращается CYP2D6 и CYP2C19 в неактивный метаболит дидесметиламитриптилин (десметилнортриптилин).
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Другие соображения:
Терапевтическая эффективность амитриптилина коррелирует с суммой плазменных концентраций амитриптилина и нортриптилина, но побочные эффекты коррелируют с плазменными концентрациями нортриптилина.
Гидроксиметаболиты потенциально кардиотоксичны.
Клинические последствия:
В одном случае описана неэффективность терапии после начального короткого периода улучшения.
Кинетические последствия:
Обнаружено 20% снижение концентрации амитриптилина плюс нортриптилин в плазме (незначительно).
Также была обнаружена положительная корреляция между активностью CYP2D6 и соотношением (гидроксиамитриптилин + гидроксинортриптилин) / (амитриптилин + нортриптилин). Это означает, что у пациентов с УМ наблюдается относительное увеличение гидроксиметаболитов.
Было обнаружено 47% увеличение метаболического соотношения амитриптилин / нортриптилин (незначительно).
АТОМОКСЕТИН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетическая изменчивость приводит к повышенному превращению атомоксетина в активный метаболит 4-гидроксиатомоксетин, концентрация которого в плазме намного ниже. Поскольку в результате концентрация активных ингредиентов в плазме снижается, это изменение гена может привести к снижению эффективности.
Рекомендация:
- Будьте особенно внимательны к снижению эффективности лечения
- Посоветуйте пациенту обратиться к врачу в случае неадекватного эффекта
- В качестве меры предосторожности можно выбрать альтернативу
Клонидин не метаболизируется CYP2D6 .
Механизм:
Атомоксетин в основном метаболизируется CYP2D6 до 4-гидроксиатомоксетина. Этот метаболит эквивалентен атомоксетину, но циркулирует в плазме в гораздо более низких концентрациях.
Фермент CYP2C19 и другие изоферменты образуют N-десметилатомоксетин, который практически неактивен.
Для получения дополнительной информации о фенотипе UM см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (введите «CYP2D6»).
Клинические последствия:
Теоретически риск снижения эффективности терапии увеличивается при уменьшении суммы плазменных концентраций атомоксетина и 4-гидроксиатомоксетина.
Кинетические последствия:
После однократного приема AUC атомоксетина снизилась примерно на две трети для 1 UM с дозой гена 3.Концентрация 4-гидроксиатомоксетина составляла менее 1% от концентрации атомоксетина, что означает, что вклад 4-гидроксиатомоксетина был незначительным.
АЗАТИОПРИН
Причина: НЕДОСТАТОЧНЫЙ МЕТАБОЛИЗАТОР TPMT
Генетическая изменчивость снижает превращение азатиоприна и меркаптопурина в преимущественно неактивные метаболиты. Это увеличивает риск серьезных, опасных для жизни нежелательных явлений, таких как миелосупрессия.
Рекомендация:
- Выберите альтернативу или начните с 10% стандартной дозы.
При корректировке начальной дозы следует руководствоваться токсичностью (мониторинг показателей крови) и эффективностью.
Следует увеличить частоту мониторинга. - Если доза снижена: посоветуйте пациентам обратиться за медицинской помощью при появлении симптомов миелосупрессии (таких как сильная боль в горле в сочетании с лихорадкой, регулярные кровотечения из носа и склонность к синякам)
Механизм:
Азатиоприн превращается в организме в меркаптопурин. Меркаптопурин – это неактивное пролекарство, которое в организме превращается в активные метаболиты – нуклеотиды тиогуанина.Два катаболических пути снижают биодоступность меркаптопурина для образования тиогуаниновых нуклеотидов. Тиопуринметилтрансфераза (TPMT) катализирует S-метилирование как меркаптопурина, так и рибонуклеотидов 6-меркаптопурина, образующихся в метаболическом пути. В дополнение к этому, меркаптопурин окисляется до неактивной 6-тиуровой кислоты ферментом ксантиноксидазой (XO), который происходит в основном в печени и кишечнике. Для получения дополнительной информации о фенотипе PM: см. Общую справочную информацию о TPMT в банке знаний KNMP или на сайте www.knmp.nl (поиск по ключевому слову «фармакогенетика»).
Клинические последствия:
В одиннадцати из шестнадцати случаев стандартная доза привела к прекращению лечения из-за лейкопении / миелосупрессии. У четырех пациентов произошло значительное снижение дозы из-за лейкопении / миелосупрессии и / или высоких концентраций активного метаболита. Один ПМ проявил только легкую токсичность при стандартной дозе. Метаанализ с участием 43 человек с раком показал, что у 86% развилась тяжелая миелосупрессия (по сравнению с 7% для всех генотипов).В метаанализе с 19:00 при аутоиммунных заболеваниях риск лейкопении увеличился (OR = 20,84; 95% ДИ: 3,42–126,89). В этом метаанализе не было выявлено различий в риске других нежелательных явлений (миелотоксичность, гепатотоксичность и панкреатит). Переносимая доза варьировала для 27 часов вечера от 2,2% до 20% стандартной дозы (в среднем 10%). Один ПМ перенес дозу 124% от стандартной. Одно исследование показало сопоставимый клинический ответ (некоторые оставшиеся лейкозные клетки) на PM при 10% стандартной дозе и на EM при 100%.Другое исследование показало хороший клинический ответ (уменьшение язвенного колита) при 2,2% стандартной дозы.
Кинетические последствия:
В одном исследовании концентрация активного метаболита была в 8,5 раз выше по сравнению с ЭМ при 14% дозы. У одного пациента при дозе 5% концентрация активного метаболита была в 4,6 раза выше, а у одного пациента при дозе 20% концентрация была в 5,0 раза выше. Одно исследование показало, что концентрация активного метаболита в пределах целевого диапазона составляет 2.2% от стандартной дозы. В двух случаях при 10% стандартной дозе концентрация активного метаболита была в 3,4-4,3 раза выше постулируемого нижнего терапевтического предела. В одном случае скорректированная на дозу концентрация активного метаболита была увеличена в семь раз.
CITALOPRAM
Причина: СЛОЖНЫЙ МЕТАБОЛИЗАТОР CYP2C19
Вариация гена приводит к увеличению концентрации циталопрама в плазме. Это увеличивает риск удлинения интервала QT и torsades de pointes.
Рекомендация:
- не превышайте следующие суточные дозы (50% стандартной максимальной дозы) или выберите альтернативу:
- взрослые до 65 лет: 20 мг в виде таблеток или 16 мг в виде капель
- взрослые старше 65 лет лет: 10 мг в виде таблеток или 8 мг в виде капель
- взрослые до 65 лет: 20 мг в виде таблеток или 16 мг в виде капель
Механизм:
Циталопрам метаболизируется главным образом CYP2C19 и в меньшей степени CYP3A4 до слабоактивного N-десметилциталопрама. Десметилциталопрам превращается CYP2D6 в дидесметилциталопрам.
Для получения дополнительной информации о фенотипе PM: см. Общую справочную информацию о CYP2C19 в базе знаний KNMP или на сайте www.knmp.nl (поиск по ключевому слову «фармакогенетика»).
Другие соображения:
Связь между концентрацией в плазме и эффективностью и побочными эффектами не установлена. Риск индуцированного циталопрамом удлинения интервала QT и torsades de pointes зависит от дозы и, следовательно, от концентрации в плазме.
Верхний предел терапевтического диапазона циталопрама составляет 400 нг / мл.Токсичность была подтверждена при концентрациях циталопрама в плазме от 210 нг / мл. Как правило, терапевтические концентрации циталопрама в плазме колеблются от 30 до 130 нг / мл.
Клинические последствия:
Исследование шестнадцати IM-пациентов и одного PM выявило удлинение интервала QTc на 3,0%. Для этой группы исследование не обнаружило разницы в средней дозе и процентном соотношении пациентов с дозой выше 40 мг / день.
Два исследования не обнаружили разницы в частоте возникновения побочных эффектов. Исследование с участием новорожденных, в группе из четырех человек, в / м и одного после полудня, не обнаружило разницы в тяжести серотонинергических симптомов после приема циталопрама матерью.
Никакой разницы в допуске для ПМ не было. Для IM + PM результаты вероятности толерантности варьировались от отсутствия разницы в валидационном исследовании до снижения.
По вероятности ремиссии эффект варьировался от отсутствия разницы до увеличения на 48%.
Значительного влияния на установленную дозу не наблюдалось.
Кинетические последствия:
Увеличение AUC на 19-119%. Увеличение AUC в первую очередь вызвано увеличением активного S-энантиомера: увеличение AUC рацемата на 19% эквивалентно увеличению AUC S-циталопрама на 57%.
Для концентрации в плазме эффект варьировал от увеличения на 64% до снижения на 6%.
Снижение перорального клиренса на 24-76%.
Увеличение периода полураспада на 10-40%.
Это НЕ взаимодействие гена с лекарством.
Механизм:
Циталопрам превращается в N-десметилциталопрам, в первую очередь CYP2C19 и в меньшей степени CYP3A4. N-десметилциталопрам превращается в дидесметилциталопрам с помощью CYP2D6.
N-десметилциталопрам обладает антидепрессивным действием. Однако при стандартных дозах циталопрама активность невысока и клинически незначима.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Клинические последствия:
Одно исследование не обнаружило влияния на толерантность, реакцию и ремиссию.
Кинетические последствия:
В трех исследованиях не было обнаружено значительного влияния циталопрама на плазменную концентрацию.
КЛОМИПРАМИН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм приводит к увеличению метаболической емкости CYP2D6.Это может вызвать снижение концентрации кломипрамина и активного метаболита в плазме крови и повышение концентрации потенциально кардиотоксичных гидроксиметаболитов.
Рекомендация:
- выберите альтернативу
Антидепрессанты, которые не метаболизируются CYP2D6, или, в меньшей степени, включают циталопрам и сертралин. - , если альтернативный вариант невозможен:
- увеличить дозу до 150% от стандартнойОбе концентрации важны для токсичности и для индикации депрессии.
Механизм:
Кломипрамин и активный метаболит N-десметилкломипрамин в основном преобразуются CYP2D6 в неактивные гидроксиметаболиты.
Кломипрамин в основном превращается CYP2C19 в N-десметилкломипрамин.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Другие соображения:
Неактивные гидроксиметаболиты потенциально кардиотоксичны. Больше этих гидроксиметаболитов образуется в UM и с увеличением дозы, в то время как они также накапливаются при тяжелом нарушении функции почек.
Активный метаболит десметилкломипрамин не обладает активностью обратного захвата серотонина. Следовательно, метаболит, по-видимому, не способствует лечению обсессивно-компульсивного расстройства и других тревожных расстройств. Однако метаболит действительно способствует токсичности и лечению депрессии.
В случае депрессии используется значение 0,2-0,3 мг / л для суммы концентраций кломипрамина и десметилкломипрамина в плазме. Теоретически для тревожных расстройств используется значение 0,4 мг / л. В случае тяжелых тревожных расстройств доза может быть дополнительно увеличена под строгим контролем ЭКГ до суммы концентраций в плазме не более 0,7 мг / л. Если это по-прежнему не дает никакого эффекта, иногда добавляют флувоксамин в малых дозах (начальная доза 50 мг), чтобы ингибировать превращение кломипрамина в десметилкломипрамин.В этом есть некоторый опыт, и это действительно увеличивает соотношение кломипрамин / десметилкломипрамин. Другими словами, в случае тревожных расстройств лечение очень индивидуально.
Клинические последствия:
В двух случаях отсутствия ответа увеличение концентрации в плазме за счет увеличения дозы или ингибирования CYP2D6 привело к исчезновению проблемы. При увеличении дозы со 150 до 300 мг / сут. Другие сообщения об увеличении дозы UM неизвестны.
Теоретически риск побочных эффектов из-за потенциально кардиотоксичных гидроксиметаболитов возрастает с увеличением концентрации в плазме.
Кинетические последствия:
Одно исследование с 3 ед.
В том же исследовании было обнаружено снижение концентрации кломипрамина в плазме с поправкой на дозу на 25%.
Необычно низкие концентрации кломипрамина и десметилкломипрамина в плазме крови наблюдались в двух случаях.
Теоретически концентрация гидроксиметаболитов в плазме может увеличиваться.
КЛОПИДОГРЕЛЬ
Причина: СЛОЖНЫЙ МЕТАБОЛИЗАТОР CYP2C19
Генетическая изменчивость снижает активацию клопидогреля. Это увеличивает риск серьезных сердечно-сосудистых событий у пациентов, перенесших баллонную ангиопластику или установку стента (чрескожное коронарное вмешательство). У других пациентов отрицательных клинических последствий не доказано.
Рекомендация:
- ПЕРКУТАННОЕ КОРОНАРНОЕ ВМЕШАТЕЛЬСТВО:
- выберите альтернативу
Прасугрел и тикагрелор не метаболизируются CYP2C19 (или в меньшей степени).
- выберите альтернативу
- ДРУГИЕ ПОКАЗАНИЯ:
- определить уровень ингибирования агрегации тромбоцитов клопидогрелом
- рассмотреть альтернативу при плохих ответах
Прасугрел и тикагрелор не метаболизируются CYP2C19 (или в меньшей степени).
- определить уровень ингибирования агрегации тромбоцитов клопидогрелом
Механизм:
Клопидогрель является пролекарством, 85% которого превращается эстеразами в неактивный метаболит. Остальные 15% преобразуются в основном CYP2C19 и CYP3A4 в 2-оксоклопидогрель, а затем в активный метаболит h5, нестабильное тиоловое соединение, которое ингибирует агрегацию тромбоцитов за счет образования дисульфидного мостика с остатком цистеина на рецепторе ADP тромбоцитов (P2Y12).
Для получения дополнительной информации о фенотипе PM: см. Общую справочную информацию о CYP2C19 в банке знаний KNMP или на сайте www.knmp.nl (поиск CYP2C19).
Клинические последствия:
Увеличение частоты тромбоза стента на 267-425% или OR 3,78. Результаты варьировались от отсутствия разницы до повышенного риска серьезных сердечно-сосудистых событий (HRcorr = 1,98 для всех пациентов; HRcorr = 3,58 для пациентов, перенесших чрескожное коронарное вмешательство; OR = 1,59-1,75; RR = недостоверно -3.64). В метаанализе пациентов европеоидной расы ОР не был значимым, но был значимым после исключения большого исследования, в котором процент пациентов, перенесших чрескожное коронарное вмешательство, составлял 18,7% (ОР = 1,57). RR также не был значимым в метаанализе, в котором участвовали в основном пациенты европеоидной расы (122 PM), которым не проводилось чрескожное коронарное вмешательство. RR среди пациентов европеоидной расы, перенесших чрескожное коронарное вмешательство (278 PM), составил 1,67. RR был выше среди населения Восточной Азии (исследования, включающие только чрескожное коронарное вмешательство): 3.04-3.64.
Результаты варьировались от отсутствия разницы в большом кровотечении до снижения риска всех кровотечений (OR = 0,36; RR = 0,56).
Терапия на основе генотипа после чрескожного коронарного вмешательства с участием внутримышечных пациентов, получавших двойную дозу клопидогреля, и пациентов с ПМ, получающих альтернативную дозу (тикагрелор или клопидогрель в комбинации с цилостазолом), привела к снижению частоты серьезных сердечно-сосудистых событий (OR = 0,42 и снижение на 71%). % соответственно) по сравнению с терапией, в которой участвовали все пациенты, получавшие клопидогрель 75 мг / сут.Терапия на основе генотипа в исследовании с использованием тикагрелора в качестве альтернативы не привела к значительным различиям в серьезных сердечно-сосудистых событиях и кровотечениях между пациентами с PM, IM и EM, в то время как частота смерти снизилась на 89%, от инфаркта миокарда на 86% и стента. тромбоз на 78% при использовании клопидогреля в комбинации с цилостазолом в качестве альтернативы.
Лечение пациентов с ПМ двойной дозой клопидогреля в течение 1 месяца приводило к более незначительным кровотечениям, чем лечение тикагрелором (HR = 2.88). Остаточная агрегация тромбоцитов была выше в группе клопидогрела.
Реактивность тромбоцитов при дозе 225 мг / день была выше, чем у пациентов с EM + UM при дозе 75 мг / день. Отсутствие ответа, определяемое реактивностью тромбоцитов при нагрузочной дозе 900 мг, было выше, чем при нагрузочной дозе 300 мг для пациентов с EM + UM. Вышесказанное относится к пациентам. Дозовая реакция была выше среди здоровых добровольцев.
Кинетические последствия:
AUC активного метаболита h5 снизилась на 49-72%.
AUC увеличился на 194%.
AUC 2-оксоклопидогреля снизилась на 43-65%.
CODEINE
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм увеличивает превращение кодеина в морфин. Это может привести к усилению побочных эффектов. Смерть наступила у детей.
Рекомендация:
Кодеин противопоказан для CYP2D6 UM.
- Если возможно, выберите альтернативу.
Для БОЛИ: не выбирайте трамадол, так как он также метаболизируется CYP2D6.
Ойкскодон также метаболизируется CYP2D6, но обычно дозу можно титровать, чтобы обеспечить адекватное обезболивание без побочных эффектов.
Механизм:
Кодеин в основном метаболизируется CYP3A4, CYP2D6 и путем глюкуронизации. Конверсия CYP2D6 приводит к образованию активного метаболита морфина, который имеет в 200 раз более высокое сродство к µ-опиоидным рецепторам, чем сам кодеин. Морфин далее превращается в морфин-3-глюкуронид и активный морфин-6-глюкуронид.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP.
Прочие соображения:
Обезболивающее действие кодеина вызывается активными метаболитами морфином и морфин-6-глюкуронидом. Кодеин и его метаболит морфин подавляют кашлевой рефлекс.
Клинические последствия:
Пять из шести взрослых UM испытали побочные эффекты, вызванные кодеином. В одном случае это привело к коме.Из двух новорожденных, получавших грудное молоко от матерей (UM), употреблявших кодеин, один умер. Другой демонстрировал сильную сонливость и плохое поведение при кормлении, но выздоровел после полного перехода на молочную смесь. В двух случаях маленькие дети умерли от вызванных кодеином побочных эффектов после тонзиллэктомии из-за обструктивного апноэ во сне.
UM испытывают больше побочных эффектов. Доля людей с седативными препаратами увеличилась на 82%. В случае кормящих матерей риск депрессии центральной нервной системы у матери и ребенка увеличивается с уменьшением дозы гена.Этого не было в исследовании, в котором кодеин использовался максимум четыре дня.
Кинетические последствия:
Морфин: увеличение AUC на 45% для UM + EM (доза гена ≥ 2,5). Повышение концентрации в плазме до токсического уровня у детей раннего возраста.
Кодеин: без изменений в AUC.
Теоретически концентрация кодеина в плазме снижена.
ДОКСЕПИН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм приводит к увеличению метаболической емкости CYP2D6, что может вызывать снижение плазменных концентраций доксепина и нордоксепина и повышение плазменной концентрации гидроксиметаболитов.
Рекомендация:
- выберите альтернативу
Антидепрессанты, которые не метаболизируются CYP2D6, или, в меньшей степени, включают циталопрам и сертралин. - , если альтернативный вариант невозможен: увеличьте дозу до 200% от стандартной и контролируйте плазменные концентрации доксепина и нордоксепина перед установкой поддерживающей дозы
Механизм:
Доксепин и активный метаболит N-десметилдоксепин ( нордоксепин) в основном преобразуются CYP2D6 в неактивные гидроксиметаболиты.Доксепин в основном преобразуется изоферментом CYP2C19 в нордоксепин.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Прочие соображения:
Надежность расчета корректировки дозы в настоящее время ограничена тем фактом, что неизвестно, какой изомер является активной формой, хотя было обнаружено, что метаболизм E-изомера, в частности, зависит от CYP2D6.
Клинические последствия:
Теоретически риск снижения эффективности терапии увеличивается при снижении плазменных концентраций доксепина и нордоксепина.
Кинетические последствия:
AUC доксепин + нордоксепин снижается на 55%.
ЭЛИГЛУСТАТ
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Эта вариация гена увеличивает превращение элиглустата в неактивные метаболиты. В результате обычная доза неэффективна.Нет достаточного научного обоснования, чтобы предложить эффективную дозу для всех UM.
Рекомендация:
Элиглустат противопоказан.
1. Если возможно, выберите альтернативу.
Механизм:
Элиглустат преобразуется в неактивные метаболиты, в основном CYP2D6 и в меньшей степени CYP3A.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Другие соображения:
Элиглустат является ингибитором CYP2D6 и P-gp. Таким образом, элиглустат подавляет собственный метаболизм, подавляя CYP2D6. Это приводит к нелинейной зависимости между дозой и концентрацией.
Клинические последствия:
У всех четырех UM, получавших дозу 127 мг 2 раза в день (254 мг / день), был адекватный клинический ответ. У одного UM, получавшего дозу 84 мг 2 раза в день, не было адекватного клинического ответа.
Кинетические последствия:
Кинетические последствия не публиковались.Голландский SmPC заявляет, что рекомендации по дозировке не могут быть сделаны для UM.
ЭСЦИТАЛОПРАМ
Причина: СЛОЖНЫЙ МЕТАБОЛИЗАТОР CYP2C19
Вариация гена приводит к увеличению концентрации эсциталопрама в плазме. Это увеличивает риск удлинения интервала QT и torsades de pointes.
Рекомендация:
- Не превышайте следующие дозы (50% от стандартной максимальной дозы) или выбирайте альтернативу: взрослые <65 лет 10 мг / день, ≥65 лет 5 мг / день
Механизм:
Эсциталопрам в первую очередь метаболизируется CYP2C19 и в меньшей степени CYP3A4 до слабоактивного N-десметилесциталопрама.Десметилесциталопрам превращается CYP2D6 в дидесметилесциталопрам.
Для получения дополнительной информации о фенотипе PM: см. Общую справочную информацию о CYP2C19 в базе знаний KNMP или на сайте www.knmp.nl (поиск по ключевому слову «фармакогенетика»).
Другие соображения:
Связь между концентрацией в плазме и эффективностью и побочными эффектами не установлена. Риск индуцированного эсциталопрамом удлинения интервала QT и torsades de pointes зависит от дозы и, следовательно, от концентрации в плазме.
Верхний предел терапевтического диапазона эсциталопрама составляет 250 нг / мл.
Клинические последствия:
Одно исследование показало, что интервал QTc не увеличивался в группе из одного пациента PM и 21 пациента IM. Группа IM + PM и группа EM не были сопоставимы, потому что процент женщин был значительно ниже среди пациентов IM + PM, чем среди пациентов с EM. У женщин интервал QTc был на 3,7% длиннее, чем у мужчин. Процент пациентов, использующих субстраты, ингибиторы или индукторы CYP2C19, был значительно выше среди пациентов с IM + PM.Наблюдалась тенденция к увеличению интервала QTc на 2,8% среди пациентов, принимавших этот комбинированный препарат.
Исследование с участием шести пациентов с ПМ не обнаружило разницы между генотипами с точки зрения побочных эффектов и процентной доли пациентов, выбывших из исследования. В другом исследовании не было обнаружено различий в неврологических, психологических и «других» побочных эффектах для группы из 23 пациентов с IM + PM через одну неделю. Оценка автономных побочных эффектов, например потоотделение и желудочно-кишечные симптомы через неделю были ниже, но это, вероятно, не имеет клинического значения.
Не было различий в дозах, обусловленных побочными эффектами и эффектами.
Три исследования не обнаружили разницы в ответах у пациентов с депрессией (одно включало 16 ПМ, одно – девять ПМ и одно – 23 ВМ + ПМ). Исследование, включавшее одного ПМ с периферической невропатией, не обнаружило разницы в ответе. Исследование, включавшее группу из 22 IM и одного PM с расстройством аутистического спектра, не обнаружило разницы в ответах.
Кинетические последствия:
Концентрация в плазме увеличилась на 67-470%.
AUC0-24ч увеличился на 86%.
ФЛЕКАИНИД
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетическая изменчивость увеличивает превращение флекаинида в неактивные метаболиты. В результате может потребоваться более высокая доза.
Рекомендация:
Нет данных о фармакокинетике и / или влиянии флекаинида на УМ.
- контролировать концентрацию в плазме в качестве меры предосторожности и записывать ЭКГ или выбирать альтернативу.
Примеры антиаритмических препаратов, которые не метаболизируются посредством CYP2D6 (или в меньшей степени), включают соталол, дизопирамид, хинидин и амиодарон.
Механизм:
R-энантиомер флекаинида метаболизируется CYP2D6, S-энантиомер метаболизируется другими путями. Это приводит к образованию фармакологически неактивных метаболитов мета-O-дезалкил флекаинида и мета-O-дезалкиллактам флекаинида.
Терапевтический диапазон включает плазменные концентрации флекаинида 200-1000 нг / мл.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (найдите CYP2D6).
Клинические последствия:
Теоретически риск снижения эффективности увеличивается с уменьшением концентрации флекаинида в плазме.
Кинетические последствия:
Теоретически концентрация флекаинида в плазме снижается, когда метаболическая активность CYP2D6 увеличивается.
ГАЛОПЕРИДОЛ
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм приводит к увеличению метаболической емкости CYP2D6, что может вызывать снижение плазменных концентраций галоперидола и активного метаболита, сниженного галоперидола.
Рекомендация:
Дать обоснованный совет по корректировке дозы невозможно из-за ограниченного количества доступной литературы.
- Сообщите лицу, выписывающему рецепт:
- , будьте бдительны в отношении возможных пониженных концентраций галоперидола и пониженного галоперидола в плазме и увеличьте дозу на основе результатов терапевтического мониторинга лекарственных средств,
- или назначьте альтернативу в соответствии с действующими руководящими принципами.
Антипсихотические средства, которые не метаболизируются через CYP2D6 – или в гораздо меньшей степени – включают, например, флупентиксол, флуфеназин, кветиапин, оланзапин или клозапин.
- , будьте бдительны в отношении возможных пониженных концентраций галоперидола и пониженного галоперидола в плазме и увеличьте дозу на основе результатов терапевтического мониторинга лекарственных средств,
Механизм:
Галоперидол в основном метаболизируется посредством глюкуронизации и в меньшей степени посредством CYP3A4, CYP2D6 и восстановления карбонила. Активный метаболит, восстановленный галоперидол, может снова окисляться до галоперидола с помощью CYP2D6 и CYP3A4.
Повышенное соотношение восстановленный галоперидол / галоперидол связано с возникновением побочных эффектов.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (поиск по ключевому слову “фармакогенетика”).
Клинические последствия:
Симптомы улучшаются меньше, чем для других фенотипов.
Теоретически риск снижения эффективности терапии увеличивается при снижении концентрации галоперидола и активного метаболита в плазме крови. Риск побочных эффектов увеличивается при увеличении соотношения восстановленный галоперидол / галоперидол.
Кинетические последствия:
Галоперидол: снижение концентрации в плазме на 4% после перорального приема и на 35% после введения в виде внутримышечного депо, повышение перорального клиренса на 18%.
Сниженный галоперидол: увеличение концентрации в плазме на 260%.
Соотношение концентрации в плазме восстановленного галоперидола / галоперидола: увеличение на 367%.
ИМИПРАМИН
Причина: СЛОЖНЫЙ МЕТАБОЛИЗАТОР CYP2C19
Генетический полиморфизм приводит к снижению метаболической емкости CYP2C19, что может вызывать повышение концентрации имипрамина в плазме.
Рекомендация:
- Снизьте дозу до 70% от стандартной и контролируйте концентрации имипрамина и дезипрамина в плазме или выберите альтернативу.
Антидепрессанты, которые не метаболизируются или в меньшей степени метаболизируются через CYP2C19, включают, например, флувоксамин и миртазапин.
Механизм:
Основными путями метаболизма имипрамина являются N-метилирование главным образом CYP2C19 до активного метаболита дезипрамин и гидроксилирование CYP2D6 до 2-гидроксиимипрамина. Дезипрамин метаболизируется CYP2D6 до 2-гидроксидезипрамина.
Фенотип PM приводит к отсутствию активности CYP2C19.
Для получения дополнительной информации о фенотипе PM: см. Общую справочную информацию о CYP2C19 в банке знаний KNMP или на сайте www.knmp.nl (поиск по ключевому слову «фармакогенетика»).
Другие соображения:
Терапевтическая эффективность и побочные эффекты имипрамина связаны с концентрацией в плазме суммы имипрамина и дезипрамина.
Клинические последствия:
Одно исследование показало незначительное увеличение терапевтического эффекта (на 10%) и побочных эффектов (на 42%).
Кинетические последствия:
Повышение концентрации имипрамина плюс дезипрамин в плазме на 17-85%.
Повышение AUC имипрамина плюс дезипрамина на 36%.
Генетический полиморфизм приводит к увеличению метаболической емкости CYP2D6, что может вызывать снижение плазменных концентраций имипрамина и дезипрамина и повышение плазменной концентрации гидроксиметаболитов.
Рекомендация:
- выберите альтернативу
Антидепрессанты, которые не метаболизируются через CYP2D6 – или в меньшей степени – включают, например, циталопрам и сертралин. - , если альтернативный вариант невозможен: увеличьте дозу до 170% стандартной дозы и проверьте плазменные концентрации имипрамина и дезипрамина перед установкой поддерживающей дозы
Механизм:
Имипрамин и активный метаболит дезипрамин в основном преобразуются посредством CYP2D6 в неактивные гидроксиметаболиты.Имипрамин в основном преобразуется изоферментом CYP2C19 в дезипрамин.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Клинические последствия:
Теоретически риск снижения эффективности терапии возрастает при снижении концентрации имипрамина и дезипрамина в плазме крови.
Кинетические последствия:
Концентрация имипрамина + дезипрамин в плазме: снижение на 41%.
ИМИПРАМИН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм приводит к снижению метаболической емкости CYP2C19, что может вызывать повышение концентрации имипрамина в плазме.
Рекомендация:
- Снизьте дозу до 70% от стандартной и контролируйте концентрации имипрамина и дезипрамина в плазме или выберите альтернативу.
Антидепрессанты, которые не метаболизируются или в меньшей степени метаболизируются через CYP2C19, включают, например, флувоксамин и миртазапин.
Механизм:
Основными путями метаболизма имипрамина являются N-метилирование главным образом CYP2C19 до активного метаболита дезипрамин и гидроксилирование CYP2D6 до 2-гидроксиимипрамина. Дезипрамин метаболизируется CYP2D6 до 2-гидроксидезипрамина.
Фенотип PM приводит к отсутствию активности CYP2C19.
Для получения дополнительной информации о фенотипе PM: см. Общую справочную информацию о CYP2C19 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Другие соображения:
Терапевтическая эффективность и побочные эффекты имипрамина связаны с концентрацией в плазме суммы имипрамина и дезипрамина.
Клинические последствия:
Одно исследование показало незначительное увеличение терапевтического эффекта (на 10%) и побочных эффектов (на 42%).
Кинетические последствия:
Повышение концентрации имипрамина плюс дезипрамин в плазме на 17-85%.
Повышение AUC имипрамина плюс дезипрамина на 36%.
Генетический полиморфизм приводит к увеличению метаболической емкости CYP2D6, что может вызывать снижение плазменных концентраций имипрамина и дезипрамина и повышение плазменной концентрации гидроксиметаболитов.
Рекомендация:
- выберите альтернативу
Антидепрессанты, которые не метаболизируются через CYP2D6 – или в меньшей степени – включают, например, циталопрам и сертралин. - , если альтернативный вариант невозможен: увеличьте дозу до 170% стандартной дозы и проверьте плазменные концентрации имипрамина и дезипрамина перед установкой поддерживающей дозы
Механизм:
Имипрамин и активный метаболит дезипрамин в основном преобразуются посредством CYP2D6 в неактивные гидроксиметаболиты.Имипрамин в основном преобразуется изоферментом CYP2C19 в дезипрамин.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Клинические последствия:
Теоретически риск снижения эффективности терапии возрастает при снижении концентрации имипрамина и дезипрамина в плазме крови.
Кинетические последствия:
Концентрация имипрамина + дезипрамин в плазме: снижение на 41%.
МЕРКАПТОПУРИН
Причина: НЕДОСТАТОЧНЫЙ МЕТАБОЛИЗАТОР TPMT
МЕТОПРОЛОЛ
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Вариация гена увеличивает превращение метопролола в неактивные метаболиты. Это может увеличить требуемую дозу. Однако при целевой дозе 200 мг / день не наблюдалось никакого эффекта на кровяное давление и почти никакого эффекта на снижение частоты сердечных сокращений.
Рекомендация:
- используйте максимальную дозу для соответствующего показания в качестве целевой дозы
, если эффективность все еще недостаточна: увеличьте дозу в зависимости от эффективности и побочных эффектов до 2.5-кратная стандартная доза или выберите альтернативу.
Возможные альтернативы:- СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ: бисопролол или карведилол. Бисопролол: преимущество: не метаболизируется CYP2D6; Недостаток: устранение зависит от функции почек. Карведилол: преимущество: выведение не зависит от функции почек; Недостаток: метаболизируется (в меньшей степени, чем метопролол) CYP2D6.
- ДРУГИЕ ПОКАЗАНИЯ: атенолол или бисопролол. Ни один из них не метаболизируется CYP2D6.
Механизм:
Метопролол в основном метаболизируется CYP2D6 до O-десметилметопролола и затем до α-гидроксиметопролола.Активный S-энантиомер метопролола метаболизируется CYP2D6 в меньшей степени, чем менее активный R-энантиомер метопролола.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в базе знаний KNMP или на сайте www.knmp.nl (введите ключевое слово «фармакогенетика»).
Клинические последствия:
Артериальное давление: Два исследования (пациенты с гипертонией и здоровые испытуемые) не обнаружили влияния на систолическое и диастолическое артериальное давление.
Частота сердечных сокращений: Одно исследование с участием пациентов с гипертонией и целевой дозой 200 мг / день показало снижение частоты сердечных сокращений на 2%. Одно исследование с участием пациентов с недавно перенесенным острым инфарктом миокарда и низкой дозой 0,9 мг / кг в день почти не обнаружило терапевтического эффекта (снижение частоты сердечных сокращений с 78 до 69 ударов в минуту). Распространенность нарушения желудочкового ритма увеличилась от 11 до 22%. В исследовании с участием субъектов, получивших однократную дозу 100 мг, частота сердечных сокращений при нагрузке не отличалась для ЭМ, но падение частоты сердечных сокращений в состоянии покоя уменьшилось на 14%.
Кинетические последствия:
Снижение концентрации в плазме на 70-79%.
Снижение AUC на 40-49%, снижение AUC S-метопролола на 48%.
НОРТРИПТИЛАЙН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм приводит к увеличению метаболической емкости CYP2D6, что может вызвать снижение концентрации нортриптилина в плазме и повышение концентрации активного метаболита E-10-OH-нортриптилина в плазме.
Рекомендация:
- выберите альтернативу
Антидепрессанты, которые не метаболизируются через CYP2D6 – или в меньшей степени – включают, например, циталопрам и сертралин. - Если альтернативный вариант невозможен:
- увеличить дозу до 160% от стандартной дозы и контролировать концентрацию нортриптилина в плазме
- Будьте внимательны к ожидаемому увеличению концентрации в плазме возможно кардиотоксичного активного метаболита E- 10-гидроксинортриптилин
Механизм:
Нортриптилин в основном метаболизируется CYP2D6 до активного метаболита E-10-гидроксинортриптилина.Этот метаболит примерно вдвое слабее самого нортриптилина. Нортриптилин превращается через CYP2D6 и CYP2C19 в неактивный метаболит десметилнортриптилин.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Прочие соображения:
Е-10-гидроксинортриптилин примерно вдвое слабее исходного вещества в ингибировании захвата норадреналина.Он имеет гораздо более низкую антихолинергическую активность, чем нортриптилин, и связан с кардиотоксичностью.
Клинические последствия:
Для одного пациента дозу нортриптилина пришлось увеличить до 500 мг / день (в 3-5 раз больше стандартной дозы), чтобы достичь терапевтических концентраций в плазме и получить ответ.
Теоретически риск кардиотоксических метаболитов увеличивается с увеличением концентрации Е-10-гидроксинортриптилина в плазме, а риск снижения эффективности терапии увеличивается с уменьшением концентрации нортриптилина в плазме.
Кинетические последствия:
В исследованиях AUC нортриптилина снизилась на 23-41%, а пероральный клиренс увеличился на 85%.
С 3 функциональными аллелями: для нортриптилина увеличение клиренса на 62–315% и уменьшение периода полувыведения на 12%.
С 13 функциональными аллелями: для нортриптилина увеличение клиренса на 325% и уменьшение периода полувыведения на 8%.
ОКСИКОДОН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм увеличивает превращение оксикодона в более активный метаболит оксиморфон.Однако облегчение боли без усиления побочных эффектов обычно достигается, когда дозирование осуществляется с учетом боли.
Рекомендация:
- Будьте внимательны к побочным эффектам (таким как сонливость, спутанность сознания, запор, тошнота и рвота, угнетение дыхания или задержка мочи) и / или
- посоветуйте пациенту обратиться к своему врачу в случае побочных эффектов.
Механизм:
Оксикодон частично превращается CYP3A4 в нороксикодон и CYP2D6 в оксиморфон.Оксиморфон примерно в 14 раз превышает анальгетическую активность оксикодона, а нороксикодон – примерно в 0,01 раза.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP.
Клинические последствия:
У одного пациента развилась бессонница, беспокойство и повышенная настороженность при двукратном применении 10 мг оксикодона.
Нет клинических исследований, в которых проводилось бы прямое сравнение UM и EM (есть только сравнения более чем 2 групп).Одно исследование с участием онкологических больных не показало влияния генотипа CYP2D6 на усталость, тошноту, когнитивные функции и депрессию. Одно исследование с участием здоровых добровольцев, которым была введена однократная доза, показало усиление седативного эффекта и снижение функционирования в психомоторном тесте (замена числовых цифр) с увеличением дозы гена.
Послеоперационное исследование показало снижение кумулятивного потребления оксикодона до 12 часов после операции и эквивалентной анальгетической дозы по сравнению с пиритрамидом при увеличении дозы гена.В исследовании, включающем однократную дозу на кг массы тела, болевой порог при воздействии ледяной воды и при электрической стимуляции нервов увеличивался с увеличением дозы гена.
Кинетические последствия:
Снижение дозы на 6,7% привело к незначительному увеличению средней концентрации оксиморфона в сыворотке на 44% по сравнению с EM + IM. Увеличение концентрации в сыворотке было значительным для тренда PM, EM + IM, UM.
Не было значительного снижения средней концентрации оксикодона в сыворотке с увеличением дозы гена.
ПАРОКСЕТИН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Конверсия пароксетина ферментом CYP2D6 увеличивается в результате генетической изменчивости. Это может снизить эффективность.
Рекомендация:
Невозможно дать обоснованный совет по корректировке дозы на основе литературы.
- Если возможно, выберите альтернативный
Антидепрессанты, которые не метаболизируются CYP2D6, или, в меньшей степени, включают, например, циталопрам или сертралин.
Механизм:
Пароксетин в основном метаболизируется CYP2D6 до неактивных метаболитов.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (поиск CYP2D6).
Клинические последствия:
Не было терапевтической эффективности в 100% UMs, для которых была определена терапевтическая эффективность (n = 6).
Кинетические последствия:
Концентрация в плазме снизилась на ≥ 91%.Для 71% UMs, где определялась концентрация в плазме (n = 7), это значение было ниже предела обнаружения после стандартных доз пароксетина.
Увеличение максимальной скорости метаболизма (Vm) на 708%.
Повышение перорального клиренса с увеличением дозы гена, особенно при низких дозах.
ПРОПАФЕНОН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетическая изменчивость снижает сумму плазменных концентраций пропафенона и активного метаболита 5-гидроксипропафенона.Это увеличивает риск снижения эффективности или ее отсутствия.
Рекомендация:
Предложить адекватно обоснованные рекомендации по корректировке дозы на основе литературы невозможно.
- Следите за концентрацией в плазме, выполняйте ЭКГ и будьте внимательны к снижению эффективности терапии.
- Или выберите альтернативу.
Антиаритмические препараты, которые практически не метаболизируются CYP2D6, включают, например, соталол, дизопирамид, хинидин и амиодарон.
Механизм:
Пропафенон метаболизируется CYP2D6 до эквивалентного метаболита 5-гидроксипропафенона. Он превращается CYP1A2 и CYP3A4 в N-депропилпропафенон, который менее активен.
Пропафенон – ингибитор CYP2D6. Таким образом, фармакокинетика пропафенона нелинейна.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Клинические последствия:
Исследование с участием 5 пациентов с УМ показало, что пропафенон неэффективен в качестве профилактического средства при пароксизмальной фибрилляции предсердий; исследование с участием 3 пациентов с UM не обнаружило влияния на эффективность профилактической терапии предсердной тахиаритмии (67% у пациентов UM по сравнению с 69% у пациентов с EM).
Теоретически риск снижения эффективности увеличивается с уменьшением суммы концентраций пропафенона и 5-гидроксипропафенона в плазме.
Кинетические последствия:
Концентрация пропафенона в плазме снизилась на 61%.
Теоретически увеличивается концентрация 5-гидроксипропафенона в плазме.
SERTRALINE
Причина: СЛОЖНЫЙ МЕТАБОЛИЗАТОР CYP2C19
Вариация гена приводит к увеличению концентрации сертралина и активного метаболита десметилсертралина в плазме крови.Это увеличивает риск побочных эффектов.
Рекомендация:
- Не давайте дозу, превышающую 50 мг / день.
- Выбирайте дозу в зависимости от реакции и побочных эффектов и / или концентрации сертралина плюс десметилсертралин в плазме.
Механизм:
Сертралин в основном преобразуется CYP2C19 в активный метаболит десметилсертралин, который также преобразуется преимущественно CYP2C19.
Для получения дополнительной информации о фенотипе PM: см. Общую справочную информацию о CYP2C19 в базе данных KNMP Knowledge Database или на сайте www.knmp.nl (поиск по ключевому слову «фармакогенетика»).
Прочие соображения:
Хотя десметилсертралин менее активен, чем сертралин, сумма концентраций сертралина и десметилсертралина используется для терапевтического мониторинга лекарственных средств (терапевтический диапазон: 50–250 нг / л).
Клинические последствия:
У одного из двух пациентов, участвовавших в исследовании, развились соответствующие побочные эффекты.
У двух из шести пациентов с ПМ в другом исследовании, включающем однократное введение сертралина, развились серьезные желудочно-кишечные расстройства и побочные эффекты, затрагивающие центральную нервную систему.
Исследование с участием 2-х дневных пациентов не показало связи между предсказанной генотипом активностью CYP2C19 и побочными эффектами. Если сумма концентраций сертралина и десметилсертралина в плазме также влияет на побочные эффекты, эта связь, однако, осложняется тем фактом, что концентрация сертралина в плазме снижается, а концентрация десметилсертралина увеличивается у пациентов с генотипом UM (повышенная активность), в отличие от PM и IM. пациенты, у которых оба увеличиваются.
Это же исследование обнаружило незначительную тенденцию к ассоциации между предсказанной генотипом активностью CYP2C19 и ответом.
Кинетические последствия:
Исследование, в котором участвовали пациенты в 17:00, показало 277% -ное увеличение концентрации сертралина плюс десметилсертралин в плазме с поправкой на дозу, что обусловлено увеличением сертралина на 193% и десметилсертралина на 315%.
Другое исследование сообщило об увеличении концентрации сертралина в плазме на 112% по сравнению с EM + IM, а SPC заявляет об увеличении на 50%.
Исследование с участием 1-го пациента не показало связи между предсказанной генотипом активностью CYP2C19 и скорректированными по дозе концентрациями сертралина и десметилсертралина в плазме.
Это НЕ взаимодействие гена с лекарством.
Механизм:
Сертралин в основном превращается CYP2C19 в неактивный метаболит десметилсертралин. Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Клинические последствия:
–
Кинетические последствия:
Кинетические последствия для UM отсутствуют.
Однако одно исследование с PM и EM не обнаружило влияния активности CYP2D6 на AUC и период полувыведения.
ТИОГУАНИН
Причина: НЕДОСТАТОЧНЫЙ МЕТАБОЛИЗАТОР TPMT
Генетическая изменчивость снижает превращение тиогуанина в неактивные метаболиты. Это увеличивает риск серьезных, опасных для жизни нежелательных явлений, таких как миелосупрессия.
Рекомендация:
- Выберите альтернативу или начните с 6-7% стандартной дозы
При любой корректировке начальной дозы следует руководствоваться токсичностью (мониторинг показателей крови) и эффективностью.
Следует увеличить частоту мониторинга. - Если доза снижена: посоветуйте пациентам обратиться за медицинской помощью при развитии симптомов миелосупрессии (таких как сильная боль в горле в сочетании с лихорадкой, регулярные кровотечения из носа и склонность к синякам)
Механизм:
Тиогуанин является неактивным пролекарством, которое превращается в активные метаболиты (нуклеотиды тиогуанина) ферментом гипоксантин-гуанинфосфорибозилтрансферазой (HGPRT). Два катаболических пути снижают биодоступность тиогуанина для образования тиогуаниновых нуклеотидов.Тиопуринметилтрансфераза (TPMT) катализирует S-метилирование тиогуанина. Тиогуанин превращается в неактивные метаболиты 6-тиоксантин, а затем в 6-тиуриновую кислоту ферментами гуаназой и ксантиноксидазой (XO) соответственно. Для получения дополнительной информации о фенотипе PM: см. Общую справочную информацию о TPMT в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Клинические последствия:
Ремиссия заболевания была достигнута у одного пациента PM с болезнью Крона без развития миелосупрессии с использованием 7.14% стандартной дозы (20 мг / 2 недели; 0,018 мг / кг / день). Стационарное начало тиогуанина у одного пациента с острым лимфобластным лейкозом привело к получению 6,25% стандартной дозы (2,5 мг / м2). В одном сообщении описывается пациент, у которого развилась тяжелая и продолжительная панцитопения и миелосупрессия при стандартной дозе тиогуанина. Одно исследование показало, что варианты гена TPMT не были связаны с измененным риском синдрома обструкции синусоидальных синусоид печени, связанного с тиогуанином.
Кинетические последствия:
По сравнению с EM, в одном случае была обнаружена аналогичная концентрация активного метаболита (изменение во времени 0.В 5-1 раз больше средней концентрации EM) при 7,14% стандартной дозы (20 мг / 2 недели вместо 20 мг / день). Скорректированная на дозу концентрация активного метаболита была в 19 раз выше у одного пациента PM.
ТРАМАДОЛ
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм снижает превращение трамадола в метаболит с более сильным опиоидным действием. Это может привести к усилению побочных эффектов.
Рекомендация:
Поскольку общий обезболивающий эффект изменяется при изменении соотношения между исходным соединением и активным метаболитом, эффект снижения дозы нельзя предсказать с уверенностью.
- уменьшите дозу до 20-40% от стандартной
- , если снижение дозы не дает желаемого эффекта: выберите альтернативу
Не выбирайте кодеин, так как он противопоказан для CYP2D6 UM.
Ойкскодон также метаболизируется CYP2D6, но обычно дозу можно титровать, чтобы обеспечить адекватное обезболивание без побочных эффектов. - , если альтернатива не выбрана: посоветуйте пациенту обратиться к своему врачу в случае побочных эффектов (таких как сонливость, спутанность сознания, запор, тошнота и рвота, угнетение дыхания или задержка мочи).
Механизм:
Трамадол метаболизируется CYP2D6, CYP3A4 и путем глюкуронизации. Конверсия CYP2D6 приводит к образованию активного метаболита O-десметилтрамадола, (+) – энантиомер которого имеет в 300 раз большее сродство к µ-опиоидному рецептору, чем материнское вещество. Сам трамадол в первую очередь подавляет обратный захват норадреналина и серотонина. (+) – O-десметилтрамадол, по-видимому, играет доминирующую роль как в обезболивании, так и в побочных эффектах.
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP.
Клинические последствия:
Один случай, в котором возникли преходящие побочные эффекты: атаксия, расширение зрачка, скованность в руках и ногах, дрожь и дисфория.
Один случай угнетения дыхания и потери сознания при контролируемой пациентом анальгезии трамадолом.
Исследование с 11 UM показало повышение болевого порога и толерантности к боли. Кроме того, процент людей с тошнотой увеличился на 411%, и у одного человека была рвота, а у другого – учащенное сердцебиение.О значимости этих эффектов не сообщалось.
Кинетические последствия:
(+) – O-десметилтрамадол: увеличение AUC на 225-490%.
ВЕНЛАФАКСИН
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм приводит к увеличению метаболической емкости CYP2D6. Это может вызвать снижение плазменной концентрации венлафаксина и повышение плазменной концентрации активного метаболита О-десметилвенлафаксина.
Рекомендация:
- Будьте внимательны к возможному снижению суммы плазменных концентраций венлафаксина и активного метаболита О-десметилвенлафаксина
- , если необходимо, увеличьте дозу до 150% от стандартной дозы
- , если доза корректировка на основе терапевтического мониторинга лекарственных средств невозможна, следует выбрать альтернативу
Антидепрессанты, которые не метаболизируются CYP2D6 – или в меньшей степени – включают, например, циталопрам и сертралин.
Механизм:
Венлафаксин в основном превращается CYP2D6 в активный метаболит O-десметилвенлафаксин.
Венлафаксин и O-десметилвенлафаксин в основном превращаются CYP3A4 и CYP2C19 в неактивные метаболиты (N-десметилвенлафаксин и N, O-дидесметилвенлафаксин соответственно).
Для получения дополнительной информации о фенотипе UM: см. Общую справочную информацию о CYP2D6 в банке знаний KNMP или на сайте www.knmp.nl (выполните поиск по ключевому слову «фармакогенетика»).
Клинические последствия:
Одно исследование не обнаружило разницы в эффективности. В другом исследовании с 2 UM были 1 респондент и 1 не отвечающий. Теоретически риск снижения эффективности увеличивается при более низких концентрациях венлафаксина + активного метаболита в плазме.
В одном исследовании количество побочных эффектов снизилось незначительно на 39%. Другое исследование не обнаружило влияния на концентрацию натрия.
Кинетические последствия:
Концентрация венлафаксина + О-десметилвенлафаксина в плазме крови снижается на 24-41%.
Соотношение плазменных концентраций О-десметилвенлафаксина / венлафаксина увеличивается на 139–199%. Увеличение соотношения в первую очередь вызвано снижением концентрации венлафаксина в плазме крови.
ВОРИКОНАЗОЛ
Причина: СЛОЖНЫЙ МЕТАБОЛИЗАТОР CYP2C19
Вариация гена может снизить конверсию вориконазола и, как следствие, увеличить концентрацию в плазме. Это может привести к повышению эффективности или увеличению риска побочных эффектов.
Рекомендация:
- Контролировать концентрацию в плазме
Механизм:
Вориконазол преимущественно метаболизируется CYP2C19, а в противном случае – CYP2C9 и CYP3A4. Самый важный метаболит, вориконазол-N-оксид, неактивен.
Для получения дополнительной информации о фенотипе PM: см. Общую справочную информацию о CYP2C19 в банке знаний KNMP или на сайте www.knmp.nl (введите ключевое слово «CYP2C19»).
Другие соображения:
Несколько исследований указывают на более высокий риск гепатотоксичности при более высоких концентрациях вориконазола в плазме.
Кинетика вориконазола при терапевтических дозах нелинейна.
Клинические последствия:
Эффективность
Метаанализ 10 исследований, включающих в общей сложности 67 PM, выявил повышение эффективности лечения (ОР = 1,31). Исследование, не включенное в метаанализ с 19:00, не обнаружило эффекта для PM по сравнению с IM по сравнению с EM в ответе через 6 недель и в случае смерти во время лечения стандартными внутривенными дозами, пероральной дозой 300 мг 2 раза в день (или 150 мг 2 раза в день). ежедневно для пациентов с массой тела <40 кг) и разрешенной корректировки дозы в зависимости от ответа, побочных эффектов или минимальных концентраций.
Побочные эффекты
Метаанализ 10 исследований, включающих в общей сложности 67 PM, не выявил различий во всех побочных эффектах. Исследование, не включенное в метаанализ с 14:00, также не обнаружило разницы в побочных эффектах.
Метаанализ 10 исследований, включающих в общей сложности 67 PM, не выявил различий в нейротоксичности. Исследование, не включенное в метаанализ с 17:00, не обнаружило эффекта для PM по сравнению с IM по сравнению с EM по влиянию на психиатрические побочные эффекты при стандартных внутривенных дозах, пероральной дозе 300 мг 2 раза в день (или 150 мг 2 раза в день для пациентов < 40 кг) и допустимую корректировку дозы в зависимости от ответа, побочных эффектов или минимальных концентраций.
Мета-анализ 10 исследований, включающих в общей сложности 67 PM, не выявил различий в гепатотоксичности. Исследование, не включенное в метаанализ с 8 часами вечера и дозой в соответствии с SmPC, не обнаружило значительного увеличения – после корректировки смешивающих факторов – риска гепатотоксичности для PM по сравнению с IM по сравнению с EM. Исследование, не включенное в метаанализ с 19:00, не обнаружило эффекта для PM по сравнению с IM по сравнению с EM в отношении влияния на печеночные побочные эффекты при стандартных внутривенных дозах, пероральной дозе 300 мг 2 раза в день (или 150 мг 2 раза в день для пациентов < 40 кг) и допустимую корректировку дозы в зависимости от ответа, побочных эффектов или минимальных концентраций.Результаты тестирования функции печени были повышены у 1 пациента, получавшего вориконазол 600 мг / сут.
Минимальные концентрации
Исследование, включающее 15 PM и стандартную начальную дозу с последующим мониторингом терапевтических препаратов, обнаружило увеличение процента первых минимальных концентраций в терапевтическом диапазоне (1-5,5 мкг / мл) и частоты терапевтических минимальных концентраций и снижение процента субтерапевтических концентраций первого корыта (<1 мкг / мл) для PM по сравнению с IM по сравнению с EM.Все ТЧ в этом исследовании имели терапевтическую концентрацию первого минимума. В исследовании, включающем 42 в / м и 14 мкг и дозу 200-250 мг 2 раза в день, распределение по группам минимальной концентрации (<1 мкг / мл, 1-4 мкг / мл и> 4 мкг / мл) отличалось для IM + PM (меньше низких и более высоких минимальных концентраций), чем для EM.
Кинетические последствия:
Мета-анализ 10 исследований, включающих в общей сложности 67 PM, обнаружил значительное увеличение минимальной концентрации на 1,22 мкг / мл. В исследовании, не включенном в метаанализ, с 8 PM с дозой согласно SmPC было обнаружено значительное увеличение минимальной концентрации.В двух исследованиях, не включенных в метаанализ, было обнаружено значительное увеличение средней минимальной концентрации (1 исследование с 16:00 и дозой 200 мг 2 раза в день и 1 исследование с 1 педиатрическим PM и минимальными минимальными концентрациями с поправкой на дозу).
Минеральная концентрация увеличилась на 39-90%.
У детей пониженная концентрация увеличилась на 330%.
Средняя минимальная концентрация увеличилась на 29-80%.
Средняя минимальная концентрация у детей увеличилась на 933%. Начальная доза в этом исследовании была ниже для большинства пациентов, чем доза в «Детском формуляре» (детский формуляр).
Доза, необходимая для достижения терапевтических минимальных концентраций (1-5 мкг / мл), уменьшилась на 46%.
Средняя доза, необходимая для достижения минимальных терапевтических концентраций (1-5,5 мкг / мл) у детей / подростков, увеличилась на 7%.
AUC у детей увеличилась на 240%.
Средняя AUC у детей увеличилась на 140%.
У здоровых добровольцев AUC для вориконазола увеличилась на 159–480%, пероральный клиренс снизился на 65–75%, а период полувыведения увеличился на 69–244%.
ЦУКЛОПЕНТИКСОЛ
Причина: УЛЬТРАРАПИДНЫЙ МЕТАБОЛАЙЗЕР CYP2D6
Генетический полиморфизм приводит к увеличению метаболической емкости CYP2D6, что может вызвать снижение концентрации зуклопентиксола в плазме.
Рекомендация:
Не были опубликованы данные исследований фармакокинетики и эффектов зуклопентиксола для этого фенотипа.
- В качестве меры предосторожности врач, назначающий препарат, должен быть внимателен к снижению концентрации зуклопентиксола в плазме и, при необходимости, следует увеличить дозу в зависимости от клинического эффекта или назначить альтернативу в соответствии с действующими рекомендациями.
Нейролептики, которые не метаболизируются через CYP2D6 – или в меньшей степени – включают, например, флупентиксол, кветиапин, оланзапин и клозапин.
Механизм:
Зуклопентиксол в основном метаболизируется CYP2D6 до неактивных метаболитов.
Для получения дополнительной информации о фенотипе UM см. Общую справочную информацию о CYP2D6 в банке знаний KNMP.
Клинические последствия:
Теоретически риск снижения эффективности терапии увеличивается при снижении концентрации зуклопентиксола в плазме крови.
Кинетические последствия:
Теоретически концентрация зуклопентиксола в плазме снижена.
Заявление об ограничении ответственности и дополнительная информация
Руководящие принципы и вывод рекомендаций
Фармакогеномные рекомендации по дозировке основаны на руководящих принципах, разработанных Голландской рабочей группой по фармакогенетике (DPWG) Королевской голландской ассоциации фармацевтов (KNMP). Голландская рабочая группа по фармакогенетике формулирует оптимальные рекомендации для каждой фенотипической группы на основе имеющихся научных данных. Если эта оптимальная рекомендация не может быть соблюдена из-за практических ограничений, e.грамм. Терапевтический мониторинг лекарств или более низкая доза недоступны, врач должен рассмотреть следующий лучший вариант. Рекомендации не принимают во внимание какие-либо другие факторы, которые могут повлиять на фенотип пациента и реакцию на лекарства, такие как лекарственные взаимодействия, различные состояния здоровья или факторы окружающей среды. Отсутствие рекомендации по конкретному лекарству не следует приравнивать к общему отсутствию вариантов, которые могут повлиять на индивидуальную реакцию на это лекарство, поскольку у пациента может быть более редкий вариант, который в настоящее время не охвачен тестом на генотипирование U-PGx.Настоящий инструмент сопоставляет фенотипы с терапевтическими рекомендациями. Ответственность за определение правильных фармакогеномных фенотипов на основе необработанных генетических данных лежит исключительно на пользователе.
База данных, содержащая аннотации и рекомендации для создания этого отчета, постоянно обновляется по мере появления новых научных данных. Следовательно, информация, включенная в этот отчет, зависит от даты создания отчета.
Дополнительная информация о рекомендациях по пероральным / вагинальным контрацептивам с эстрогенами
Рекомендация относится ко всем гормональным контрацептивам, содержащим эстроген, для системного применения.Это включает, но не ограничивается ими, комбинированные препараты эстрогенов (например, этинилэстрадиол, эстрадиол) со следующими прогестагенами: ципротерон, дезогестрел, диеногест, дроспиренон, этоногестрел, гестодин, левоноргестрел, номегестрол, норелгестератромин, норетимонатромин.
Происхождение и развитие паспорта PGx
Паспорт PGx был разработан с целью позволить продолжить научно обоснованное дозирование лекарств под контролем фармакогеномики за пределами проекта U-PGx.В проекте U-PGx (http://www.upgx.eu) упреждающее фармакогеномное тестирование для выбора лекарств и доз было реализовано в рамках клинического исследования в семи европейских странах, чтобы предоставить доказательства влияния фармакогеномных назначений на исходы для пациентов. Этот инструмент с открытым исходным кодом был разработан в соответствии с целью проекта – сделать эффективную оптимизацию лечения доступной для каждого гражданина Европы.
Показать фармакогеномные данные
| Ген / фенотип |
|---|
| Ген / фенотип CYP2C19 НЕДОСТАТОЧНЫЙ МЕТАБОЛИЗАТОР |
| Ген / фенотип УЛЬТРАРАПИДНЫЙ МЕТАБОЛИЗАТОР CYP2D6 |
| Ген / фенотип TPMT ПЛОХОЙ МЕТАБОЛИЗАТОР |
внезапно стал RAW – неизвестный Kadath
ОБНОВЛЕНО Как исправить: внешний диск внезапно стал RAW
ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ: В этих примерах используются методы, которые я действительно использую в реальном мире для решения реальных проблем.Они могут быть неправильными или опасными. Они могут быть неэффективными. Если вы попробуете их сами, это может привести к повреждению или невосполнимому ущербу. Я не несу ответственности ни за что, что вы делаете на основании моих примеров или информации, которую я здесь предоставляю.
Прошло уже больше года с момента последнего обновления моего сообщения о «Восстановление внешнего жесткого диска, который внезапно стал RAW» , и произошли некоторые существенные изменения.
- PartedMagic больше не бесплатный
- Жесткие диски емкостью более 500 ГБ стали обычным явлением
- TestDisk стал еще лучше
- Было опубликовано много-много комментариев от людей, в которых показаны общие проблемы, не решенные напрямую в исходном сообщении.
Итак, имея в виду все это, вот исправленная версия, которая, как мы надеемся, устраняет некоторые недостатки сообщения, которое было первоначально выпущено в январе 2013 года.
Распространенная и сбивающая с толку проблема компьютеров – внезапное и, казалось бы, необъяснимое исчезновение внешнего жесткого диска, который функционировал должным образом. Когда вам внезапно говорят, что ваши данные, часто незаменимые изображения и документы, могут быть навсегда утеряны, это может быть захватывающим событием.
Как и во многих подобных жизненных ситуациях, правильная реакция – «Не паникуйте». При разумном и внимательном подходе ситуация может быть разрешена, и данные будут сохранены чаще, чем нет. Здесь мы рассмотрим причины, исправления и профилактические меры для случаев, когда внешние диски используются с Windows XP и Windows Vista / 7/8.
Сообщения об ошибках
Распространенные сообщения об ошибках, связанные с внезапной невозможностью доступа к внешнему жесткому диску.
| Windows XP | Windows 7 |
| НЕ ФОРМАТИРУЙТЕ ПРИВОД | |
При попытке доступа к диску в Windows вы можете увидеть сообщение с просьбой отформатировать диск НЕ ФОРМАТИРУЙТЕ ДИСК
Перед использованием диск в приводе необходимо отформатировать.
Отформатировать?
Другая ошибка, которую вы можете увидеть при попытке получить доступ к диску в Windows из программы или командной строки:
Этот том не содержит распознанной файловой системы.Убедитесь, что все необходимые драйверы файловой системы загружены и том не поврежден.
Попытка запустить chkdsk для устранения проблемы также приведет к ошибке…
chkdsk не может быть запущен на диске
Тип файловой системы - RAW.
CHKDSK недоступен для дисков RAW.
В окне «Управление дисками» раздел отображается как RAW или без файловой системы.
| Свойства диска показывают, что и используемое, и свободное пространство имеют размер 0 байт для необработанного диска | |
| Windows XP | Windows 7 |
Что означает раздел RAW
Файловая система RAW просто означает, что это файловая система, не распознаваемая Windows.Поэтому все доступные драйверы файловой системы не могут смонтировать файловую систему как диск. Это часто происходит, когда записи, определяющие тип файловой системы или расположение на диске, повреждены или повреждены, обычно это таблица разделов или загрузочный сектор.
Поскольку Windows не видит файловой системы в разделе, она предлагает отформатировать его, чтобы создать на нем файловую систему. НЕ ФОРМАТИРУЙТЕ ЕГО.
Почему это происходит и как этого избежать
Наиболее частая причина того, что внешние жесткие диски внезапно становятся дисками в формате RAW, – это их отсоединение от компьютера без использования опции «Безопасное извлечение оборудования».Это может произойти по-разному, например, сбой питания, отключение накопителя от USB-порта или адаптера переменного тока, проблема с компьютером, которая приводит к временному отключению USB-концентраторов, и многие другие обстоятельства могут привести к этому.
Всегда используйте «Безопасное извлечение оборудования» для отключения привода. Щелкните левой кнопкой мыши значок на панели задач, выберите устройство в меню и дождитесь сообщения с подтверждением.
Как это исправить
В этом примере я выбрал наиболее сильно поврежденный диск с этой проблемой, который я смог найти в моей коллекции поврежденных дисков.У него есть обе самые распространенные проблемы. Таблица разделов повреждена, и загрузочный сектор основного раздела также зашифрован. Изображения сообщений об ошибках, прежде всего, были получены с этого диска. Приведенные ниже изображения процесса ремонта взяты из фактического ремонта этого привода. Некоторые изображения взяты с виртуальной машины (просто для облегчения получения снимков экрана), а некоторые – с реального рабочего стола. Это настоящий ремонт, а не фабричный образец.
Прежде чем продолжить, вы должны осознавать связанные с этим риски. Если проблема с накопителем не просто логическая ошибка, а проявление физического повреждения, то чем чаще вы используете его и пытаетесь отремонтировать, тем серьезнее может быть повреждение. Чтобы свести к минимуму риски, диск можно передать профессионалу, имеющему опыт ремонта такого типа. Привод не должен издавать странных щелчков или звуковых сигналов. Это означает, что определенно существует физический ущерб, и его следует отправить на предприятие с соответствующими инструментами и средой для его ремонта / восстановления, поскольку попытка восстановить его, как описано в этом сообщении, может ухудшить эту ситуацию.Если вы хотите продолжить самостоятельно, запомните три важных правила.
1. Проблемы с компьютером могут быть разными. Вы вполне можете придумать другую ситуацию, чем я описываю ниже. Убедитесь, что вы остановились и тщательно все обдумали, когда процесс станет другим, чем я описываю.
2. Вы, , НЕ ХОТИТЕ ЗАПИСАТЬ НИЧЕГО НА RAW DRIVE , кроме восстановленной MBR и восстановленного загрузочного сектора, если это необходимо. Любая другая запись может перезаписать данные на диске, которые вы хотели бы сохранить.
3. Этот ремонт не применяется к твердотельным дискам (SSD). Они сильно отличаются от обычных дисков и могут стереть важные данные в разделе RAW, просто подключив к ним питание.
ПРЕЖДЕ ЧЕМ РАБОТАЕТ, ВЫ ДОЛЖНЫ ПОПЫТАТЬСЯ ОПРЕДЕЛИТЬ, ЕСТЬ ЛИ ФИЗИЧЕСКИЕ ПОВРЕЖДЕНИЯ.
Если есть физическое повреждение, рассмотрите возможность отправки диска в профессиональную службу восстановления, поскольку физическое повреждение часто продолжает ухудшать качество данных, и простое включение диска может сделать данные безвозвратными.
Доступ и оценка S.M.A.R.T. жесткого диска Данные для определения наличия физического урона
Возможность эффективно анализировать S.M.A.R.T. данные на жестком диске (HDD) позволяют быстро выявлять проблемы, которые могут помочь вам восстановить все данные с него, прежде чем они станут безвозвратными или потребуют значительных затрат для извлечения.
S.M.A.R.T. расшифровывается как Self-Monitoring, Analysis and Reporting Technology и представляет собой запись жесткого диска о его внутреннем диагностическом мониторинге и статистике использования, упакованную для внешнего доступа.Основная цель S.M.A.R.T. предупреждает нас о надвигающемся отказе диска, пока есть время для сохранения данных. Когда жесткий диск сообщает, что S.M.A.R.T. health is FAILED, вы должны немедленно удалить с него важные данные и больше не использовать диск.
ВАЖНО ПОНИМАТЬ, что РАЗЛИЧНЫЕ ПРОИЗВОДИТЕЛИ И РАЗЛИЧНЫЕ МОДЕЛИ ПРИВОДОВ МОГУТ ХРАНИТЬ И ОТОБРАЖАТЬ РАЗЛИЧНЫЕ ПОДСТАВКИ S.M.A.R.T. ДАННЫЕ И РАССЧИТЫВАЙТЕ ЗНАЧЕНИЯ И ДОПУСКИ ПО-РАЗНОМУ.
С.M.A.R.T. данные лучше всего использовать в качестве общего руководства. Для уточнения деталей обратитесь к технической документации жесткого диска. Иногда эту информацию трудно получить, и она может быть конфиденциальной. Например, бывает очень сложно найти формулы для расчета нормализованных значений атрибутов некоторыми производителями.
Запись в Википедии о S.M.A.R.T.
Правильный анализ S.M.A.R.T. данные
- Может помочь определить, является ли проблема физическим или просто логическим повреждением.
- При логическом повреждении накопителю можно доверять и продолжать его использование после ремонта.
- При физическом повреждении вы хотите удалить с диска все важные данные и заменить его.
- Помогает выбрать лучший метод восстановления всех данных с диска.
- Предотвращает случайное выполнение действий, которые могут ухудшить положение.
Для проверки S.M.A.R.T. данные на HDD
- Привод не должен издавать странных щелчков или звуковых сигналов.Это означает, что определенно имеется физический ущерб, и его следует отправить на предприятие с соответствующими инструментами и средой для его ремонта / восстановления.
- Диск должен быть доступен BIOS компьютера во время POST (отвечает на команду ATA IDENTFY_DEVICE). Другими словами, диск должен быть виден в Windows.
- В случае внешних накопителей, подключенных через USB, они должны быть обнаружены компьютерным программным обеспечением Plug and Play (отвечает на команду ATA IDENTFY_DEVICE).
Убедившись, что соединение между накопителем и
компьютером правильное и его качество является наилучшим, необходимо
проверить состояние самого накопителя. Тогда вы можете исключить физическое повреждение
, которое требует ремонта с помощью специализированных инструментов в контролируемой среде.
Что мы ищем
·
Привод издает звуки, которых не издавал раньше?
o
Громкий щелчок или периодический звуковой сигнал могут указывать на механическое повреждение
.Физическое повреждение может потребовать отправки диска на предприятие с соответствующими инструментами и оборудованием
для восстановления данных.
·
Есть ли у S.M.A.R.T. показать какие-либо ошибки или неверные значения атрибутов?
o
Мы смотрим на чистую стоимость S.M.A.R.T.
атрибутов с идентификаторами 5, 191 и 197.
·
Соответствует S.M.A.R.T. Краткая самопроверка?
o
Мы управляем S.M.A.R.T.
Краткое самотестирование.
Если он не проходит ни один из этих тестов, вам необходимо отнести его в лабораторию по восстановлению данных для профессионального восстановления, иначе вы рискуете ухудшить ситуацию.
Посмотреть S.M.A.R.T. данные с GSmartControl
Получите копию GSmartControl для Windows
http://sourceforge.net/projects/gsmartcontrol/files/0.8.7/gsmartcontrol-0.8.7-win32.zip/download
Распакуйте его и запустите gsmartcontrol.exe
Дважды щелкните диск и перейдите на вкладку АТРИБУТЫ.
- Если ID # 05 «Число перераспределенных секторов» указан и имеет RAW VALUE больше 5, то имеется физическое повреждение в виде сбойных секторов.
- Если ID # 191 G-sense Error Rate указан и имеет RAW VALUE больше 0, это означает, что диск упал или сильно ударился.
- Если ID # 197 указан в списке Current Pending Sector Count и имеет RAW VALUE больше 5, то имеется физическое повреждение в виде поврежденных секторов.
Затем щелкните вкладку ВЫПОЛНИТЬ ТЕСТЫ и выполните КОРОТКИЙ ТЕСТ. Если он не проходит проверку, значит, имеется физический ущерб.
Восстановить таблицу разделов и загрузочный сектор
Это может занять много часов, даже дней, для работы на больших жестких дисках емкостью более 500 ГБ
Когда я впервые написал это руководство, диски емкостью 1 ТБ были очень редкими.Сейчас они довольно распространены. Имейте в виду, что это может занять очень много времени. Вы можете делать другие вещи на своем компьютере, пока он работает, если только он не пытается использовать неисправный диск.
Если есть физическое повреждение, рассмотрите возможность отправки диска в профессиональную службу восстановления, поскольку физическое повреждение часто продолжает ухудшать качество данных, и простое включение диска может сделать данные безвозвратными.
Если нет никаких признаков физического повреждения, вы можете продолжить.Чтобы исправить наиболее распространенные проблемы, из-за которых внешний диск внезапно становится RAW, мы будем использовать TestDisk.
Загрузите Testdisk
http://www.cgsecurity.org/wiki/TestDisk_Download
и запустите testdisk_win.exe
TestDisk – это консольное приложение, поэтому для взаимодействия с ним вам придется использовать клавиатуру, а не мышь.
Выберите CREATE и нажмите Enter
. Убедитесь, что ваш внешний диск выделен
Выберите Продолжайте и нажмите ввод
Выберите Intel и нажмите Enter (есть небольшая вероятность, что раздел EFI GPT, если размер диска 2 ТБ или больше, и в нижней части этого экрана указано, что Подсказка: EFI GPT был обнаружен .В этом случае выберите EFI GPT и попробуйте это.)
Выберите Analyze и нажмите Enter
Данные раздела выглядят некорректно (объяснение, почему выходит за рамки этой статьи)
Выберите Quick Search и нажмите Enter
Скажите « Y », если он спросит, был ли диск создан в Vista / Win7 (даже если он был создан в XP, скажите «да»).
Теперь будет запущен быстрый поиск
Когда быстрый поиск завершится, мы увидим один раздел (если вы видите только опцию ПРОДОЛЖИТЬ в нижней части экрана, нажмите ENTER один раз, чтобы перейти к экрану, на котором вы должны быть).
Давайте посмотрим на данные на этом разделе, нажмите
P
, и вы должны увидеть список файлов / папок в разделе.
Хммм… Это похоже на набор диагностических инструментов, но не на наши недостающие данные. Нам нужно будет посмотреть дальше. Нажмите
Q
, чтобы вернуться на экран, а затем нажмите
введите
ЕСЛИ ВЫ ВИДИТЕ ВСЕ СВОИ ФАЙЛЫ, ПРОПУСТИТЕ ГЛУБОКИЙ ПОИСК И ПЕРЕЙДИТЕ К ШАГУ ВЫБОР ЗАПИШИТЕ
Чтобы перейти к этому экрану, выберите DEEPER SEARCH и нажмите Enter.
Естественно, более глубокий поиск занимает больше времени, чем быстрый поиск
Когда более глубокий поиск завершится, мы увидим два раздела. Тот, который мы видели после быстрого поиска, и еще один.
Выберите новый раздел и нажмите
P
, чтобы увидеть файлы / папки, и теперь мы видим данные, которые мы хотим снова сделать видимыми.
Нажмите
Q
, чтобы вернуться на экран, а затем нажмите , введите , чтобы перейти на этот экран.
Выберите WRITE и нажмите Enter, чтобы записать нашу новую таблицу разделов на диск.
НЕ ЗАПИСЫВАЙТЕ НОВУЮ ТАБЛИЦУ РАЗДЕЛОВ, ЕСЛИ ВЫ НЕ ВИДЕЛИ СВОИ ФАЙЛЫ / ПАПКИ Это означает, что правильная таблица разделов не была найдена, и вам придется попробовать другой метод восстановления данных.
Нажмите Y , чтобы подтвердить, что вы хотите записать новую таблицу разделов.
Как я упоминал в начале этого ремонта, на этом диске также есть повреждение в загрузочном секторе раздела, который мы снова пытаемся сделать видимым. В этом случае TestDisk остановится на этом этапе и попросит вас исправить это до того, как он закончит запись новой таблицы разделов.Если резервный загрузочный сектор в порядке (как в этом случае), просто выберите BACKUP BS и нажмите Enter. Если резервный загрузочный сектор тоже плохой, выберите ПЕРЕСТРОИТЬ BS.
Нажмите Y, чтобы подтвердить восстановление загрузочного сектора
Затем выберите ВЫЙТИ и нажмите ввод
Независимо от того, требуется ли восстановление загрузочного сектора или нет, вы окажетесь на этом экране, где все, что вы можете сделать, это нажать клавишу ввода. Затем нажимайте Q , пока не закончите TestDisk.
Теперь перезагрузите компьютер, чтобы увидеть, виден ли диск.
ПОМОГЛО ЛИ ВАМ ВОССТАНОВИТЬ ДАННЫЕ ЭТОТ ПОСТ? Пожалуйста, оставьте комментарий ниже и скажите «Это сработало», чтобы я мог оценить эффективность этого сообщения. Вы можете использовать поддельный адрес электронной почты, если хотите, я не собираюсь использовать его для рекламы.
Спасибо,
Джеймс
Вот результаты для привода, использованного в этом примере…
Сделайте резервную копию важных файлов и запустите chkdsk
Теперь вы должны сделать резервные копии всех важных файлов на диске на случай, если он снова выйдет из строя, а затем запустить chkdsk, чтобы исправить любые другие ошибки файловой системы, которые все еще могут существовать.
После резервного копирования важных файлов щелкните правой кнопкой мыши диск в проводнике Windows и выберите СВОЙСТВА . Перейдите на вкладку ИНСТРУМЕНТЫ и нажмите ПРОВЕРИТЬ СЕЙЧАС . Отметьте оба варианта и нажмите START .
Это мой любимый внешний диск для резервного копирования, поскольку он надежен, прочен и не шифрует ваши данные без вашего разрешения. Я сам ими пользуюсь.
Надеюсь, это решит вашу проблему. Пожалуйста, не стесняйтесь обращаться ко мне через контактную форму или комментарии, если у вас есть какие-либо вопросы или предложения по этому сообщению.
ПОМОГЛО ЛИ ВАМ ВОССТАНОВИТЬ ДАННЫЕ ЭТОТ ПОСТ? Пожалуйста, оставьте комментарий ниже и скажите «Это сработало», чтобы я мог оценить эффективность этого сообщения. Вы можете использовать поддельный адрес электронной почты, если хотите, я не собираюсь использовать его для рекламы.
Спасибо,
Джеймс
ОБНОВЛЕНИЕ: ИЮЛЬ 2017 г.
Я написал сообщение о простом способе создания образа вашего диска, на котором вы можете использовать TestDisk, чтобы вернуть файлы в случае, если плохие сектора затрудняют это сделать.Создайте образ, используя эту технику под названием image.dd, а затем вы можете открыть окно командной строки в папке TestDisk и ввести
testdisk_win.exe image.dd
, и он будет работать с файлом изображения так же, как и на диск. Дайте мне знать, если вы застрянете или у вас возникнут вопросы.
Что ж, вам нужно будет ввести пути, чтобы он работал. поэтому, если у меня есть testdisk_win.exe в папке C: \ testdisk, а мой файл image.dd находится на моем внешнем диске G: \, я бы набрал…
C: \ testdisk \ testdisk_win.exe G: \ image.dd
Вот сообщение…
Создание полного изображения сломанного, RAW, зараженного или зашифрованного жесткого диска с помощью бесплатных инструментов
.Создание полного изображения сломанного, RAW, зараженного или зашифрованного жесткого диска с помощью бесплатных инструментов


 Для этого есть стойка, на которой расположена шпиндельная бабка. В середине данного компонента находится коробка скоростей, представленная комбинированием зубчатых колес. Во время изготовления стойки и шпиндельной бабки применяется сталь, благодаря чему обеспечивается высокая защитная степень и маленький вес конструкции. Поверхность стали покрывается краской чтобы исключить допустимости возникновения коррозии при долгой эксплуатации в трудных условиях.
Для этого есть стойка, на которой расположена шпиндельная бабка. В середине данного компонента находится коробка скоростей, представленная комбинированием зубчатых колес. Во время изготовления стойки и шпиндельной бабки применяется сталь, благодаря чему обеспечивается высокая защитная степень и маленький вес конструкции. Поверхность стали покрывается краской чтобы исключить допустимости возникновения коррозии при долгой эксплуатации в трудных условиях. Стол передвигается по стойке в вертикальном направлении для обеспечения подачи заготовки.
Стол передвигается по стойке в вертикальном направлении для обеспечения подачи заготовки. Они предназначаются для управления столом и перекачивания охлаждающей жидкости в территорию резания.
Они предназначаются для управления столом и перекачивания охлаждающей жидкости в территорию резания.
 ..пропущен …
..пропущен … .. пропущено …
.. пропущено … Профили защиты личности могут быть нацелены на назначенных пользователей или устройства и применяться во время регистрации.
Профили защиты личности могут быть нацелены на назначенных пользователей или устройства и применяться во время регистрации. Когда вы выбираете Включено , дополнительные параметры для Windows Hello становятся видимыми и могут быть настроены для устройств.
Когда вы выбираете Включено , дополнительные параметры для Windows Hello становятся видимыми и могут быть настроены для устройств. После настройки этих параметров выберите Сохранить .
После настройки этих параметров выберите Сохранить .

